|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Para más información sobre cada apartado hacer click en:
|
Key words: Eurasian Eagle Owl, diet, hunting area and behaviour, intraguild predation, prey-predator relationships.
Ecología trófica La alimentación del búho real, su variación geográfica y la selección de presas han sido relativamente bien estudiadas en toda Europa y en la Península Ibérica (ver por ejemplo Ruiz Bustos y Camacho Muñoz, 1973; Hiraldo et al., 1975, 1976; Vericad et al., 1976; Herrera y Hiraldo, 1976; Pérez Mellado, 1978; Zamorano et al., 1986; Donázar, 1989a; Donázar y Ceballos, 1988; Donázar y Castién, 1989, Fernandez-Llario e Hidalgo de Trucios, 1995; Fernández y Pinedo, 1996; Lourenco, 2006). De manera resumida se puede describir al búho real como un cazador extremadamente ecléctico: en la dieta del búho real en Europa se han detectado aproximadamente más de 90 especies de mamíferos, 170 de aves, 10 de reptiles, 9 de anfibios, 30 de peces y 15 de invertebrados (Ver apéndice al final para las especies citadas en España). No obstante, en la Península Ibérica las presas más frecuentes son conejos y ratas. Por ejemplo, en Sierra Morena (Andalucía) la mayoría de la biomasa capturada fue conejo (64 ± 15%, N= 32 parejas, Delgado, Lourenço y Penteriani, datos no publicados), con un peso medio de 376 ± 90 g por presa. En el centro de España la biomasa ingerida procedente del conejo representa el 84% de la dieta (N= 20 parejas, Pérez Mellado, 1978). Además de conejos y ratas, otro grupo importante en la dieta del búho real son las perdices, especialmente en el centro de la península Ibérica (Hiraldo et al., 1975). Las aves y los mamíferos representan casi el 96% de las especies incluidas en la dieta, aunque hay variaciones provinciales (Tabla 1). Con la lista de especies identificadas en los estudios incluidos en la Tabla 1 se puede calcular el índice H de Shannon-Wiener y comprobar que H es similar en los estudios con mayor esfuerzo de recolección de egagrópilas (varios años y estaciones del año, identificación de especies exhaustiva, etc.): H = 2.6 (Hiraldo et al., 1975), H = 2.7 (Donázar et al., 1989a) y H = 2.5 (Serrano, 1998). La diversidad de la dieta de los búhos en Navarra (Donázar et al., 1989a) y Zaragoza (Serrano, 1998) fue semejante a la estimada a escala peninsular (Hiraldo et al., 1975).
Tabla 1. Frecuencia relativa de las presas identificadas en egagrópilas de búho real recogidas en territorios de algunas provincias españolas. Los estudios se presentan por orden cronológico. § – número de territorios controlados (t), egagrópilas recogidas (e) y presas identificadas (p). ‡ - Varias provincias (Andalucía, Extremadura, Castilla, etc.). † – 3.5% en las cinco categorías, pero principalmente reptiles e invertebrados. Referencias: 1) Hiraldo et al., 1975; 2) Pérez-Mellado, 1978; 3) Donázar, 1989a; 4) Fernández-Llario y Hidalgo de Trucios, 1995; 5) Martínez et al., 1996; 6) Serrano, 1998; 7) Epifanio et al., 2006; 8) Penteriani et al., 2008a.
Algunas variaciones estacionales en las frecuencias numéricas del conejo parecen ajustarse a las propias fluctuaciones de las poblaciones de lagomorfos (Donázar, 1989a): el máximo veraniego, además de coincidir con la época de máxima abundancia del conejo, puede estar relacionado también a un incremento en la vulnerabilidad de esta especie por la mixomatosis, que alcanza su máxima virulencia en verano. El búho real selecciona conejos jóvenes en verano y conejos subadultos en invierno, mientras que los conejos adultos son cazados con menor frecuencia que la esperada por su abundancia (Donazar y Ceballos, 1989). En Navarra los conejos machos son capturados con mayor probabilidad que las hembras. Se ha observado el consumo abundante de gaviotas patiamarillas (Larus michahellis) por una pareja nidificante en Gibraltar (De Juana y Garcia, 2015)1. Se ha registrado el consumo de carroña de conejo (Díaz-Ruiz et al., 2010)1.
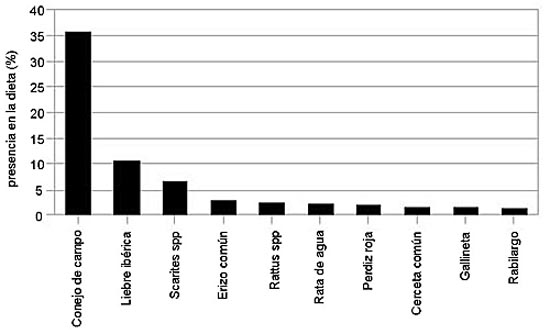
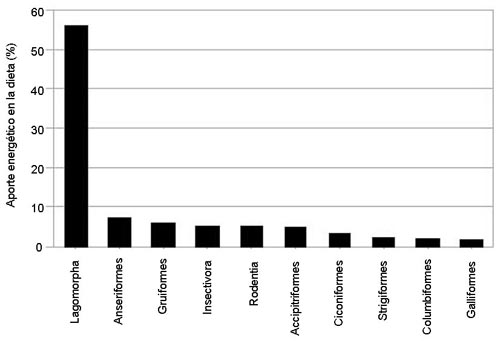
Adaptación a la heterogeneidad de hábitats y recursos: el caso del entorno natural de Doñana Un estudio realizado a lo largo de tres años en el entorno natural de Doñana representa un buen ejemplo de la capacidad de adaptación trófica del búho real (Penteriani et al. 2008a). A lo largo de tres años se analizaron un total de 1.752 presas recogidas en 19 territorios. Los lagomorfos (conejo y liebre) han representado las presas más frecuentes, así como el mayor aporte energético, constituyendo el 46% de las presas capturadas y el 56% de la biomasa ingerida. Los Anseriformes ha sido el segundo grupo de presas más importante en la dieta del búho real en Doñana (7% de la biomasa), reflejo de su disponibilidad como presa en los territorios cerca de las marismas y lagunas. Siguen por importancia los Gruiformes (polla de agua, calamón y focha), que han resultado ser presas incluidas en la dieta en algunos territorios (5,9% de la biomasa). El erizo en algunos territorios, también ha resultado ser un elemento incluido en la dieta, representando una media de 5,4% de la biomasa ingerida. Las 10 especies de presas más frecuentes en la dieta (Figuras 1, 4) han representado en su conjunto el 67% de las presas capturadas. Los 10 órdenes de presas más frecuentes en la dieta (Figura 2) han representado el 94% de las presas capturadas. Entre ellos, los Lagomorfos se han destacado claramente de los demás grupos.
Figura 1. Las 10 especies de presas más frecuentes en la dieta del búho real en Doñana (Penteriani et al., 2008a).
Figura 2. Las 10 órdenes de presas con mayor aporte energético para el búho real en Doñana (Penteriani et al., 2008a).
La dieta en Doñana se compone (biomasa) de conejo (44,1%), liebre (11,7%), aves acuáticas (7%; Gallinula chloropus, Porphyrio porphyrio, Fulica atra), milano negro (2,6%; Milvus migrans), milano real (0,9%; Milvus milvus), busardo ratonero (0,5%; Buteo buteo), lechuza (0,9%; Tyto alba), cárabo (0,9%, Strix aluco), cánidos (0,8%; zorro, gato doméstico) (Penteriani et al., 2012)1. La frecuencia de otros predadores (predación intragremio) en la dieta del búho real en Doñana ha presentado valores similares a los observados en otras localidades en Europa. Los carnívoros predados fueron siempre cachorros, encontrándose entre ellos tres de zorro, uno de gato doméstico y dos de otros cánidos (zorro o perro). La frecuencia media de carnívoros fue de 0,4%, representando en media un aporte energético de 0,8%, que puede considerarse prácticamente irrelevante en la composición de la dieta. Este valor se encuentra por debajo de la media de consumo de carnívoros por el búho real en Europa, que es de 0,8% (Lourenço et al., en prensa). En la dieta aparecieron también siete especies de rapaces diurnas (elanio azul, milano real, milano negro, ratonero, águila calzada, cernícalo vulgar y cernícalo primilla), siendo la más frecuente el milano negro, una de las rapaces más abundantes en Doñana. La frecuencia media de rapaces diurnas incluidas en la dieta fue de 2,7%, valor que está escasamente por encima de la media en Europa (1,1%, Lourenço et al., en prensa). Las rapaces diurnas representaron un aporte energético de 5,0%, valor en general poco relevante. Las rapaces nocturnas más predadas fueron el cárabo y la lechuza común, dos especies abundantes en el área de estudio. Su frecuencia media fue de 2,5%, valor muy parecido al encontrado en Europa, que alcanza el valor del 2,2% (Lourenço et al., en prensa). El aporte energético de las rapaces nocturnas (2,4%), al igual que por las rapaces diurnas, es poco relevante. De estos resultados se concluye que: (a) la predación por parte del búho real sobre otros predadores es semejante a la observada en el resto de Europa, (b) la predación intragremio representa porcentajes de frecuencia y biomasa irrelevantes; y (c) cuando esta predación ocurre, incide sobre todo en especies que son particularmente abundantes en Doñana y/o lugares específicos en los que algunas especies de rapaces son muy abundantes.
Figura 3. Búho real con una presa (Meloncillo, Herpestes ichneumon). © V. Penteriani
Figura 4. Pollo de Búho real con una presa (Rabilargo, Cyanopica cooki). © V. Penteriani
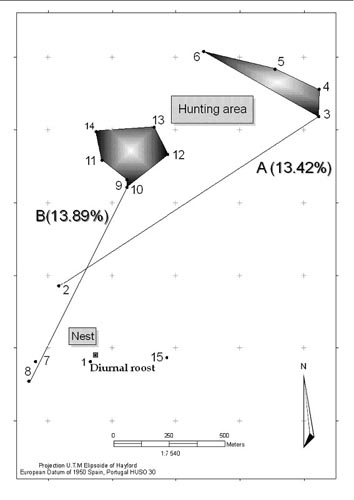
Depredación selectiva hacia los individuos de peor condición física La incidencia de depredación selectiva sobre las presas con algún tipo de anormalidad se puede evaluar considerando aquellos huesos presentes en las egagrópilas que presenten malformaciones detectables tales como callos óseos, tumores, etc. En un estudio realizado en Almagro (Ciudad Real) se estimó que al menos el 18% de las aves capturadas presentaban algún tipo de anormalidad ósea (Fernandez-Llario e Hidalgo de Trucios, 1995). Este porcentaje es superior al estimado en las aves no capturadas, lo que sugiere que los búhos reales podrían seleccionar durante la caza individuos con deformidades óseas que afectan a su movilidad e incrementen el éxito de la captura. En los estudios realizados sobre depredación se ha asumido en general que los predadores realizan una selección sobre los individuos en peor condición física (Errington, 1946; Curio, 1976). Tales asunciones concuerdan bien con los clásicos modelos de la caza óptima, en los que se predice que los predadores maximizan la energía que gastan durante la caza seleccionando presas fáciles de cazar (Greene, 1986; Giraldeau y Caraco, 2000). El grado de selección de la presa se encuentra relacionada con la técnica de caza empleada por el predador (Kruuk, 1972; Schaller, 1967, 1972). Los predadores que realizan una caza de forma activa (capaces de seleccionar a sus presas a muy largas distancias, como es el caso de muchas especies pertenecientes a los cánidos y a los felinos) tienen más oportunidades para seleccionar presas en peores condiciones físicas que los predadores que realizan la caza de modo pasivo, esperando el encuentro con la presa, como es el caso de los búhos. Este último grupo de predadores al acecho realizan una predación más azarosa, debido a la estocasticidad del encuentro con diferentes tipos de presa. Sin embargo, recientes estudios demuestran que el proceso de predación es más complejo de lo que antes se pensaba, debido a que es el resultado de la interacción de una gran cantidad de factores (tamaño de grupo, edad y sexo, así como el nivel de vigilancia de la presa, hábitat, entorno y las tácticas del predador). En este sentido, la simple dicotomía entre predadores activos y pasivos, así como la regla general de que los predadores predan sobre individuos en peores condiciones físicas no son reglas tan generales (Reich, 1981; Koivunen et al., 1996; FitzGibbon y Fanshawe, 1989; Rohner y Krebs, 1996; Husseman et al., 2003). Anteriores estudios demuestran que el grado en que los individuos en peores condiciones físicas son predados es un reflejo de la dificultad de capturar a la presa (Temple, 1987). Es decir, cuando una presa es fácil de capturar, los individuos de baja calidad serán predados en una proporción que será un reflejo de su presencia en la población. El búho real es un predador que, junto al águila imperial, representa una de las rapaces europeas más especializada en el conejo (Delibes y Hiraldo, 1981; Penteriani et al., 2002, 2005). El búho real alcanza picos de máxima densidad en los hábitats mediterráneos en los que el conejo se encuentra ampliamente distribuido (Donázar, 1987). Recientemente (Penteriani et al., 2008) se ha podido demostrar como el búho real selecciona el conejo mediante señales visuales a través de la información que transmite la reflectancia del color blanco de la cola de los conejos. La reflectancia del blanco que caracteriza las colas de conejos está correlacionada con el índice de condición física de los mismos: las colas de los conejos capturados por búhos reales tuvieron una reflectancia menor que las colas de los conejos no capturados, siendo además de peor condición física. Por último, utilizando la información de búhos marcados con emisores, y la información disponible en relación a las técnicas de caza y el esfuerzo que el proceso conlleva, se ha podido mostrar como el búho, aún teniendo un esfuerzo de caza bajo, presenta una alta proporción de presas de baja calidad física. El radioseguimiento continuo de los individuos apoyó la idea de que los conejos representan una presa fácil en nuestra área de estudio. De hecho (Figura 5), se registraron: (a) cortos períodos de tiempo entre el comienzo de un evento de caza y la finalización del mismo con éxito (97 ± 63 min, con un rango de 35 y 378 min); (2) el tiempo que los individuos invirtieron en cazar fue corto respecto a la duración total de la noche (17 ± 12%, en un rango entre 3 y 79%).
Figura 5. Movimientos realizados por un macho de búho a lo largo de la noche. Al cesar la actividad vocal del anochecer el individuo se dirige hacia se zona de campeo. A y B representan los bajos valores de tiempo invertidos en la caza.
El principal resultado de este estudio fue que, efectivamente, el búho real selecciona presas en baja condición física (como mostraron las comparaciones de reflectancia de las colas de los conejos encontrados en los nidos respecto a los niveles de las colas recogidas en el área de estudio), aún siendo la presa fácil de obtener (como mostraron los datos tomados a través del radioseguimiento). Esta es la primera evidencia de que un predador pasivo, con un esfuerzo de caza bajo, selecciona presas en peor condición física. Los individuos en baja condición física son más fáciles de predar que los normales. De hecho, niveles bajos de condición física pueden afectar las habilidades evasivas de los individuos (Norrdahl and Korpimäki, 1998; Murray, 2002; Wirsing et al., 2002). Como consecuencia, los predadores que seleccionan presas en baja condición física tienen mayor probabilidad de acabar el proceso de forma exitosa e invertir menos energía en llevar a cabo su propósito. Sin embargo, los beneficios de predar sobre individuos de baja condición física se ven reducidos cuando el predador tiene facilidad para capturar a la presa, cuando también los individuos más sanos son fáciles de cazar (Temple, 1987). El que el conejo represente una presa fácil para el búho, como muestran los datos de comportamiento registrados a través del radioseguimiento, son apoyados por los ritmos de actividad y el uso del espacio del lagomorfo en la Península Ibérica (Moreno et al., 1996), donde el número de predadores diurnos es mayor que los nocturnos. Como consecuencia, el riesgo de ser predados durante el día es mayor y los conejos (Villafuerte, 1994; Moreno et al., 1996): (1) prefieren alimentarse cerca de lugares protegidos durante las horas del día, y en zonas abiertas durante la noche, volviéndose más visibles y, por tanto, más vulnerables a los búhos; y (2) son más activos durante la noche que durante el día, aumentado su tasa de encuentro con los búhos. Entonces, ¿por qué los búhos seleccionan presas, que son fáciles de cazar, en baja condición física? En teoría, el encontrar una mayor proporción de individuos en baja condición física podría ser el resultado de dos procesos (Temple, 1987). El primero, en el que los predadores no realizan una selección activa sobre sus presas, predando por igual a individuos en baja condición física e individuos normales, pero los ataques presentan una mayor tasa de éxito cuando el individuo es de peor calidad. El segundo proceso opera mediante la percepción de las presas en baja condición física, que presentan señales visuales que el predador puede detectar y asociar con una mayor facilidad de captura. En este sentido, obteniendo prácticamente los mismos resultados pero con menos costes, se satisface la teoría de la caza óptima. Greene (1986) resalta que los predadores pasivos son más propensos a cazar sobre individuos en baja condición física si determinadas señales visuales representan el principal factor que determina el ataque del predador. Los búhos no son percibidos por las presas en la mayoría de los casos y, en situaciones en las que la caza es fácil, no hay razones para pensar que el éxito en la predación sobre individuos en peor condición física podría ser la causa de la desproporción que hemos encontrado de estos individuos. Por el contrario, se podría lanzar la hipótesis de que las decisiones de caza del búho están guiadas por señales visuales. Aunque hay poca información disponible sobre señales visuales entre predador-presa, algunas evidencias indican que la señal blanca de la cola de los conejos desempeña un importante papel en la preferencia de los búhos. Trabajos empíricos, llevados a cabo tanto en mamíferos como en aves (Woodland et al., 1980) demuestran que existen señales por parte de las presas para indicar al predador que han sido percibidos (Hansson, 1991) o estas señales pueden informar al predador de que se encuentra en un estado saludable como para escapar (FitzGibbon y Fanshawe, 1989).
Apéndice: Lista de especies citadas en la dieta del búho real en España Mamíferos: Erinaceus europaeus, Atelerix algirus, Sorex coronarius, Crocidura russula, Lepus capensis, Oryctolagus cuniculus, Sciurus vulgaris, Clethrionomys glareolus, Arvicola sapidus, Neomys anomalus, Pitymys duodecimcostatus, Microtus agrestis, Apodemus sylvaticus, Mus musculus, Mus spretus, Rattus rattus, Rattus norvegicus, Myotis myotis, Eliomys quercinus, Glis glis, Vulpes vulpes, Felis sp., Canis familiaris, Herpestes ichneumon, MusteIa nivalis, Martes foina, Bovidae sp. Aves: Anser anser, Bubulcus ibis, Nycticorax nycticorax, Anas platyrhynchos, Anas crecca, Buteo buteo, Accipiter gentilis, Milvus migrans, Circaetus gallicus, Falco tinnunculus, Pernis apivorus, Circus aeruginosus, Circus pygargus, Alectoris rufa, Coturnix coturnix, Gallinula chloropus, Larus michahellis1, Vanellus vanellus, Scolopax rusticola, Tringa sp., Burhinus oedicnemus, Columba palumbus, Columba livia, Columba oenas, Columba oenas, Gallus gallus, Gallinago gallinago, Himantopus himantopus, Porphyrio porphyrio, Fulica atra, Streptopelia turtur, Otis tetrax, Cuculus canorus, Bubo bubo, Tyto alba, Asio otus, Asio flammeus, Otus stops, Athene noctua, Strix aluco, Caprimulgus sp., Apus apus, Coracias garrulus, Upupa epops, Galerida sp., Lullula arborea, Picus viridis, Monticola solitarius, Erithacus rubecula, Turdus merula, Turdus philomelos, Emberiza calandra, Miliaria calandria, Carduelis carduelis, Carduelis chloris, Fringilia coelebs, Coccothrausthes Coccothrausthes, Sturnus unicolor, Oriolus oriolus, Garrulus glandarius, Cyanopica cooki, Pica pica, Ptyonoprogne rupestris, Melanocorypha calandra, Phyrrhocorax phyrrhocorax, Corvus monedula, Corvus corone, Corvus corax. Reptiles: Mauremys leprosa, Podarcis hispanica, Psammodromus algirus, Timon lepidus. Anfibios: Pelophylax perezi, Pelobates cultripes. Peces: Chondrostoma toxostoma, Chondrostoma polylepis, Barbus barbus, Barbus bocagei. Invertebrados: Cerambix cerdo, Oryctes nasicornis, Lucanus cervus, Scarabeus sacer, Copris hispanus, Geotrupes sp., Mantis religiosa, Anacridium aegyptium, Akis sp., Butlus occitanus, Scolopendra sp., Scarites sp.
Referencias Colwell, R. K. (2009). EstimateS: Statistical estimation of species richness and shared species from samples. Versión 8.2. http://purl.oclc.org/estimates. Curio, E. (1976). The ethology of predation. Springer-Verlag, New York. Delibes, M., Hiraldo, F. (1981). The rabbit as prey in the Iberian Mediterranean ecosystem. Pp. 614-622. En: Myers, K., MacInnes, C.D. (Eds.). Proceedings of the World Lagomorph Conference. Guelph University Press,Guelph, Ontario. De Juana, E., Garcia, E. (2015). The Birds of the Iberian Peninsula. Christopher Helm, London. 688 pp. Díaz-Ruiz, F., Buenestado, F., Fernández de Simón, J., Ferreras, P. (2010). First record of rabbit carrion consumption by eurasian eagle-owl (Bubo bubo) on the Iberian Peninsula. Journal of Raptor Research, 44 (1): 78-79. Donázar, J.A. (1987). Geographic variations in the diet of the eagle owls in western Mediterranean Europe. Pp. 220-224. En: Nero, R.W., Clark, R.J., Knapton, R.J., Hamre, R.H. (Eds.). Biology and conservation of northern forest owl: symposium proceedings. General Technical Report RM-142. USDA, Forest Service, Fort Collins, USA. Donázar, J. A., (1989a). Variaciones geográficas y estacionales en la dieta del Búho Real (Bubo bubo) en Navarra. Ardeola, 36: 25-36. Donázar, J. A., Ceballos, O. (1988). Sur l'alimentation du hibou grand duc (Bubo bubo) dans une localite de la haute montagne pyreneenne espagnole. Alauda, 56: 274-276. Donázar, J. A., Ceballos, O. (1989). Selective predation by Eagle Owls Bubo bubo on rabbits Oryctolagus cuniculus: Age and sex preferences. Ornis Scand., 20: 117-122. Donázar, J. A., Castién, E. (1989). Predación del Búho Real Bubo bubo sobre la perdiz roja Alectoris rufa. Selección de edad y sexo. Doñana Acta Vertebr., 16: 219-225. Epifanio, J. C., Novegil, A., Novegil, A., González, J. (2006).Primeros datos sobre la biología del búho real en Galicia. Quercus, 240: 8-13. Errington, P.L. (1946). Predation and vertebrate populations. Q. Rev. Biol., 21: 221-245. Fernández, J. M., Pinedo, X. (1996). Un cas de predation du grand-duc d'Europe Bubo bubo sur une ecrevisse rouge de Louisiane Procambarus clarkii (Crustacea Decapoda). Alauda, 64 (4): 396. Fernández-Llario, P., Hidalgo de Trucios, S. J. (1995). Importancia de presas con limitaciones físicas en la dieta del búho real, Bubo bubo. Ardeola, 42: 205-207. FitzGibbon, C. D., Fanshawe, J. H. (1989). The condition and age of Thomson’s gazelles killed by cheetahs and wild dogs. J. Zool. (Lond.), 218: 99-107. Giraldeau, L. A., Caraco, T. (2000). Social foraging theory. Princeton University Press, Princeton, New York. Greene, C. H. (1986). Patterns of prey selection: implications of predator foraging tactics. Am. Nat., 128: 824-839. Hansson, O. (1991). Pursuit deterrent signals: communication between prey and predators. Trends Ecol. Evol., 6: 325-329. Herrera, C. M., Hiraldo, F. (1976). Food-niche and trophic relationship among European owls. Ornis Scand., 7: 29-41. Hiraldo, F., Andrada, J., Parreno, F. F. (1975). Diet of the Eagle Owl (Bubo bubo) in Mediterranean Spain. Doñana Acta Vertebr., 2: 161-177. Hiraldo, F., Parreno, F. F., Andrada, V., Amores, F. (1976). Variations in the food habits of the European Eagle Owl Bubo bubo. Doñana Acta Vertebr., 3: 137-156. Husseman, J. S., Murray, D. L., Power, G., Mack, C., Wenger, C. R., Quigley, H. (2003). Assessing differential prey selection patterns between two sympatric large carnivores. Oikos, 101: 591-601. Jiménez-Valverde, A., Hortal, J. (2003).Las curvas de acumulación de especies y la necesidad de evaluar la calidad de los inventarios biológicos. Rev. Ibérica Aracnol., 8: 151-161. Koivunen, V., Korpimäki, E., Hakkarainen, H., Norrdahl, K. (1996). Prey choice of Tengmalm’s owls (Aegolius funereus): preference for substandard individuals? Can. J. Zool., 74: 816-823. Kruuk, H. (1972). The spotted hyaena. University of Chicago Press, Chicago. Lourenco, R. (2006). The food habits of Eurasian eagle-owls in Southern Portugal. Journal of Raptor Research, 40 (4): 297-300. Lourenço, R., Santos, S., Rabaça, J. E., Penteriani, V. (2011). superpredation patterns in four European raptors. Popul. Ecol., 53. 175-185. Martínez, J. A., Izquierdo, A., Izquierdo, J. J., López, G. (1996). Causas de mortalidad de las rapaces nocturnas en la Comunidad Valenciana. Quercus 126: 18-19. Moreno, S., Villafuerte, R., Delibes, M. (1996). Cover is safe during the day but dangerous at night: the use of vegetation by European wild rabbits. Can. J. Zool., 74: 1656-1660. Murray, D. L. (2002). Differential body condition and vulnerability to predation in snowshoe hares. J. Anim. Ecol., 71: 614-625. Norrdahl, K., Korpimäki, E. (1998). Does mobility or sex of voles affect risk of predation by mammalian predators? Ecology, 79: 226-232. Penteriani, V., Gallardo, Roche, P. (2002). Landscape structure and food supply affect eagle owl (Bubo bubo) density and breeding performance: a case of intra-population heterogeneity. J. Zool. (Lond.), 257: 365-372. Penteriani V., Sergio F., Delgado M. M., Gallardo, M., Ferrer, M. (2005). Biases in population diet studies due to samplings in heterogeneous environments: a case study with the Eagle Owl. J. Field Orn., 76: 237-244. Penteriani, V., Lourenço, R. Delgado, M. M. (2008a). El fenómeno de la colonización de Doñana por parte del búho real. Patrones espacio-temporales de la población y efectos sobre las comunidades de aves y mamíferos. Convenio de colaboración entre la Consejería de Medio Ambiente de la Junta de Andalucía y el Consejo Superior de Investigaciones Científicas (CSIC) para la realización del trabajo denominado “Colonización del búho real en el Parque Natural de Doñana” EXPTE.:700/2005/M/00./ Penteriani, V., Lourenco, R., Delgado, M. M. (2012). Eagle Owls in Doñana: a conservation dilemma or not? British Birds, 105 (2): 88-95. Penteriani, V., Delgado, M. M., Bartolommei, P., Maggio, C., Alonso-Alvarez, C. Holloway, G.J. (2008b). Owls and rabbits: predation against substandard individuals of an easy prey. J. Avian Biol., 39: 215-221. Pérez Mellado, V. (1978). Alimentación del búho real (Bubo bubo) en España Central. Ardeola, 25: 93-112. Reich, A. (1981). Sequential mobilization of marrow fat in the Impala (Aepyceros melampus) and analysis of condition of Wild dog (Lycaon pictus) prey. J. Zool. (Lond.) 194: 409-419. Rohner, C., Krebs, C.J. (1996). Owl predation on snowshoe hares: consequences of antipredator behaviour. Oecologia, 108: 303-310. Ruiz Bustos, A., Camacho Muñoz, I. (1973). Datos sobre la alimentación del Bubo bubo y determinación de micromamíferos en Sierra Nevada mediante egagrópilas. Cuadernos Cienc. biol., 2 (2): 57-61. Schaller, G.B. (1967). Hunting behaviour of the cheetah in the Serengeti National Park. East Afr. Wildl. J., 6: 95-100. Schaller, G.B. (1972). The Serengeti lion. University of Chicago Press, Chicago, Illionois. Serrano, D. (1998). Diferencias inter-hábitat en la alimentación del Búho Real(Bubo bubo) en el valle medio del Ebro (NE de España): efecto de la disponibilidad de conejo (Oryctolagus cuniculus). Ardeola, 45: 47-53. Serrano, D. (2000).Use of farm chicken carcasses by the eagle owl Bubo bubo. Ardeola, 47: 101-103. Temple, S. A. (1987). Do predators always capture substandard individuals disproportionately from prey populations? Ecology, 68: 669-674. Vericad, J. R., Escarre, A., Rodríguez, E. (1976). Datos sobre la dieta de Tyto alba y Bubo bubo en Alicante (SE de Iberia). Mediterranea, 1: 47-59. Villafuerte, R. (1994). Riesgo de predación y estrategia defensivas del conejo, Oryctolagus cuniculus, en el parque Nacional de Doñana. Tesis Doctoral, Universidad de Córdoba. Wirsing, A.J., Steury, T.D., Murray, D.L. (2002). Relationship between body condition and vulnerability to predation in red squirrels and snowshoe hares. J. Mammal., 83: 707-715. Woodland, D. J., Jaafar, Z., Knight, M. (1980). The “pursuit deterrent” function of “alarm signals”. Am. Nat., 116: 157-177. Zamorano, E., Palomo, L. J., Antúnez, A., Vargas, J. M. (1986). Criterios de predación selectiva de Bubo bubo y Tyto alba sobre Rattus. Ardeola, 33 (1-2): 3-9.
Vincenzo Penteriani y María del Mar Delgado Fecha de publicación: 30-03-2010 Otras contribuciones: 1. Alfredo Salvador. 18-03-2016 Penteriani, V., Delgado, M. M. (2016). Búho real – Bubo bubo. En: Enciclopedia Virtual de los Vertebrados Españoles. Salvador, A., Morales, M. B. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||