|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Para más información sobre cada apartado hacer click en:
|
Key words: Mediterranean stripe-necked terrapin, description, size, sexual dimorphism, variation.
Sistemática Esta especie fue descrita por primera vez por Schweigger (1812) que le asignó el nombre de Emys leprosa. En la actualidad la especie se denomina Mauremys leprosa y se clasifica dentro de la familia Geoemydidae. Hasta 1964, la especie se designaba Clemmys caspica (Gmelin, 1774) y presentaba una distribución disjunta con un grupo de poblaciones orientales, entre la región del Caspio y los Balcanes, y un grupo occidental que incluía las poblaciones de la Península Ibérica y las del noroeste africano, integradas en la subespecie “leprosa”. McDowell (1964) reorganizó las especies incluidas en el género Clemmys, en base a caracteres morfológicos, asignando las especies de distribución euroasiática a dos géneros distintos y quedando incluidas las poblaciones ibéricas en el género Mauremys, especie Mauremys caspica. Posteriormente, los estudios de Merkle (1975), basados en diferencias bioquímicas, y definitivamente, el trabajo de Busack y Ernst (1980), basado en análisis morfológicos, pusieron en evidencia la existencia de diferencias suficientes entre las subespecies de M. caspica como para elevar las poblaciones del Mediterráneo occidental, incluidas hasta entonces en la subespecie leprosa, al nivel de especie con la denominación actual de Mauremys leprosa.
Descripción Mauremys leprosa es un quelonio cuya morfología refleja su adaptación al medio acuático (Figuras 1 y 2). El caparazón es alargado y deprimido dorso-ventralmente, ligeramente más ancho en la parte posterior que la anterior. El borde del caparazón es liso. En el espaldar se distingue, en los adultos jóvenes, una quilla longitudinal, que desaparece con la edad. La coloración del espaldar varía entre el verde oliváceo y el pardo, con manchas pardo rojizas, que se van difuminando conforme el animal se hace más viejo. El peto es rígido, sin charnela y presenta un color de fondo amarillo o crema, con manchas marrón oscuro, que desaparecen con la edad. Está unido firmemente al espaldar por un puente óseo bastante ancho, del que forman parte una placa axilar y otra inguinal bien desarrolladas. El espaldar está cubierto por una placa nucal y cinco vertebrales en el eje central, en general más anchas que largas, con cuatro costales y doce marginales a cada lado. En el peto hay dos placas gulares, dos humerales, dos pectorales, dos abdominales, dos femorales y dos anales, éstas últimas terminadas en punta. La piel, especialmente la del cuello, presenta un diseño de rayas anaranjadas o amarillas sobre fondo verdoso oscuro. Destaca una mancha circular, naranja o amarilla, en la cabeza, entre el ojo y el tímpano. Las bandas y manchas son muy conspicuas en los animales jóvenes pero desaparecen o se difuminan con la edad.
Figura 1. Detalle de la cabeza de una hembra adulta y de un juvenil de Mauremys leprosa de Doñana. (C) A. Cordero (izda) y C. Díaz-Paniagua (derecha).
Figura 2. Aspecto dorsal y ventral de los juveniles de Mauremys leprosa de Huelva. (C) C.Díaz-Paniagua (izda), A. Portheault (dcha).
La cabeza es corta y ancha, aplanada en la parte superior y apuntada anteriormente. La pupila es oscura y la órbita está cruzada por una raya transversal oscura. Las narinas están situadas altas en el extremo anterior de la cabeza. Las mandíbulas tienen una cubierta córnea en forma de pico. Las patas presentan piel entre los dedos y terminan en cinco uñas en las delanteras y cuatro uñas en las traseras. La cola es larga. Estos galápagos poseen dos glándulas inguinales, las glándulas de Rathke, que emiten una sustancia de olor desagradable, cuya función no está clara aún. Es frecuente en muchos individuos la presencia de algas sobre el caparazón que, en algunos ejemplares, llegan a proliferar masivamente sobre éste e incluso sobre la piel de la cola y las patas posteriores. En estos casos la infestación puede llegar a producir daños en el caparazón y confiere a estos animales un aspecto leproso (Gadow, 1901). Sin embargo, la denominación específica “leprosa” no responde a la presencia de estas algas como se cree erróneamente, sino que fue asignada por Schweigger (1812) en su descripción de la especie, en base a pequeños nódulos o verrugas que presentan algunos especímenes viejos en el caparazón. Ver descripción general de la especie en Andreu y López-Jurado (1998), Díaz-Paniagua y Andreu (2014) y en Bertolero y Busack (en prensa).
Biometría Aunque la mayor parte de los ejemplares adultos de la Península Ibérica tienen tamaños comprendidos entre 100 y 180 mm de longitud recta de espaldar, las tallas máximas encontradas superan los 200 mm, alcanzando los machos 210 mm y las hembras 229 mm (Tabla 1).
Tabla 1. Tamaños de individuos de Mauremys leprosa de poblaciones de diferentes puntos de la Península Ibérica. Se indica la media y los valores mínimo y máximo de longitud de espaldar, medido en línea recta; n= número de individuos medidos. *: Poblaciones en las que no se describe cómo se mide la longitud del espaldar. Nótese que el valor medio está influenciado por la cantidad de individuos subadultos y jóvenes incluidos en la muestra.
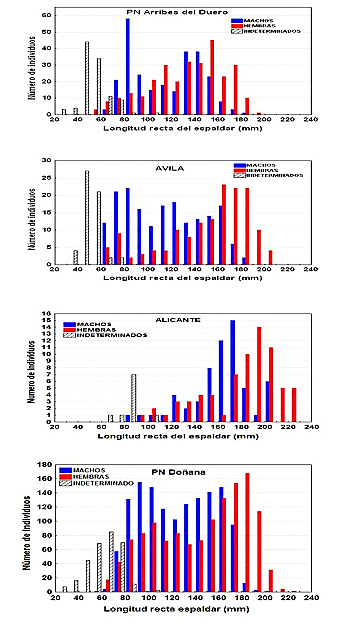
La distribución del tamaño de los individuos puede variar entre poblaciones de la Península Ibérica (Figura 3). En algunas poblaciones la distribución del tamaño de los individuos es bimodal en uno o en los dos sexos, como se observa para machos y hembras de la población de Doñana, o para los machos de Arribes de Duero y de Ávila (Figura 3). Tanto la bimodalidad como las diferencias observadas en el tamaño de los individuos entre diferentes poblaciones podrían estar relacionadas con variaciones ambientales y merecen la atención de futuros estudios.
Figura 3. Longitud recta del espaldar de los individuos de cuatro poblaciones de Mauremys leprosa de la Península Ibérica. Entre los individuos identificados como machos o hembras se incluyen inmaduros que ya mostraban caracteres sexuales secundarios. PN Arribes del Duero: Datos de 659 individuos de Salamanca (Vilvestre, Barruecopardo, La Peña) y Zamora (Fornillos de Fermoselle) de abril a septiembre, entre 2006 y 2009 (datos de Alarcos et al., 2010). Ávila: Datos de 388 individuos muestreados en Candeleda y Hoyales del Poyo, de mayo a agosto de 2008 (datos de Alarcos et al., 2010). Alicante: Datos de 141 individuos capturados en el Rio Serpis (Alicante) de mayo a octubre de 2011 (datos de LIFE-Trachemys, 2011a). PN Doñana: Datos de 3037 individuos capturados en el Parque Nacional de Doñana de abril a septiembre entre 1991 y 2001 (datos de Keller, 1997a; Keller, 1999 y C. Keller, datos sin publicar).
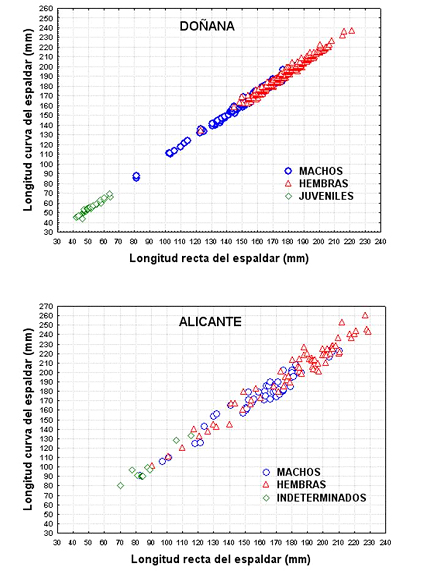
Figura 4. Relación entre la longitud recta y curva del espaldar para 369 individuos de Mauremys leprosa del Parque Nacional de Doñana (C. Keller, datos sin publicar) y 137 individuos del Rio Serpis (Alicante) (datos de LIFE-Trachemys, 2011a).
En Mauremys leprosa, la longitud recta y curva del caparazón están relacionadas linealmente (Figura 4). La diferencia entre ambas medidas es pequeña en individuos con longitudes de 40-50 mm, pero llega a más de 20 mm de diferencia en individuos con longitud recta del espaldar por encima de los 200 mm. Por otra parte, aunque la relación entre las dos medidas tiene una pendiente similar tanto en los galápagos de Doñana como en los del río Serpis, en Alicante, éstos últimos presentan mayor variabilidad de la curva del caparazón (Figura 4).
Dimorfismo sexual En Doñana, la diferenciación sexual está asociada con el inicio de la madurez sexual en los machos, que se produce con longitudes de espaldar iguales o mayores a 85 mm, durante el segundo año de vida aproximadamente (Keller, 1997b). En la práctica, en esta población es posible, con este tamaño, diferenciar machos de hembras con bastante seguridad.
Figura 5. Diferencias entre el peto de un galápago macho (izquierda) y una hembra (derecha) de Málaga. Fotos: J. Domínguez y J. Villarán
Los caracteres que permiten distinguir a machos y hembras adultos de igual tamaño son la longitud y anchura de la zona preanal de la cola, que es más larga y ancha en los machos que en las hembras; en estas, con la cola estirada, la apertura cloacal queda a la altura del borde del caparazón, mientras que en los machos lo sobrepasa ampliamente. El peto es cóncavo en los machos y más aplanado en las hembras; asimismo es más largo, en comparación con el espaldar, en las hembras que en los machos (Figura 5); y los caparazones son más anchos y convexos en las hembras que en los machos de igual tamaño (Pérez et al., 1979; Keller, 1997a y b; Muñoz y Nicolau, 2006). Las hembras de Mauremys leprosa presentan, además, las bandas coloreadas de las extremidades significativamente más brillantes y de coloración menos saturada de ultravioleta y más de anaranjado que los machos, pero no hay diferencias en la coloración del caparazón entre los sexos (Ibáñez et al., 2013a). En general las hembras adultas alcanzan un tamaño mayor que los machos (Keller, 1997a; Muñoz y Nicolau, 2006). La menor talla de los machos adultos con respecto a las hembras se ha explicado en base a que estos alcanzan la madurez sexual con menor tamaño y edad (Keller, 1997b). El incremento de la fecundidad parece ser la causa, en esta y otras especies de quelonios, del mayor tamaño y peso de las hembras, así como de que presenten una cavidad abdominal mayor, en comparación con machos de similar longitud de caparazón. El mayor volumen abdominal permite alojar puestas más grandes, así como mayores reservas nutritivas asociadas a la vitelogénesis. Alternativamente, se podrían estar seleccionando machos más ligeros y aplanados, por lo tanto más hidrodinámicos, capaces de una mayor movilidad con menor gasto energético y por consiguiente con más recursos para dedicarlos a la búsqueda y cortejo de las hembras. Ambas hipótesis no son excluyentes (Muñoz y Nicolau, 2006; Bonnet et al., 2010).
Descripción de los huevos Los huevos son de cáscara semidura, alargados y de color blanco (Figura 6). En la Península Ibérica su longitud varía entre los 28 y los 41 mm, el ancho entre los 18 y 23 mm y el peso entre los 6,5 y 11,1 g (González de la Vega, 1988; Da Silva, 1995; Pérez-Santigosa, 2007a; Díaz-Paniagua et al., 2014, ver tabla 2).
Figura 6. Restos de huevos depredados de Mauremys leprosa. (C) A. Cordero
Tabla 2. Biometría de los huevos de Mauremys leprosa en varias poblaciones de Huelva y Badajoz. *: Huevos oviductales con cáscara ya desarrrollada obtenidos por disección de las hembras; **: Huevos medidos tras inducir la puesta con oxitocina; ***Huevos extraídos de un nido pocos días después de la puesta. N= número de huevos.
Descripción de las crías Las crías recién nacidas presentan un caparazón prácticamente redondo (Figura 7). El espaldar es de color pardo uniforme y en él se distinguen tres quillas longitudinales, las laterales menos marcadas que la central. El borde del espaldar es ligeramente aserrado. Las placas del espaldar presentan toda la superficie punteada. El peto presenta un fondo claro con manchas oscuras. La piel es pardo verdosa con líneas anaranjadas o amarillas. El tamaño de las crías al nacer varía entre los 24 y los 33 mm de longitud de espaldar, con pesos entre 3 y 7,7 gramos (Tabla 3).
Figura 7. Aspecto ventral y dorsal del caparazón de una cría recién nacida de Mauremys leprosa. (c) N. Pérez-Santigosa
Tabla 3. Tamaño (mm) y masa corporal (g) medios al eclosionar (en el campo o en el laboratorio) de las crías de Mauremys leprosa de Doñana. La incubación en laboratorio se realizó en vermiculita humedecida a 27,5ºC. Se indica también la desviación típica y, entre paréntesis, los valores mínimo y máximo. Datos de 1997 (C. Keller, inéditos); Datos de 2002 y 2003 (Pérez-Santigosa, 2007); Datos de 2001 (Díaz-Paniagua et al, 2014).
Hematología y bioquímica sanguínea Hidalgo-Vila et al. (2007a) han descrito los parámetros de referencia sanguíneos en ejemplares de Doñana, en los que la fórmula leucocitaria contenía una baja proporción de linfocitos, mientras que en individuos cautivos la frecuencia registrada era del 50% (Muñoz y de la Fuente, 2004). Los parámetros bioquímicos no difieren en general de otros reptiles, alcanzando normalmente valores más altos en hembras que en machos, especialmente en las concentraciones de calcio en el caso de las hembras durante la época reproductora (Hidalgo-Vila et al., 2007a). Estas diferencias entre ambos sexos no se detectaron en ejemplares analizados de la provincia de Almería, en los que también se observaron menores concentraciones de glucosa, ácido úrico, sodio, calcio y fosfatos que los detectados en Doñana (Pagés et al., 1992). Estos autores apreciaron el incremento de hematocrito en la concentración de hemoglobina y el de glóbulos rojos en otoño, asociado al almacenamiento de oxígeno en sangre durante la hibernación. En otoño se observaron los niveles de glucosa más bajos mientras que las concentraciones de calcio y magnesio fueron menores en verano, estación en la que se alcanzaron, sin embargo, los niveles máximos de fósforo inorgánico (Pagés et al., 1992). Estos resultados no coinciden con los obtenidos en galápagos de Huelva, donde los valores de hematocrito y eritrocitos más altos se registraron en el periodo reproductor (primavera-verano), cuando también son más altas las concentraciones de fosfatos. En este periodo son también mayores las concentraciones de glucosa en los machos, y de calcio en las hembras, mientras que las concentraciones de glucosa de las hembras se mantienen similares a las del periodo post-hibernación (Hidalgo-Vila, 2006). La fórmula leucocitaria se ha descrito para los galápagos de Doñana, consistiendo en 53,8% heterófilos, 35,3% eosinófilos, 6,3% linfocitos, 4,3% monocitos y 0% basófilos en machos; y 58,5% heterofilos, 32,6% eosinofilos, 5,8% linfocitos, 2% monocitos y 0% basófilos en hembras (Hidalgo Vila et al., 2007a).
Características genéticas El número cromosómico es 2N = 52. El cariotipo de esta especie está compuesto por 9 pares de cromosomas metacéntricos o submetacéntricos, 5 pares de cromosomas acrocéntricos y 12 pares de microcromosomas. No presenta cromosomas sexuales dimórficos (Bickham, 1975; Bickham y Baker, 1976). No se conoce aún si en esta especie la determinación sexual depende de la temperatura a la que se incuban los huevos, aunque se ha confirmado en otras especies del género Mauremys (Ewert y Nelson, 1991) y parece que existe una relación entre ausencia de cromosomas sexuales diferenciados y determinación sexual por temperatura (Bull, 1980). Se han obtenido 11 loci microsatélites en poblaciones ibéricas y norteafricanas de M. leprosa (Verissimo et al., 2013).
Variación geográfica Aunque se han descrito hasta ocho subespecies de M. leprosa en base a caracteres morfológicos, siete de ellas solo en Marruecos (Schleich, 1996; Bour y Maran, 1998), en la actualidad se reconocen solo dos subespecies, bien diferenciadas a nivel genético, y separadas por la cadena montañosa del Atlas (Fritz et al., 2005 y 2006; Pleguezuelos et al., 2008; Lovich et al., 2010). Así lo indican los resultados del análisis de secuencias del citocromo b mitocondrial procedentes de individuos de 38 poblaciones tanto de la Península Ibérica como del Magreb, que permitieron identificar dos grupos o clados distintos de haplotipos. El clado A se encontró en la Península Ibérica y el norte de África, mientras que el B se halló en poblaciones al sur del Atlas en Marruecos. Estos resultados indican, asimismo, un origen norteafricano de la especie y señalan al suroeste ibérico como refugio en época glacial, desde donde se expandió al resto de la Península Ibérica. Los datos indican incluso una recolonización del norte de África desde la Península Ibérica en época postglacial, poniendo de relieve que el estrecho de Gibraltar no ha sido una barrera para la expansión de esta y otras especies de anfibios y reptiles (Pleguezuelos et al., 2008). Las subespecies así definidas son: M. l. leprosa que se encuentra en la Península Ibérica y en Marruecos, al norte y oeste del Atlas, y M. l. saharica, que se distribuye en Marruecos, al sur y al este del Atlas, en Túnez y en el este de Argelia (Figura 8) (Fritz et al., 2005 y 2006; Pleguezuelos et al. 2008; Lovich et al., 2010). Como peculiaridad, los individuos de M. l. saharica marroquíes presentan unos característicos ojos azules (Bour y Maran, 1998).
Figura 8. Izquierda: Mauremys l. leprosa de Selouane, en el Rif Oriental. (C) H. García Peña. Derecha: Mauremys l. leprosa del Río Llobregat. (C) M. Martín Pérez.
Referencias Alarcos, G.; Flechoso, F., Lizana, M. (2010). Distribución y estado de conservación de los galápagos en Castilla y León. Informe inédito. Junta de Castilla y León. Andreu, A. C., López-Jurado, L. F. (1998). Mauremys leprosa (Schweigger 1812). Pp.103-108. En: Salvador, A. (Coord.). Reptiles. En: Ramos, M. A. et al. (Eds). Fauna Ibérica, Vol. 10. Museo Nacional Ciencias Naturales, CSIC. Madrid. Bertolero, A., Busack, S. D. (En prensa). Mauremys leprosa (Schweigger, 1812) – Mediterranean stripe-necked terrapin. In: Rhodin, A. G. J., Pritchard, P. C. H., van Dijk, P. P., Saumure, R. A., Buhlmann, K. A., Iverson, J. B., and Mittermeier, R. A. (Eds.). Conservation Biology of Freshwater Turtles and Tortoises: A Compilation Project of the IUCN/SSC Tortoise and Freshwater Turtle Specialist Group. Chelonian Research Monographs No. 5. Bickham, J.W. (1975). A cytosystematic study of turtles in the genera Clemmys, Mauremys and Sacalia. Herpetologica, 31: 198-204 Bickham, J.W., Baker, R. J.(1976). Chromosome Homology and Evolution of Emydid Turtles. Chromosoma, 54, 201-219. Bonnet, X., Delmas, V., El-Mouden, H., Slimani, T., Sterijovski, B., Kuchling, G. (2010). Is sexual body shape dimorphism consistent in aquatic and terrestrial chelonians?. Zoology, 113: 213-220. Bour, R., Maran, J. (1998). Taxonomie de Mauremys leprosa (Schweigger, 1812) dans le sud du Maroc: “la tortue aux yeux bleus” (Reptilia, Chelonii, Geoemydidae). Manouria, 1(2):22-52. Bull, J.J. (1980). Sex determination in reptiles. The Quarterly Review of Biology, 55(1): 3-21. Busack, S. D., Ernst, E. H. (1980). Variation in Mediterranean populations of Mauremys Gray 1869 (Reptilia, Testudines, Emydidae). Annals of Carnegie Museum, 49(17): 251-264. Da Silva, E. (1995). Notes on clutch size and egg size of Mauremys leprosa from Spain. Journal of Herpetology, 29: 484-485. Díaz-Paniagua, C., Andreu, A. C. (2014). Mauremys leprosa (Schweigger, 1812). Pp. 194-203. En: Salvador, A. (Coordinador). Reptiles, 2ª edición revisada y aumentada. Fauna Ibérica, vol. 10. Ramos, M. A. et al. (Eds.). Museo Nacional de Ciencias Naturales, Consejo Superior de Investigaciones Científicas, Madrid. 1367 pp. Díaz-Paniagua, C., Andreu, A.C., Marco, A., Nuez, M., Hidalgo, J., Perez-Santigosa, N. (2014). Data on nesting, incubation, and hatchling emergence in the two native aquatic turtle species (Emys orbicularis and Mauremys leprosa) from Doñana National Park. Basic & Applied Herpetology, 28: 147-153. Ewert, M. A., Nelson, C. E. (1991). Sex determination in turtles: diverse patterns and some possible adaptive values. Copeia, 1991: 50-69. Fritz, U., Fritzsch, G., Lehr, E., Ducotterd, J.-M., Müller, A. (2005). The Atlas Mountains, not the Strait of Gibraltar as a biogeographic barrier for Mauremys leprosa (Reptilia: Testudinae). Salamandra, 41: 97-106. Fritz, U., Barata, M., Busack, S.D., Fritsch, G., Castilho, R. (2006). Impact of mountain chains, sea straits and peripheral populations on genetic and taxonomic structure of a freshwater turtle, Mauremys leprosa (Reptilia, Testudines, Geoemydidae). Zoologica Scripta, 35: 97-108. Gadow, H. (1901). Amphibians and Reptiles. Volume 8. The Cambridge Natural History. Macmillan and Co. Ltd. London. González de la Vega, J. P. (1988). Anfibios y reptiles de la provincia de Huelva. Ed. Ertisa. Huelva. Hidalgo-Vila, J. (2006). Hematología y perfil bioquímico sanguíneo en las especies de galápagos Mauremys leprosay Emys orbicularis. Aspectos sanitarios y evaluación de la introducción de la especie exótica Trachemys scripta elegans sobre la fauna autóctona. Tesis Doctoral. Universidad de Sevilla. Hidalgo-Vila, J., Díaz-Paniagua, C., Pérez-Santigosa, N., Plaza, A., Camacho, I., Recio, F. (2007a). Hematologic and biochemical reference intervals of free-living Mediterranean Pond turtles(Mauremys leprosa). Journal of Wildlife Disease, 43: 798-801. Ibáñez, A. (2014). Function of multiple signals in sexual selection and antipredator strategies in the Spanish terrapin, Mauremys leprosa. Tesis doctoral no publicada. Univ. Complutense de Madrid. 266 pp. Ibáñez, A., Marzal, A., López, P., Martín, J. (2013a). Sexually dichromatic coloration reflects size and immunocompetence in female Spanish terrapins, Mauremys leprosa. Naturwissenschaften (100):1137-1147. Keller, C. (1997a). Ecología de poblaciones de Mauremys leprosa y Emys orbicularis en el Parque Nacional de Doñana. Tesis doctoral, Universidad de Sevilla.: 217 pp. Keller, C. (1997b). Discriminant analysis for sex determination in juvenile Mauremys leprosa. Journal of Herpetology, 31(3): 456-459. Keller, C. (1999). Estrategias adaptativas de los quelonios acuáticos Mauremys leprosa y Emys orbicularis en el Parque Nacional de Doñana. Memoria final de proyecto, no publicada. Fundación Caja Madrid. LIFE-Trachemys (2011a). Seguimiento de la Mauremys leprosa en el río Serpis. Evaluación y cuantificación. Proyecto LIFE-Trachemys: Estrategia y técnicas demostrativas para la erradicación de galápagos invasores (Proyecto nº LIFE+09 NAT/E/000529). Conselleria d’Infraestructures, Territori i Medi Ambient, Generalitat Valenciana. Informes - Life Trachemys 6: 15 pp. LIFE-Trachemys (2012). Seguimiento de Mauremys leprosa en el Parque Natural Chera-Sot de Chera. Evaluación y cuantificación. Proyecto LIFE-Trachemys: Estrategia y técnicas demostrativas para la erradicación de galápagos invasores (Proyecto nº LIFE+09 NAT/E/000529). Conselleria d’Infraestructures, Territori i Medi Ambient, Generalitat Valenciana. Informes - Life Trachemys 9: 19 pp. Lovich, J. E., Baamrane, Z. M., Ait Naimi, M. A., Abdelouahab, M. M. (2010). Biphasic geographic variation in sexual size dimorphism of turtle (Mauremys leprosa) populations along an environmental gradient in Morocco. Chelonian Conservation and Biology, 9(1): 45-53. Martín Pérez, M. (2011). Caracterització i conservació d’una población de tortuga de rierol (Mauremys leprosa) a l’ein riu Llobregat al terme municipal d’Abrera. Informe justificativo. Projecte ACOM 2008. Agència de Gestió d’Ajuts Universitaris i de Recerca. Ajuntament d’Abrera. 64 pp. http://hdl.handle.net/2072/117487. McDowell, S. B. (1964). Partition of the genus Clemmys and related problems in the taxonomy of the aquatic Testudinidae. Proceedings of the Zoological Society of London, 143(2): 239-278. Merkle, D. A. (1975). A taxonomic analysis of the Clemmys complex (Reptilia: Testudines) utilizing starch gel electrophoresis. Herpetologica, 31, 162–166. Muñoz, A. I., Nicolau, B. (2006). Sexual dimorphism and allometry in the stripe-necked terrapin, Mauremys leprosa, in Spain. Chelonian Conservation and Biology 5(1): 87-92. Muñoz, F.J., De La Fuente, M. (2004). Seasonal changes in lymphoid distribution of the turtle Mauremys caspica. Copeia, 2004: 178–183. Pagés, T., Peinado, V.I., Viscor, G. (1992). Seasonal changes in hematology and blood chemistry of the freshwater turtle Mauremys caspica leprosa. Comparative Biochemistry and Physiology, 103A: 275–278. Pérez, M., E. Collado, C. Ramo. (1979). Crecimiento de Mauremys caspica leprosa (Schweigger, 1812)(Reptilia Testudines) en la Reserva Biológica de Doñana. Doñana Acta Vertebrata, 6: 161-178. Pérez-Santigosa, N. (2007a). Ecología del galápago exótico, Trachemys scripta elegans, en la Península Ibérica. Efectos sobre las poblaciones autóctonas de Mauremys leprosa y Emys orbicularis. Tesis doctoral. Universidad de Sevilla. 367pp. Pleguezuelos, J. M., Fahd, S., Carranza, S. (2008). El papel del Estrecho de Gibraltar en la conformación de la actual fauna de anfibios y reptiles en el Mediterráneo Occidental. Boletín de la Asociación Herpetológica Española. 19: 1-16. Schleich, H. H. (1996). Beitrag zur Systematik des Formenkreises von Mauremys leprosa (Schweigger) in Marokko. Teil I: (Reptilia, Chelonii, Emydidae). Spixiana, Suppl. 22: 29–59. Schweigger, A.F. (1812). Prodromus Monographia Cheloniorum auctore Schweigger. Königsberg. Arch. Naturwiss. Mathem., 1: 271-368, 406-458. Verissimo, J., Pereira, P., Lopes, S., Teixeira, J., Fritz, U., Velo-Antón, G. (2013). Cross-amplification of microsatellite loci for the Mediterranean stripe-necked terrapin (Mauremys leprosa). Amphibia-Reptilia, 34 (2): 259-262. Vidal, L. B., Saura-Mas, S. (2009). Avaluació de l’estat de conservació de la població de tortuga de rierol (Mauremys leprosa) dels estanyols del Mas Margall, Avinyonet de Puigventós. Annals de l'Institut d'Estudis Empordanesos, 40: 131-146.
Carmen Díaz-Paniagua1, Ana C. Andreu1, Claudia Keller2 Fecha de publicación: 27-10-2015 Díaz-Paniagua, C., Andreu, A. C., Keller, C. (2015). Galápago leproso – Mauremys leprosa. En: Enciclopedia Virtual de los Vertebrados Españoles. Salvador, A., Marco, A. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||