|
|
|
|
|
|
Para más información sobre cada apartado hacer click en:
|
Key words: Pyrenean Chamois, Cantabrian Chamois, diet.
Ecología trófica
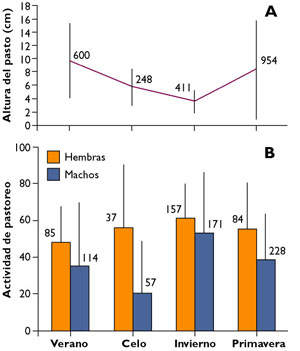
Cordillera Cantábrica Tanto machos como hembras ajustan el tiempo que dedican a pastar en relación a la disponibilidad de alimento, la cual varía mucho entre estaciones, sobre todo en las cotas más altas de las montañas. Durante el invierno tanto machos como hembras dedican un 60% de su actividad diurna al forrajeo. En machos los mínimos en actividad de forrajeo tienen lugar durante el celo (20%). En verano, durante el celo y también en primavera, las hembras pasan más tiempo pastando que los machos (Figura 1) (Pérez-Barbería et al., 1997). Mediante el uso de radio marcaje y sensores de actividad se ha demostrado que el rebeco es principalmente diurno, con muy poca actividad de pastoreo durante la noche (Pérez-Barbería y Mutuberría, com. per.).
Figura 1. Relación entre la actividad de diurna pastoreo de machos y hembras a lo largo del año y la disponibilidad de alimento estimada mediante la altura media del pasto (gramíneas y herbáceas) en una zona de la montaña cantábrica (Concejo de Caso). La actividad de pastoreo se calculó mediante observaciones instantáneas cada 15 minutos a lo largo del día. Los números indican el tamaño de la muestra y las líneas verticales son las desviaciones estandar (extraído de Pérez-Barbería, 1994).
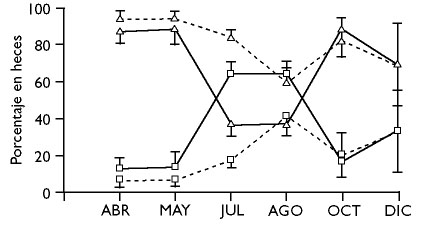
El rebeco cantábrico utiliza pastos subalpinos y alpinos que generalmente están fuera del alcance de la mayoría de las especies domésticas, principalmente vacas, caballos y ovejas. Esto le permite explotar pastos que son abundantes y muy diversos en especies vegetales debido a la variación altitudinal. En la montaña cantábrica (Concejo de Caso, Asturias) la biomasa vegetal presenta mínimos entre mediados de noviembre y abril. El pico en la producción vegetal de los pastos tiene lugar a principios de julio y rápidamente disminuye en agosto. La cabaña ganadera accede a los pastos subalpinos en mayo, alcanzando el máximo número de cabezas en agosto. En el mes de julio las áreas ocupadas por las especies domésticas (entre 1.450-1.500 m) tienen hasta tres veces menos pasto que los pastos de mayor altitud ocupados por los rebecos (1.540-1.640 m). La variación de la calidad del pasto (contenido en nitrógeno) no sufre tanta variación como la producción vegetal. El mayor contenido en nitrógeno tiene lugar en mayo y el mínimo en invierno (Pérez-Barbería, 1994). Los rebecos evitan compartir las áreas de pastoreo estival con el ganado y en algunos puertos los rebecos se ven desplazados hacia lugares rocosos con fuerte pendiente y bordes de hayedo alejados de las majadas (Rebollo et al., 1993). Una situación similar se observa en los pastos estivales pirenaicos de escasa altitud, en donde los sarrios se confinan en el bosque durante la estancia de los rebaños domésticos (Herrero et al., 1996). El rebeco cantábrico tiene preferencia por incorporar en su dieta graminoides, aunque también ingiere especies leñosas, cuando la disponibilidad de las graminoides decae. El mayor consumo de graminoides tiene lugar en primavera (abril y mayo, entre el 85-95% del total de la dieta), cuando su contenido en nitrógeno es mayor. Los mínimos en el consumo de graminoides tiene lugar entre julio y agosto y en invierno, en estos periodos es cuando el consumo de especies leñosas se incrementa hasta alcanzar máximos del 70% (entre julio y agosto). Un pico secundario en el consumo de gramíneas tiene lugar en octubre, cuando los pastos rebrotan con las lluvias otoñales y la temperatura es todavía benigna. Por regla general las hembras consumen mayor proporción de gramíneas en comparación con los machos, sobre todo entre julio y agosto (hembras: 60-85% de gramíneas, machos: 35%) (Figura 2) (Pérez-Barbería, 1994; Pérez-Barbería et al., 1997). Estas marcadas diferencias entre sexos en la dieta de verano están condicionadas a la segregación sexual que ocurre en este periodo. Las hembras con crías ocupan pastos situados a mayor altitud que los machos, en estos lugares se mantienen lejos de las molestias humanas y de depredadores como zorros y lobos. Las especies de leñosas más frecuentemente incluidas en la dieta del rebeco cantábrico son los brezos, principalmente brecina (Calluna vulgaris) y varias especies de brezo (Erica sp) Ver Figura 3. En la montaña cantábrica son los brezos las especies dominantes de hoja perenne, no existiendo prácticamente coníferas, a diferencia de otras cadenas montañosas dentro de la distribución del género. En invierno un gran porcentaje de los pastos subalpinos se cubren de nieve y son sólo los brezos, especies arbustivas de porte medio, los que afloran en la nieve y son ramoneadas por los rebecos.
Figura 2. Porcentaje de la cantidad de especies herbáceas y leñosas (principalmente brezos) en la dieta del rebeco cantábrico a lo largo del año. Línea continua: machos; línea discontinua: hembras; triángulo: especies herbáceas; cuadrado: especies leñosas; las líneas verticales representan las desviaciones estándar.
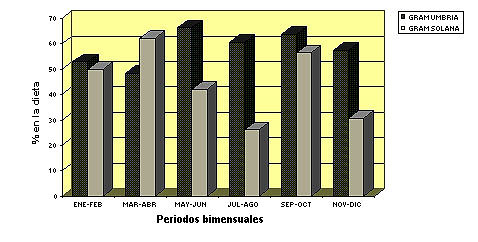
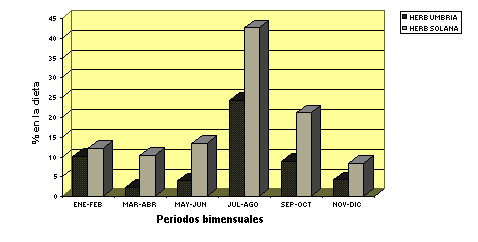
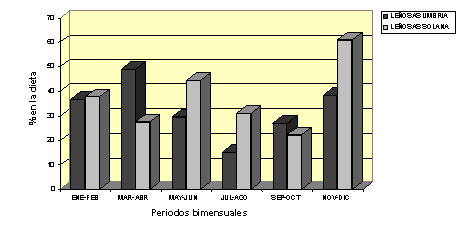
Pirineos Características generales del régimen alimentario El rebeco de los Pirineos dedica en verano entre un 50 - 60% de su tiempo a pastar, sin embargo invierte muy poco tiempo en desplazarse y bastante en reposar si no es molestado (Pepin et al., 1991; Aldezabal et al., 1999). Esta parece ser una estrategia destinada a minimizar los gastos energéticos y a aumentar la adquisición de energía y nutrientes. Las principales especies pascícolas, que forman parte de la dieta del sarrio (por ej. Festuca rubra), poseen en verano un contenido en proteína que supera sus necesidades (García-González y Montserrat, 1986; García-González y Alvera, 1986). Además el sarrio, mediante diversas estrategias (desplazamientos espacio-temporales, selección de especies y partes de las plantas), lleva a cabo una selección activa que le permite ingerir una dieta de más alta calidad que la media disponible (Aldezabal y García-González, en prensa). Con ello los depósitos grasos pueden aumentar hasta un 10-12% del peso corporal en verano (Drescher-Kaden, 1977; Hofmann, 1982), y disponer de estas reservas en los períodos de carestía en el invierno, lo cual es un factor importante para aumentar su supervivencia. En cuanto a la distribución del tiempo de pastoreo, el patrón es de tipo multimodal (Aldezabal et al., 1999), con varios máximos de actividad a lo largo del día. El acortamiento del período de luz durante el invierno evidencia dos máximos de actividad, al amanecer y al atardecer (Pepin et al., 1991; Ciefolo et Boissier, 1992). El sarrio tiende a ingerir más cantidad de especies herbáceas que de leñosas (García-González, 1984; Aldezabal y García-González, en prensa), incluso cuando habita en medios forestales (García-González y Cuartas, 1996), al igual que sucede en los Alpes (Perle y Hamr, 1985). Sólo cuando la nieve cubre la mayor parte de los pastos en invierno es cuando el sarrio ingiere gran cantidad de leñosas, tanto en Pirineos (Berducou, 1974) como en Europa central (Obrtel et al., 1984; Kozena, 1986). En esas condiciones se alimenta de coníferas, ericáceas y otros arbustos que sobresalen de la nieve y cuando la densidad poblacional de la especies es localmente muy elevada puede causar daños a las especies forestales (Berducou, 1972). Los índices mejorados de vegetación obtenidos vía satélite (EVI) pueden ser utilizados como una aproximación de la composición y calidad de la dieta del rebeco. Un estudio realizado en Pirineos mostró que el 68,4% de la composición y calidad de la dieta en primavera y el 53,3% en invierno pueden ser explicados por índices EVI (Villamuelas et al., 2016)2. Variaciones espacio-temporales del régimen alimentario El régimen alimentario del sarrio experimenta variaciones que responden a la disponibilidad de los recursos tróficos. Por ejemplo, en el Parque Nacional de Ordesa se realizó un estudio (Figura 3) para comparar la alimentación de dos poblaciones muy próximas pero que no se solapaban en el uso del espacio (Aldezabal, 1996; García-González y Cuartas, 1996), una ocupando una exposición de umbría (población U) y otra de solana (población S). En el balance anual ambas poblaciones mostraron una dieta mixta con predominio de graminoides sin grandes diferencias entre ambas poblaciones en composición general de la dieta [graminoides (58,3% U y 44,5% S), dicotiledóneas herbáceas (9% U y 18% S) y leñosas (32,7% U y 37,5% S)]. Sin embargo, la composición florística de la dieta varió significativamente entre ambas poblaciones en respuesta a las diferencias de hábitat. Las graminoides más abundantes fueron Festuca rubra (26,1% y Sesleria coerulea (13%) en la población U y F. rubra (21,1%) y F. indigesta (4,4%) en la población S. Las leñosas más consumidas fueron Pinus spp. (15,5%) y Abies alba (2,9%) en la población U y Calluna vulgaris (12,6%), Echinospartium horridum (12,3%) y Pinus spp. (9,2%) en la población S. Ambas poblaciones consumieron una gran diversidad de especies dicotiledóneas herbáceas, todas ellas con porcentajes inferiores al 1% en la dieta. En la figura 3 se observan aumentos temporales del consumo de algunos componentes vegetales, que a veces coinciden con el estado fenológico óptimo de las especies consumidas. En la población U el consumo de graminoides se mantuvo relativamente constante, mientras que en la población S descendió en primavera-verano coincidiendo con el máximo de floración de las dicotiledóneas herbáceas y de la leñosa Echinospartium horridum (erizón )(junio-julio). En la población U el consumo de leñosas es máximo en invierno debido a la escasez de herbáceas por causa de la nieve. En la población S el consumo de leñosas aumentó en primavera con la floración del erizón (72% en junio) y en otoño con un alto consumo de brecina (Calluna vulgaris) (63% en noviembre).
(A)
(B)
(C)
Figura 3. Comparación de la composición de la dieta entre las poblaciones de la Umbría de Arazas (oscuro) y la Solana de Diazas-Punta Acuta (gris claro) en el Parque Nacional de Ordesa y Monte Perdido por periodos bimensuales. (A) abundancia de graminoides, (B) abundancia de dicotiledóneas herbáceas; (C) abundancia de especies leñosas. (Aldezabal y García-González, en prensa).
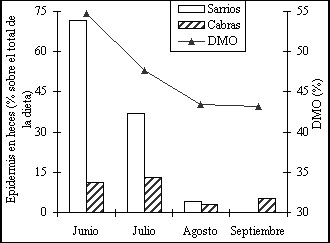
En la figura 4 se ha representado la variación de la digestibilidad del erizón (Echinospartum horridum) durante el período vegetativo y su nivel de consumo por el sarrio y otros herbívoros ramoneadores. El rebeco pirenaico, al igual que otros ungulados generalistas (Owen-Smith, 1994), parece mostrar un aprovechamiento óptimo de los recursos tróficos disponibles. Altos consumos de arbustos y herbáceas se observan cuando su estado fenológico ofrece mayor digestibilidad y concentración de proteína.
Figura 4. Estima del consumo de erizón (Echinospartum horridum) por sarrios (Rupicapra pyrenaica) y cabras domésticas durante el período estival y posible relación con los cambios que se producen en su digestibilidad (según Aldezabal, 2001 y Marinas et al., 2003). Los datos de consumo y digestibilidad no corresponden al mismo año, ni zona de estudio.
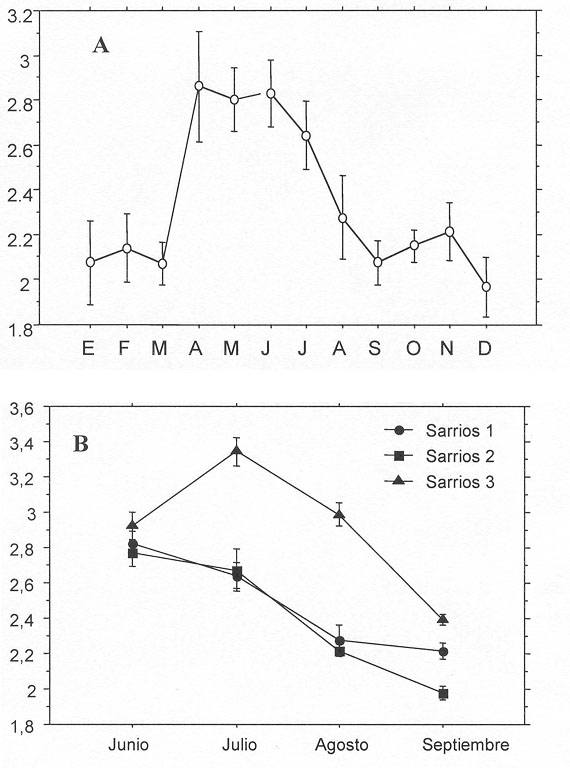
Calidad de dieta y migraciones La concentración de nitrógeno en las heces muestra, en general, una buena correlación con el nitrógeno (N) ingerido en la dieta y por ello suele utilizarse como un indicador de la calidad de la dieta en herbívoros salvajes (Blanchard et al., 2003). En la figura 5 se han expuesto los valores medios mensuales del contenido en N fecal correspondientes a varias de las subpoblaciones de sarrios estudiadas. En general, la variación mensual del N fecal muestra un patrón unimodal, alcanzando un pico máximo durante los meses de primavera (Figura 5A). Esta tendencia puede ser atribuida a los cambios en la concentración de N que sufren las plantas a lo largo de su desarrollo fenológico. Las especies vegetales son ricas en N durante la primera fase de crecimiento (Mattson, 1980; Van Soest, 1994). Una vez florecen, la cantidad de N comienza a descender hasta llegar a valores mínimos durante la etapa de marchitamiento y senescencia, perdiendo notablemente sus propiedades nutritivas (Marinas et al., 2003). En la figura 5B puede observarse como los grupos de sarrios supraforestales que migran altitudinalmente por encima de los 2.500 m, obtienen un segundo máximo de N fecal en julio, lo que podría suponer una ganancia extra en proteína para ese grupo. Los grupos migradores que siguen la onda fenológica del crecimiento de las plantas con la altitud (García-González et al., 1990), podrían beneficiarse de una mejor calidad de dieta (Crampe, 1997; Loison et al., 1999), con las correspondientes repercusiones sobre su capacidad de supervivencia y reproducción, tal como se ha sugerido para el ciervo (Morgantini y Hudson, 1989).
Figura 5. Variación mensual de la concentración de N fecal (%) correspondiente a varias subpoblaciones de sarrios del PNOMP y Zona Periférica. (A) Evolución anual de la subpoblación forestal de solana (1.400-2.000 m); (B) Evolución estival de la subpoblación forestal de solana (sarrios 1), supraforestal baja (1.950-2.500 m)(sarrios 2) y supraforestal alta (2.500-2.950 m)(sarrios 3). Las barras verticales indican los intervalos de confianza al 95%. Según Aldezabal (1996 y 2001).
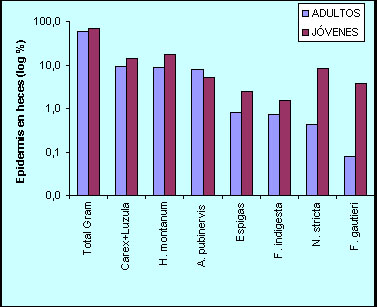
Variación de la dieta con la edad La dieta de adultos y jóvenes es muy similar, al menos durante la época estival (Figura 6). En ovejas y cabras se ha comprobado que las crías aprenden de sus madres los alimentos que deben comer y posteriormente muestran preferencia por ellos (Mirza y Provenza, 1990). En un estudio comparativo realizado en 1984 (Figura 6) se comprobó que, a pesar de ser muy parecidas, las dietas de jóvenes y adultos presentaban diferencias: los jóvenes consumieron cantidades ligeramente superiores de especies menos digestibles (Festuca indigesta, F. gautieri, Nardus stricta) y más aparentes (Helictotrichon montanum, espigas). También la diversidad de la dieta fue menor en estos últimos. Estas diferencias probablemente fueron debidas a la inmadurez de los mecanismos de selección de alimento (García-González, 1984).
Figura 7. Comparación de la dieta estival del sarrio entre jóvenes y hembras adultas determinada mediante análisis microhistológico de las heces. Medias de 6 grupos o manadas muestreados en diferentes meses y años. El orden de importancia de los principales componentes de la dieta es similar (Spearman Z = 1,89; p =0,06) (según García-González, 1984).
Referencias Aldezabal, A. (1996). Estudio nutricional del sarrio (Rupicapra pyrenaica pyrenaica) en la Reserva de Caza de Viñamala. Informe final. Instituto de Estudios Altoaragoneses, Huesca. Aldezabal, A. (2001). El sistema de pastoreo del Parque Nacional de Ordesa y Monte Perdido (Pirineo Central, Aragón). Interacción entre la vegetación supraforestal y los grandes herbívoros. Publicaciones del Consejo de Protección de la Naturaleza de Aragón, Zaragoza. Aldezabal, A., García-González, R. (2004). La alimentación del sarrio (Rupicapra p. pyrenaica) en el Pirineo Central. En: Herrero, J., Escudero, E., Luco, D.F.d., García-González., R. (Eds.). El sarrio: biología, patología y gestión. (presentado en las Jornadas sobre el sarrio 2003). Consejo Protección de la Naturaleza de Aragón, Gobierno de Aragón, Zaragoza. Aldezabal, A., Garin, I., García-González, R. (1999). Activity rhythms and the influence of some environmental variables on summer ungulate behaviour in Ordesa-Monte Perdido National Park. Pirineos, 153-154: 145-157. Berducou, C. (1972). L'isard nuit-il à l'environnement? Pirineos, 105: 119-127. Berducou, C. (1974). Contribution a l'étude d'un problème éco-phisiologique pyrénéen: L'alimentation Hivernale de l'Isard. n.º 428. Ecole Nationale Superieure Agronomique de Toulouse. Blanchard, P., Festa-Bianchet, M., Gaillard, J.M., Jorgenson, J.T. (2003). A test of long-term fecal nitrogen monitoring to evaluate nutritional status in bighorn sheep. Journal of Wildlife Management, 67: 477-484. Ciofolo, I., Boissier, M. (1992). Diurnal fluctuations in activity in the izard. J. Ethol., 10: 1-5. Crampe, J. P. (1997). Caractéristiques bio-démographiques d'une population d'isards (Rupicapra p. pyrenaica) non-chasée dans le Parc National des Pyrénées, en vallée de Cauterets. Documents scientifiques du Parc National des Pyrénées, 31: 1-169. Drescher-Kaden, V. (1977). Energy supply of chamois: microbial fermentations of natural food in rumen and cecum during summer and winter in the Alps. Pp. 114-124. XIIIth Congress of Game Biologist. Wildlife Soc., Washington. García-González, R. (1984). L'emploi des épidermis végétaux dans la determination du regime alimentaire de l'isard dans les Pyrénées occidentales. Documents d'Ecologie Pyrénéenne, 3-4: 307-313. García-González, R., Alvera, B. (1986). Relaciones entre la composición mineral de plantas abundantes en pastos supraforestales pirenaicos y su utilización por los rumiantes. Pp. 249-265. Actas XXVI Reunión Cientifíca de la S. E. E. P. Consejería de Agricultura y Pesca, Oviedo. García-González, R., Cuartas, P. (1996). Trophic utilization of a montane/subalpine forest by chamois (Rupicapra pyrenaica) in the Central Pyrenees. Forest Ecology and Management, 88: 15-23. García-González, R., Montserrat, P. (1986). Determinación de la dieta de ungulados estivantes en pastos supraforestales del Pirineo Occidental. Pp. 119-134. Actas XXVI Reunión Científica de la S. E. E. P. Consejería de Agricultura y Pesca, Oviedo. García-González, R., Hidalgo, R., Montserrat, C. (1990). Patterns of time and space use by livestock in the Pyrenean summer ranges: a case study in the Aragon valley. Mountain Research and Development, 10: 241-255. Herrero, J., Garin, I., García-Serrano, A., García-González, R. (1996). Habitat use in a Rupicapra pyrenaica pyrenaica forest population. Forest Ecology and Management, 88: 25-30. Hofmann, R. R. (1982). Adaptation saisonniere et evolutive du tractus digestif du chamois (Rupicapra rupicapra). Pp. 82-88. En: C.I.C. (Ed.).. Symposium Chamois, Paris. Kozena, I. (1986). Further data on the winter diet of chamois, Rupicapra rupicapra, in the Jeseniky mountains. Folia Zoologica, 35: 207-214. Loison, A., Jullien, J. M., Menaut, P. (1999). Subpopulation structure and dispersal in two populations of chamois. Journal of Mammalogy, 80: 620-632. Marinas, A., García-González, R., Fondevila, M. (2003). The nutritive value of five species occurring in the summer grazing ranges of the Pyrenees. Animal Science, 76: 461-469. Mattson, W. J. J. (1980). Herbivory in relation to plant nitrogen content. Ann. Rev. Ecol. Syst., 11: 119-161. Mirza, S. N., Provenza, F.D. (1990). Preference of the mother affects selection and avoidance of foods by lambs differing in age. Applied Animal Behaviour Science, 28: 255-263. Morgantini, L. E., Hudson, R. J. (1989). Nutritional significance of wapiti (Cervus elaphus) migrations to alpine ranges in Western Alberta, Canada. Arctic and Alpine Research, 21: 288-295. Obrtel, R., Holisova, V., Kozena, I. (1984). The winter diet of chamois, Rupicapra rupicapra rupicapra, in the Jeseniky mts. Folia Zoologica, 33: 327-388. Owen-Smith, N. (1994). Foraging responses of Kudus to seasonal changes in food resources: elasticity in constraints. Ecology, 75: 1050-1062. Pérez-Barbería, F. J. (1994). Biología, ecología y caracterización genética del rebeco cantábrico (Rupicapra pyrenaica parva). Tesis doctoral, Universidad de Oviedo. 112 pp. Pérez-Barbería, F. J., Oliván, M., Osoro, K., Nores, C. (1997). Sex, seasonal and spatial differences in the diet of Cantabrian chamois Rupicapra pyrenaica parva. Acta Theriologica, 42: 37-46. Perle, A., Hamr, J. (1985). Food habits of chamois (Rupicapra rupicapra L.) in Northern Tyrol. Pp. 77-84. En: Lovari, S. (Ed.). The Biology and Management of Mountain Ungulates. Croom Helm, London. Rebollo, S., Robles, L., Gómez-Sal, A. (1993). The influence of livestosck management on land use competition between domestic and wild ungulates: sheep and chamois Rupicapra pyrenaica parva Cabrera in the Cantabrian range. Pirineos, 141-142: 47-62. Van Soest, P. J. (1994). Nutritional ecology of the ruminant. Cornell Univ. Press, Ithaca and London. Villamuelas, M., Fernández, N., Albanell, E., Gálvez-Cerón, A., Bartolome, J., Mentaberre, G., López-Olvera, J. R., Fernández-Aguilar, X., Colom-Cadena, A., López-Martín, J. M., Pérez-Barbería, J., Garel, M., Marco, I., Serrano, E. (2016). The Enhanced Vegetation Index (EVI) as a proxy for diet quality and composition in a mountain ungulate. Ecological Indicators, 61 (2): 658-666.
Francisco Javier Pérez-Barbería Ricardo García-González Borja Palacios Alberti Fecha de publicación: 16-06-2004 Revisiones: 24-07-2008; 28-10-2010 Otras contribuciones: 2. Alfredo Salvador. 10-08-2017 Pérez-Barbería, F. J., García-González, R., Palacios, B. (2017). Rebeco – Rupicapra pyrenaica. En: Enciclopedia Virtual de los Vertebrados Españoles. Salvador, A., Barja, I. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
|
|
|
|
|
|
|