|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Para más información sobre cada apartado hacer click en:
|
Key words: Pyrenean Chamois, Cantabrian Chamois, reproduction, demography.
Reproducción y demografía El celo tiene lugar en noviembre. Durante el mismo se forman harenes regidos por un macho que monopoliza hasta unas 10 hembras de diferentes clases de edad. Otros machos pueden rondar los entornos del harén pero si se aproximan en exceso el macho a cargo del harén los expulsa con una rápida carrera y atacando con los cuernos. Las peleas no son frecuentes, simples escaramuzas y rápidas carreras entorno al harén. Las hembras pasan la mayor parte del tiempo pastando ajenas a la actividad de los machos. Los machos a cargo de los harenes suelen frotarse el abdomen contra el suelo del territorio, dejando marcas olfativas que parece estimular a las hembras en estro. Los harenes se emplazan en pastos subalpinos, próximos a zonas de escape (peñas y riscos, principalmente), ocupando extensiones de aproximadamente 2-3 ha. Es difícil establecer si el macho líder protege la zona y las hembras la ocupan posteriormente (como parece ser el caso del rebeco alpino) o si por el contrario es el macho el que selecciona las zonas frecuentadas por las hembras para establecer su harén. En ocasiones el macho líder reagrupa a las hembras mediante carreras entorno a ellas. Se ha observado que al menos por un periodo de tres días los harenes se mantienen constantes tanto en su composición como en su ubicación. Durante el celo los machos reducen drásticamente el tiempo dedicado a pastar. Algunos machos presentan un comportamiento territorial, habiéndose observado la ocupación de las mismas áreas durante gran parte del año y el marcaje de arbustos con las glándulas parietales En el rebeco, la calidad del esperma no difiere entre la estación no reproductiva (junio a mediados de septiembre) y la estación reproductiva (octubre y noviembre). Sin embargo, en la estación no reproductiva hay menos machos con esperma de calidad (Martínez-Pastor et al., 2005).
Cordillera Cantábrica Biología de la reproducción Los primeros partos se registran a primeros de mayo (Pérez-Barbería 1994). Las hembras paren un solo cabrito. Existen observaciones de hembras acompañadas por dos cabritos, pero son tan escasas que está por confirmar si se trata de adopciones temporales o si son realmente partos dobles (Pérez-Barbería y Mutuberria, com pers). De un total de 56 hembras capturadas entre 1992 y 1993 el 90,4% de las mayores de 3 años habían ovulado mientras que ninguna de las hembras de 1 ó 2 años había ovulado (Pérez-Barbería et al. 1998). La observación del aparato reproductor de hembras capturadas permite saber si son primerizas. El útero de aquellas hembras que nunca han estado preñadas presenta un color rosado pálido, está poco vascularizado, con trompas finas y poco desarrolladas y con un miometrio delgado, liso y muy homogéneo. Por el contrario, los úteros de las hembras que ya se han reproducido al menos una vez son de color más oscuro, con un tejido muy vascularizado, que presenta paredes gruesas con bandas transversales rugosas y trompas bien desarrolladas (Pérez-Barbería 1994; Pérez-Barbería et al. 1998) (Figura 1). No se tiene información reproductora sobre las hembras de 3 años, aunque para la especie Rupicapra rupicapra se conoce que entre el 80 y 93 % de las hembras de 3 años son sexualmente maduras (Storch, 1989; Houssin et al., 1993). El porcentaje de hembras preñadas desciende hasta el 50% en animales mayores de 11 años, aunque se han encontrado hembras de 19 años preñadas. Éxito reproductivo Los censos para contar hembras con cabritos son muy útiles para usar la relación número de cabritos/número de hembras adultas como índice de éxito reproductivo de la población. Según una serie de conteos realizados en Asturias en los veranos correspondientes a los años 1990-2007, el número de hembras adultas con cabritos variaba entre el 52% y el 63%, con una media del 60% (es=1,5, n = 8) (González-Quirós et al., 2009), y de los censos del Parque Nacional de Picos de Europa y sierras adyacentes entre los años 1986-2008 el éxito reproductivo variaba entre el 54-100% (media=76, es=3,4, n=20) (Palacios, 2009) . Este tipo de índice reproductor infravalora la tasa de natalidad entre un 30-40% por debajo de la obtenida mediante la inspección de los ovarios, ya que está afectado por la mortalidad transcurrida entre la fecha de los partos y la fecha en que se realiza el censo, entre 45 y 60 días después. Es muy importante definir la fecha en que se realiza el censo de crías para tener una idea del efecto de la mortalidad post-natal en el índice. El uso combinado de la inspección de los ovarios y censos post-natales es de gran ayuda para calcular la tasa de mortalidad post-natal.
Pirineos Los nacimientos están muy sincronizados en Pirineos pues el 80% de las crías nacen en 25 días y son muy repetibles. La plasticidad fenotípica permite a las hembras responder a los cambios anuales que se registran en la fenología de las plantas, aunque hay diferencias estacionales. Un avance de diez días en la fenología de las plantas en otoño determinó un avance de 39 días en la fecha de nacimientos mientras que un avance de diez días en primavera determinó un avance de 13 días (Kourkgy et al., 2016)2. Tasa de fertilidad En la tabla 1 se exponen los valores de varios parámetros reproductivos y demográficos recopilados de diversos estudios llevados a cabo en los Pirineos. Como puede observarse la tasa de fertilidad (proporción de cabritos en relación a hembras mayores de 2 años), muestra una gran variabilidad, oscilando entre el 50 y 90% con una media del 70%.
Tabla 1. Parámetros demográficos del sarrio en varias Reservas y espacios protegidos de los Pirineos. *poblaciones no sometidas a actividad cinegética.
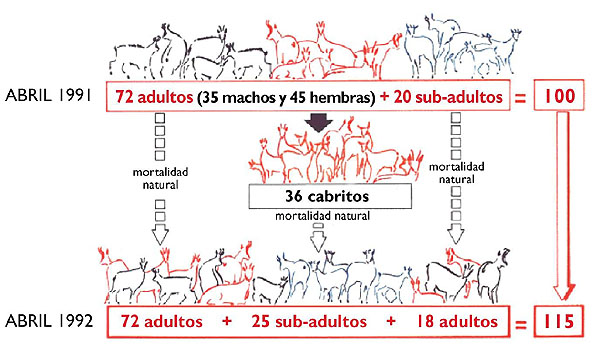
Estas tasas de fertilidad son aproximadas, pero permiten algunos comentarios generales sobre la tendencia poblacional. Con los datos expuestos en la tabla 1, se aprecia que el índice de fertilidad no está relacionado con la densidad, al igual que sucede con el rebeco de los Alpes (Allainé et al., 1990; Capurro et al., 1997). Censos repetidos en el mismo territorio durante años consecutivos, y por tanto con ligeras variaciones de la densidad, arrojan tasas de fertilidad muy diferentes (Tabla 1). En una de las poblaciones más densamente pobladas de los Pirineos (Reserva de Orlu; densidad: 34 indiv/km2), la tasa de fertilidad de las hembras maduras fue del 89% (Loison et al., 1999). Lo mismo se ha observado en otras subespecies de rebeco (Salzmann, 1977; Lovari y Cosentino, 1980). Como posibles causas de las fuertes variaciones de la fertilidad cabe pensar más bien en la influencia de factores climáticos y en la abundancia de recursos tróficos, que a su vez pueden estar relacionados entre sí. Unas condiciones climáticas adversas, especialmente al final de la gestación e inicio del período de partos (meses de abril-mayo), puede repercutir en un peor desarrollo del feto, bajos pesos al nacimiento, reducción de la producción de leche, problemas de termorregulación de los neonatos, etc, lo cual disminuye su supervivencia. Couilloud et al. (1999) encuentran para una población de los Alpes que el peso de los cabritos en otoño está significativamente correlacionado con la densidad poblacional y la precipitación en invierno. La edad de las madres también es un factor importante en la fertilidad. Esta alcanza su óptimo a los 4 años y se mantiene en torno al 80% hasta los 13 años de edad, a partir de la cual desciende (Crampe et al., 2004). Berducou et al. (1982) mencionan la desviación de la sex-ratio como posible factor de influencia sobre la tasa de fertilidad. El argumento sería que con sex-ratios fuertemente desviadas a favor de las hembras los machos tendrían más dificultad para cubrirlas a todas. Los datos expuestos en la tabla 1 no parecen sustentar esta hipótesis dada la ausencia de correlación entre ambos parámetros. Mortalidad de los cabritos Un aspecto casi más importante que el de la tasa de fertilidad, desde el punto de vista de la demografía, es el de la mortalidad de los cabritos nacidos en el año, y ligada con ella la tasa de reclutamiento de la población. Se han descrito dos máximos de la mortalidad infantil: uno a mitad de verano, que podría estar relacionado con una bajada de defensas inmunológicas (consecuencia de la disminución del suministro de calostro, Hars et Gauthier en Crampe, 1997), y otro durante el invierno, producido fundamentalmente por las rigurosas condiciones climáticas de la alta montaña. El primer pico ha sido estimado en un 15%, a partir de un seguimiento de 6 años en dos macizos del Pirineo aragonés (Herrero et al., 2002). El segundo máximo, cuantitativamente más importante, se suele dar durante las primeras fuertes nevadas del invierno y podría estar relacionado con un déficit de peso mínimo, consecuencia de una mala alimentación o de partos tardíos (Crampe, 1997). En su conjunto las tasas de mortalidad durante el primer año de vida oscilan entre el 40% y 50%. En la Reserva de Orlu, a partir de un seguimiento con animales marcados, se ha encontrado una tasa de supervivencia anual para los cabritos de 0,62 para las hembras y 0,64 para los machos (Loison, 1995). Como parte del mismo estudio se encontró una tasa de supervivencia de 0,58 en las cabritas en los Alpes (Loison et al., 1994). En el Parque Nacional de los Picos de Europa (Cordillera Cantábrica) la mortalidad durante los primeros meses de vida de los cabritos puede variar desde el 5 al 80%, dependiendo de las condiciones ambientales, especialmente la abundancia de precipitación en forma de nieve. (Palacios, 2009) Reclutamiento y edad de la primera reproducción La tasa de reclutamiento es la proporción de la población que accede a la reproducción y suele estimarse como la proporción de jóvenes entre 1 y 2 años (primales). En rigor debería tomarse entre 1 y 3 años ya que en muchas poblaciones, especialmente las estabilizadas, las hembras no acceden a la reproducción hasta después de los 3 años (Crampe et al., 2004). En poblaciones consideradas como "colonizadoras" el 63% de las primalas se reproducen (Houssin et al., 1993). El acceso a la reproducción por parte de las jóvenes probablemente este ligado a la adquisición de un peso corporal mínimo (Bauer, 1985). Por tanto, podría estar conectado con la abundancia de recursos y el nivel de competencia dentro de la población y ser dependiente de la densidad de la población. A pesar de que a partir de los 13 años la fertilidad de las hembras desciende, la edad reproductora puede mantenerse hasta los 18 años (Crampe et al., 2004). En un estudio realizado en el Parque Nacional de los Pirineos, se observó que las tasas de reclutamiento varían entre años y entre zonas y eran bajas tanto en hembras jóvenes (0.156 a los tres años de edad y 0.221 a los cuatro años de edad) como en hembras de mayor edad (0.414 por año para hembras de 5 a 16 años) (Crampe et al., 2006). Tomando la proporción de primales como estimador del reclutamiento, se obtienen cifras medias del 12% (Parc National des Pyrénées, Crampe, 1997) y entre 14 y 18% en Posets-Maladeta (Herrero et al., 2002). Estos valores, notoriamente bajos si se comparan con otras especies de ungulados, provocan que las tasas de crecimiento de las poblaciones de este género sean muy bajas (Figura 1). Debido al bajo crecimiento poblacional se recomiendan cupos de caza en torno al 5%.
Figura 1. Representación esquemática del incremento anual medio de una población de rebecos con una sex-ratio de 0,78 (M/H), fertilidad de 0,8 (C/H), mortalidad infantil del 30% y mortalidad adulta del 10% (adaptado a partir de Corti, 1992, ONCFS).
Mortalidad de adultos La tasa de supervivencia de los adultos es alta, en torno a 0,90, y su senescencia tardía: a partir de los 11 años la tasa de mortalidad comienza a superar el 90% (Crampe, 1997). En los Alpes también se han encontrado tasas de supervivencia altas para las hembras: 0,96, 0,91 y 0,58 para hembras adultas, primalas (1,5 - 3,5 años) y cabritas, respectivamente (Loison et al., 1994). La longevidad también es muy alta, teniendo en cuenta que se trata de un ungulado de pequeño tamaño (Peters, 1983), pudiendo sobrepasar los 20 años de vida. A pesar de que en algunas poblaciones del Pirineo Central no se han encontrado diferencias entre sexos en las tasas de supervivencia (González y Crampe, 2001), en otras del Pirineo Oriental sí se han descrito, siendo ligeramente superiores para las hembras (0,85) respecto de los machos (0,70) (Allainé et al., 1991). En un estudio realizado en el Parque Nacional de los Pirineos, se observó que la estructura demográfica de edades varió entre el Parque Nacional de los Pirineos y una zona de colonización (Bazes). El 50% de las hembras eran menores de 5 años y el 19% tenían más de diez años en el Parque frente al 67% y el 3.6%, respectivamente en Bazes. La tasa de incremento fue menor en el Parque (1.037) que en Bazes (1.262). El tiempo de generación fue 4,97 años en Bazes y 8,25 años en el Parque (Crampe et al., 2006). Sobre las causas de la mortalidad no hay un acuerdo unánime, ya que es difícil deslindar los factores ambientales de los denso-dependientes en los parámetros poblacionales. Varios estudios indican que la climatología (especialmente la cantidad de nieve en invierno) tendría una gran incidencia sobre la mortalidad de los cabritos, pero la de los adultos estaría más ligada a la densidad (Capurro et al., 1997). De todas formas otros estudios indican un aumento de la mortalidad de adultos en inviernos de mucha innivación (Framarin, 1985; Crampe, 1997; Chovancová y Gömory, 2000).
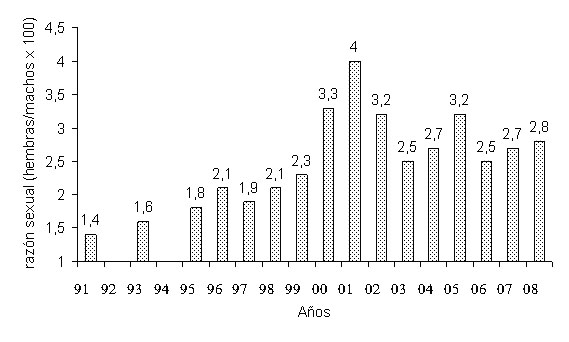
Sex-ratio Pirineos Los datos expuestos en la tabla 1 muestran como en prácticamente todas las poblaciones prospectadas en la vertiente española de los Pirineos, la sex-ratio está desviada a favor de las hembras (1,6 hembras por macho, en promedio). También los datos procedentes de la vertiente francesa muestran la misma tendencia: 1,3 hembras por macho en Cauterets (Crampe, 1997) y 2,7 en Orlu (Loison et al., 1999). La desviación se mantiene tanto en poblaciones no sometidas a explotación cinegética (Tabla 1) como en poblaciones introducidas (Levet et al., 1995). Asumiendo que la relación de sexos sea paritaria al nacimiento, la desviación de la sex-ratio en edad adulta se atribuye a una mayor mortalidad de los machos o a tasas de emigración más altas (Loison et al., 1999). Los machos que acceden a la reproducción podrían experimentar una fuerte pérdida de peso durante el celo (ver Figura 6 en Identificación) y la escasez de reservas grasas durante el invierno aumentaría su mortalidad. Otra posibilidad, no excluyente, es una mayor tasa de dispersión, especialmente en los machos jóvenes, aumentando los riegos de accidentes y su salida de las zonas de Reserva. Las tablas de caza de las zonas periféricas del Parque Nacional francés, en donde se practica la caza de todas las clases de edad, contienen una alta proporción de primales (Berducou et al., 1982; Crampe, 1997). No puede descartarse tampoco el error en los muestreos demográficos (Pepin et al., 1991), motivado por la segregación espacial de machos y hembras, que a menudo se traduce en una menor visibilidad de los primeros si ocupan zonas forestales. Cordillera Cantábrica En las poblaciones estudiadas de la cordillera Cantábrica la sex-ratio está desviada a favor de las hembras. Los datos del macizo occidental del PN Picos de Europa (poblaciones no cazadas) muestran un promedio de 1.33 hembras/macho (Palacios, 2009). Para poblaciones cazadas los datos varían entre 1.4 y 2.1 en las reservas de caza leonesas (Peral et al., 2009) y los 1.9 y 3.1 en las reservas de caza asturianas (González-Quirós et al., 2009). Es evidente que la sex-ratio esta fuertemente condicionada a las tasas de extracción por gestión. El seguimiento de la sarna sarcóptica en la cordillera cantábrica ha demostrado que la enfermedad afecta más a los machos adultos que a los demás grupos de sexo y edad. Como consecuencia de la epizootia la razón sexual se desvía, más aún, a favor de las hembras. (González-Quirós et al., 2009; Peral et al., 2009; González-Quirós y Solano, 2009; Álvarez-Cienfuegos y Menéndez, 2009; Nores y González-Quirós, 2009) La figura 2 muestra la evolución de la sex ratio en la zona afectada por la sarna en Asturias entre 1991 y 2008. En el año 1991, antes de la aparición de la sarna, era de 1,4. En el año 2001, donde la sarna había sido la causante del máximo decrecimiento poblacional anual, el valor era de 4,0 hembras/macho. (González-Quirós y Solano, 2009).
Figura 2. Evolución de la razón sexual entre los años 1991-2008 en la zona afectada por la sarna en Asturias. En los años 2006 y 2008 se realizaron muestreos parciales. La máxima disminución poblacional debida a la sarna tuvo lugar en el año 2001. Según González-Quirós y Solano (2009).
Referencias Allainé, D., Houssin, H., Gaillard, J.M. (1990). Étude de la variabilité spatio-temporelle d'une indice de reproduction dans une population de chamois (Rupicapra rupicapra). Gibier Faune Sauvage, 7: 85-94. Allaine, D., Menaut, P., Catusse, M., Gaillard, J.M., Pepin, D. (1991). Estimation des taux de survie par sexe chez l'isard adulte (Rupicapra pyrenaica). Gibier Faune Sauvage, 8: 55-64. Alvarez-Cienfuegos, G., Menéndez, M. (2009). Seguimiento de la sarna sarcóptica en el Parque Nacional de los Picos de Europa. Pp. 320-336. En: Perez-Barberia, F.J. y Palacios, B. (eds.), (2009). El Rebeco Cantábrico (Rupicapra pyrenaica parva). Conservación y Gestión de sus poblaciones. Ministerio de Medio Ambiente, Medio Rural y Marino. Naturaleza y Parques Nacionales, Madrid. 501p. Bauer, J.J. (1985). Fecundity patterns of stable and colonising chamois populations of New Zealand and Europe. Pp. 154-165. En: Lovari, S. (Ed.). The Biology and Management of Mountain Ungulates. Croom Helm, London. Berducou, C., Besson, J.P., Occ., G.d.P.N.P. (1982). Dynamique des populations d'isards du Parc National des Pyrénées Occidentales de 1968-1981. Acta Biológica Montana, 1: 153-175. Canut, J., García-Ferré, D. (1995). Dades preliminars sobre l'estructura i dinámica poblacional de l'Isard (Rupicapra pyrenaica) al P.N. d'Aigüestortes i estany de Sant Maurici i zona perifèrica. Pp. 175-192. En: La investigació al P.N. d'Aigüestortes i Estany de Sant Maurici. III Jornades sobre recerca, 26-28 Oct. 1994. Generalitat de Catalunya, Boí (Lleida). Capurro, A.F., Gatto, M., Tosi, G. (1997). Delayed and inverse density dependence in a chamois population of the Italian Alps. Ecography, 20: 37-47. Chovancová, B., Gömöry, D. (2000). Influence of some climatic factors and predators on the population size of Tatra chamois in the Tatra National park. Ibex J. Mt. Ecol., 5: 173-183. Corti, R. (1992). Le Chamois et l'Isard. Plaquette ONC. Poncet SA Imprimeurs, Échirolles/ Eybens. Couilloud, F., Jullien, J.M., Fraty, D. (1999). Le poids des chevreaux en automne: un bioindicateur utilisable pour suivre l'évolution d'une population de chamois (Rupicapra rupicapra). Gibier Faune Sauvage, 16: 273-287. Crampe, J. P. (1997). Caractéristiques bio-démographiques d'une population d'isards (Rupicapra p. pyrenaica) non-chasée dans le Parc National des Pyrénées, en vallée de Cauterets. Documents scientifiques du Parc National des Pyrénées, 31: 1-169. Crampe, J.-P., Caens, P., Florence, E., Gaillard, J.-M., Loison, A. (2004). Effets de l'âge sur la reproduction des femelles d'isards Rupicapra pyrenaica dans un population du Parc National des Pyrénées. En: El sarrio: biología, patología y gestión. Actas de las Primeras Jornadas Pirenaicas sobre el Sarrio. Marzo 2003, Jaca. Publicaciones del Consejo de Protección de la Naturaleza de Aragón., Zaragoza. Crampe, J. P., Loison, A., Gaillard, J. M., Florence, E., Caens, P., Appolinaire, J. (2006). Patrons de reproduction des femelles d'isard (Rupicapra pyrenaica pyrenaica) dans une population non chassee et consequences demographiques. Canadian Journal of Zoology, 84 (9): 1263-1268. Framarin, F. (1985). The population density of chamois and ibex in the Grand Paradise National Park, Italy. Biol. Conserv., 32: 51-57. García-González, R. (1985). Datos preliminares para el estudio de las poblaciones de sarrio (Rupicapra rupicapra pyrenaica Bonaparte, 1844) en el Pirineo Central. Munibe (Ciencias Naturales), 37: 5-15. García-González, R., Hidalgo, R. (1989). Census and summer-autumn distribution of Pyrenean chamois in "Los Valles" National Hunting Reserve (Spain). Pp. 225-241. En: C.I.C. (Ed.). Symposium Chamois, Ljubljana 1988, Paris. García-González, R., Herrero, J., Hidalgo, R. (1985). Estimación puntual de diversos parámetros poblacionales y distributivos del sarrio en el Pirineo Occidental. Pirineos, 35: 53-63. García-González, R., Hidalgo, R., Ameztoy, J.M., Herrero, J. (1992). Census, population structure and habitat use of a chamois population in Ordesa N.P. living in sympatry with the Pyrenean wild goat. Pp. 321-325. En: Spitz, F., Janeau, G., Gonzalez, G., Aulagnier, S. (Eds.), Ongulés/Ungulates 91. SFEPM-IRGM, Paris-Toulouse. Garin, I., Herrero, J. (1997). Distribution, abundance and demographic parameters of the Pyrenean Chamois (Rupicapra p. pyrenaica ) in Navarre, Western Pyreness. Mammalia, 61: 55-63. Gonzalez, G., Crampe, J.-P. (2001). Mortality patterns in a protected population of isards (Rupicapra pyrenaica). Canadian Journal of Zoology, 79: 2072-2079. González-Quirós, P., Silva, P., Solano, S. (2009). Dinámica poblacional del rebeco cantábrico en las reservas regionales de caza de Asturias. Pp. 126-153. En: Perez-Barberia, F.J. y Palacios, B. (eds.), (2009). El Rebeco Cantábrico (Rupicapra pyrenaica parva). Conservación y Gestión de sus poblaciones. Ministerio de Medio Ambiente, Medio Rural y Marino. Naturaleza y Parques Nacionales, Madrid. 501p. González-Quirós, P., Solano, S. (2009). Monitorización del brote de sarna sarcóptica en las reservas regionales de caza de Asturias. Pp. 292-319. En: Perez-Barberia, F.J. y Palacios, B. (eds.), (2009). El Rebeco Cantábrico (Rupicapra pyrenaica parva). Conservación y Gestión de sus poblaciones. Ministerio de Medio Ambiente, Medio Rural y Marino. Naturaleza y Parques Nacionales, Madrid. 501p. Herrero, J., Garin, I., García-González, R., García-Serrano, A., Aldezabal, A. (1998). Plan de Caza del Sarrio (Rupicapra p. pyrenaica) de la Reserva de Caza de Benasque. Informe inédito. Sección de Caza y Pesca. Gobierno de Aragón. Herrero, J., Garin, I., García-González, R., García-Serrano, A., Aldezabal, A. (2000). Seguimiento demográfico del sarrio en Aragón y Navarra. Pp. 35-43. En: Herrero, J., García-Serrano, A., Fernández de Luco, D., García-González, R., Couto, S. (Eds.). Jornadas técnicas sobre el sarrio (Rupicapra pyrenaica pyrenaica). Gobierno de Aragón, Jaca. Herrero, J., Prada, C., García-Serrano, A. (2002). Plan de Caza del Sarrio (Rupicapra p. pyrenaica) en los Macizos de Posets y Maladeta. Informe inédito. Sección de Caza y Pesca. Gobierno de Aragón, Zaragoza. Hidalgo, R. (1991). Evaluación de la influencia de la actividad cinegética en la estructura y la distribución de las poblaciones de Sarrio en la Reserva Nacional de Caza de Viñamala, Huesca. Informe Inédito, 2 Vol. Diputación General de Aragón,. Hidalgo, R. (1993a). Censo y estructura de las poblaciones de Sarrio de las zonas de ampliación de las Reservas Nacionales de caza de Viñamala y Los Valles. Informe Inédito. Diputación General de Aragón, Hidalgo, R. (1993b). Seguimiento poblacional y captura de Bucardos en el Parque Nacional de Ordesa y Monte Perdido. Informe Inédito. Instituto Nacional para la Conservación de la Naturaleza, Hidalgo, R. (1997a). Censo de sarrios en la parte occidental de la Reserva de Caza de Los Valles. informe inédito. Sección de Caza y Pesca. Gobierno de Aragón, Zaragoza. Hidalgo, R. (1997b). Censo de sarrios en la parte occidental de la Reserva de Caza de Los Circos. informe inédito. Sección de Caza y Pesca. Gobierno de Aragón, Zaragoza. Houssin, H., Loison, A., Gaillard, J.-M. (1993). Participation à la reproduction des femelles de chamois Rupicapra rupicapra en fonction de leur âge dans une population alpine chassé. Gibier Faune Sauvage, 10: 39-45. Kourkgy, C., Garel, M., Appolinaire, J., Loison, A., Toigo, C. (2016). Onset of autumn shapes the timing of birth in Pyrenean chamois more than onset of spring. Journal of Animal Ecology, 85 (2): 581-590. Levet, M., Appolinaire, J., Catusse, M., Thion, N. (1995). Demographic data, spacial behaviour and dispersion of an Isard (Rupicapra pyrenaica pyrenaica) population in stage of colonization. Mammalia, 59: 489-500. Loison, A. (1995). Approches intra- et interspécifiques de la dynamique des populations: l'example du chamois. PhD Thesis. Université Claude-Bernard - Lyon I. Loison, A., Gaillard, J.M., Houssin, H. (1994). New insight on survivorship of female chamois (Rupicapra rupicapra) from observation of marked animals. Can. J. Zool., 72: 591-597. Loison, A., Jullien, J. M., Menaut, P. (1999). Subpopulation structure and dispersal in two populations of chamois. Journal of Mammalogy, 80: 620-632. Lovari, S., Cosentino, R. (1980). Herd structure and social behaviour of the Abruzzian chamois (Rupicapra rupicapra ornata Neumann, 1899). Monitore zool. ital. (N.S.), 14: 109-110. Martínez-Pastor, F., Guerra, C., Kaabi, M., García-Macías, V., de Paz, P., Alvarez, M., Herraez, P., Anel, L. (2005). Season effect on genitalia and epididymal sperm from Iberian red deer, roe deer and Cantabrian chamois. Theriogenology, 63 (7): 1857-1875. Nores, C., González-Quirós, P. (2009). Cambios demográficos provocados por la sarna. Pp. 338-359. En: Pérez-Barbería, F.J. y Palacios, B. (eds.), (2009). El Rebeco Cantábrico (Rupicapra pyrenaica parva). Conservación y Gestión de sus poblaciones. Ministerio de Medio Ambiente, Medio Rural y Marino. Naturaleza y Parques Nacionales, Madrid. 501p. Palacios, B. (2009). Seguimiento poblacional de rebeco cantábrico en el Parque Nacional de los Picos de Europa. Pp. 210-266. En: Perez-Barberia, F.J. y Palacios, B. (eds.), (2009). El Rebeco Cantábrico (Rupicapra pyrenaica parva). Conservación y Gestión de sus poblaciones. Ministerio de Medio Ambiente, Medio Rural y Marino. Naturaleza y Parques Nacionales, Madrid. 501p. Parellada, X. (1993). Informe cens isard a la tardor 1993. Reserva Nacional Fresser-Setcases. Informe inédito. Direcció General del Medi Natural, Barcelona. Pepin, D., Gonzalez, G., Bon, R. (1991). Le Chamois et L'isard. Rev. Ecol. (Terre Vie), Suppl., 6: 111-153. Peral, J.C., García, E., Paredes, F., Martínez, J.J., Gomez, C., Benito, F. (2009). Situación y gestión de las poblaciones de rebeco cantábrico en Castilla y León. Pp. 170-201. En: Pérez-Barbería, F.J. y Palacios, B. (eds.), (2009). El Rebeco Cantábrico (Rupicapra pyrenaica parva). Conservación y Gestión de sus poblaciones. Ministerio de Medio Ambiente, Medio Rural y Marino. Naturaleza y Parques Nacionales, Madrid. 501p. Pérez-Barbería, F. J. (1994). Biología, Ecología y Caracterización Genética del Rebeco Cantábrico (Rupicapra pyrenaica parva). Universidad de Oviedo, España. Pérez-Barbería, F. J., Mutuberria,G., Nores, C. (1998). Reproductive parameters, kidney fat index, and grazing activity relationships between the sexes in Cantabrian chamois Rupicapra pyrenaica parva. Acta Theriologica, 43: 311-324. Peters, R. H. (1983). The ecological implications of body size. Cambridge University Press, Cambridge. Salzmann, H. C. (1977). Untersuchungen zur Fortpflanzungsbiologie der Gemsen im Schweizerischen Jura. Zeitschrift für Säugetierkunde, 42: 180-188. Storch, I. (1989). Condition in chamois populations under different harvest levels in Bavaria. J. Wildl. Manage., 53: 925-928.
Francisco Javier Pérez-Barbería Ricardo García-González Borja Palacios Alberti Fecha de publicación: 16-06-2004 Revisiones: 24-07-2008; 28-10-2010 Otras contribuciones: 2. Alfredo Salvador. 10-08-2017 Pérez-Barbería, F. J., García-González, R., Palacios, B. (2017). Rebeco – Rupicapra pyrenaica. En: Enciclopedia Virtual de los Vertebrados Españoles. Salvador, A., Barja, I. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||