|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Para más información sobre cada apartado hacer click en:
|
Key words: Pyrenean Chamois, Cantabrian Chamois, description, size, age, variation.
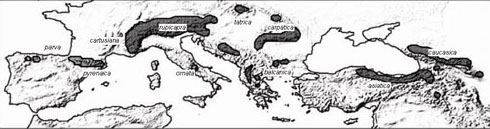
Sistemática y distribución del género Clasificación taxonómica y distribución actual El rebeco pertenece a la subfamilia Caprinae, dentro de la familia Bovidae. Las relaciones entre los distintos linajes de la subfamilia son todavía objeto de discusión (Hassanin y Douzery 1999). La clasificación taxonómica del genero Rupicapra ha sido también sometida a continua revisión. Linnaeus (1758) agrupaba al rebeco junto con las cabras, al observar similitudes tanto en cornamenta como en dentición, nombrándolo Capra rupicapra. Fue Blainville (1816) quien proporcionó género propio al rebeco (Rupicapra rupicapra); además estableció el orden de los Artiodáctilos tal como es aceptado hoy en día. Pero, incluso a este nivel, la sistemática no está definitivamente establecida, pues se ha propuesto que el orden pase a nombrarse Cetartiodáctilos al reunirse el orden de los Cetáceos y los Artiodáctilos (Price et al., 2005). En cuanto a la clasificación de las poblaciones de Rupicapra, en 1845 Bonaparte describió al rebeco pirenaico, otorgándole un nombre específico propio (Rupicapra pyrenaica). En 1913 Lydekker agrupaba a todas las poblaciones de rebeco en una única especie Rupicapra rupicapra. Camerano, un año después, hacía referencia a tres especies diferentes: R. pyrenaica, en la península Ibérica, R. ornata, en los Apeninos y R. rupicapra en el resto de los sistemas montañosos de Eurasia. Couturier (1938) y Dolan (1963) aceptaban una única especie, R. rupicapra, con 10 subespecies distintas (Masini y Lovari, 1988). En la actualidad, y atendiendo a datos morfológicos y de variabilidad para isoenzimas (enzimas codificados por distintos alelos de un gen, que se pueden distinguir por su movilidad electroforética) presentados por Lovari (1987) y por Nascetti et al. (1985), se reconocen un total de 10 subespecies agrupadas en dos especies, Rupicapra pyrenaica presente en el suroeste de Europa y Rupicapra rupicapra que se distribuye por el resto de Europa y en el Cáucaso. Cada una de las diez subespecies de rebeco está confinada en un sistema montañoso (Domínguez et al., 2009) (Figura 1).
Figura 1. Distribución actual de las poblaciones de rebeco. En claro (península Ibérica y centro de Italia) las subespecies de Rupicapra pyrenaica y en oscuro las subespecies de R. rupicapra. Según Domínguez et al. (2009).
La especie R. rupicapra agrupa a un total de siete subespecies que corresponden a las poblaciones presentes en el centro y este de Europa. De oeste a este tendríamos las siguientes subespecies: cartusiana (macizo francés de La Chartreuse), rupicapra (Alpes, principal núcleo de la especie), tatrica (Montes Tatra), carpatica (en los Cárpatos), balcanica (Península Balcánica), asiatica (Turquía) y caucasica (Cáucaso). La especie R. pyrenaica agrupa a los rebecos del suroeste de Europa. Se distinguen las subespecies parva (Cordillera Cantábrica), pyrenaica (Pirineos) y ornata (Abruzzos). Debate actual sobre su sistemática La reconstrucción de las relaciones filogenéticas entre especies y/o sub-especies del género Rupicapra depende de los marcadores estudiados. Un estudio que usaba el citocromo b como marcador reveló que las dos especies propuestas (Rupicapra rupicapra y Rupicapra pyrenaica) eran no monofiléticas (Domínguez et al., 2009). Más recientemente se analizaron las secuencias de ADN de otras cuatro regiones mitocondriales (ND1, 12S, tRNApro y Control Region) y de 20 marcadores nucleares (microsatélites) de todas las subespecies. Estos investigadores encontraron filogenias discordantes entre la información procedente de microsatélites y la procedente de ADN mitocondrial. Teniendo en cuenta la filogenia mitocondrial se formaban 3 linajes, Oeste, Central y Este, en desacuerdo con la clasificación taxonómica. Se estimó que hace 1,7 millones de años (hacia final del Plioceno y el principio del Pleistoceno) hubo una separación inicial en dos ramas, Oeste-Central por un lado y Este por otro, rápidamente seguida por la división de los linajes Oeste y Central. El linaje Oeste contenía haplotipos de la península Ibérica y de los Alpes occidentales, el linaje Central incluía haplotipos de los Apeninos y del macizo de Chartreuse y el linaje Este comprendía las poblaciones más orientales de los Alpes. La divergencia entre las poblaciones dentro de cada uno de estos linajes es reciente (< 0,5 millones de años). El análisis de microsatélites reveló diferencias entre cada par de subespecies formando tres grupos bien diferenciados (oeste, centro y este) con un marcado componente geográfico. Los agrupamientos no se correspondieron con los linajes mitocondriales sino que estaban más próximos a la clasificación taxonómica y morfológica. La subespecie ornata tiene una muy baja diversidad genética debido a recientes y drásticas reducciones en su tamaño poblacional. Las filogenias parcialmente discordantes obtenidas para ADN mitocondrial y microsatélites indican sucesos de hibridación entre diferentes linajes del área central de distribución (Rodríguez et al., 2010). Bajos niveles de variación genética en el marcador Mhc‑DRB1 entre las subespecies R. p. pyrenaica y R. p. parva (Alvarez‑Busto et al., 2007), sugiere que ambas podrían estar agrupadas bajo el mismo taxón, lo cual vuelve a indicar la discusión existente sobre la sistemática de este género. Un estudio filogenético basado en el cromosoma Y mostró dos haplogrupos, uno correspondiente a las poblaciones ibéricas y de los Apeninos y otro al resto de poblaciones; también se observó una clina desde alelos ancestrales en el oeste a alelos derivados en el este. El linaje paterno del rebeco se originó probablemente en la Península Ibérica y se dispersó hacia el este en una serie de eventos durante los ciclos glaciales e interglaciales del Cuaternario (Pérez et al., 2012)2. Diferentes componentes del genoma pueden producir patrones filogeográficos que entran en conflicto. Un análisis filogeográfico basado en intrones ha señalado que se diversificaron a finales del Pleistoceno, hace 43.000-101.000 años, en tres clados, uno en la Península Ibérica, otro en los Apeninos y el tercero en los Alpes, Balcanes, Cárpatos, Tatra, Turquía y Cáucaso. Estos resultados sugieren que solamente hay una especie (Pérez et al., 2017)2. Paleontología del género Los primeros fósiles de la subfamilia Caprinae corresponden al Mioceno superior, hace unos 10 millones de años (Alcalá y Morales, 1997; Gentry, 2000). Al contrario que la mayoría de los bóvidos, el registro fósil de los caprínidos es relativamente pobre debido a los hábitats montañosos en que han evolucionado (Simpson 1945). La mayoría de los paleontólogos creen que los Caprini se originaron en Asia, pero Ropiquet y Hassanin (2005) consideran que su origen no está claro dado que la distribución de los caprínidos ha sido modificada de una forma muy importante durante el Pleistoceno, debido a las glaciaciones y grandes cambios climáticos que han tenido lugar. Los fósiles de los parientes más próximos del rebeco son extremadamente raros y dispersos, aún en relación a otros caprínidos (Masini y Lovari, 1988). Por ello existen opiniones diversas y contradictorias sobre las relaciones filogenéticas entre las pocas formas vivientes y las muchas formas fósiles descritas. Se propuso que Phachygazella grangeri, que habitó el centro y sur de Asia a principios del Plioceno (hace unos 5 millones de años), pudo ser una forma de rupicaprínido próxima al ancestro del rebeco (Thenius y Hofer, 1960). Sin embargo, especies próximas como Neotragocerus en Norteamerica y Myotragus en las Islas Baleares ya se habían dispersado en el Plioceno temprano, posiblemente a partir de un ancestro del Mioceno (Masini y Lovari 1988). Los escasos datos paleontológicos disponibles apuntan a que el género Rupicapra pertenecería, junto con el fósil europeo Procamptoceras y quizá el fósil norteafricano Numidocapra, a una rama filética ya diferente durante el periodo Villafranchiano (hace más de 2 millones de años) del resto de los rupicápridos (Gentry 1978). Procamptoceras puede haber sobrevivido en Europa del Este hasta el principio del Pleistoceno Medio, hace unos 800.000 años. Los primeros fósiles de Rupicapra propiamente dicho se hallaron en un yacimiento prehistórico del pirineo francés, el de la gruta de Caune d´Arago, cerca del pueblo de Tautavel y corresponden al Pleistoceno medio. La aparición de fósiles de Rupicapra después de un periodo en el que aparentemente no existían rupicápridos en la zona, sugiere una migración desde el este de Europa durante un periodo frío, pues sus fósiles se encuentran asociados a la fauna de climas fríos. Masini y Lovari (1988) sugieren que el rebeco, o su antecesor directo, puede haber alcanzado Europa durante el Pleistoceno medio o el Pleistoceno Inferior (hace, al menos, 800.000 años) y relacionan su migración con los grandes cambios en la fauna que tuvieron lugar durante el Villafranchiano marcado por la llegada a Europa de olas de taxa procedentes de ambientes fríos o abiertos. Los fósiles de Caune de l`Arago son del final de la glaciación de Mindel o principios del Riss (entre 400.000 y 350.000 años antes del presente, AP). En Pirineos, el suroeste de Francia, en Provenza, Alpes italianos, Apeninos y Hungría se han encontrado restos del periodo Riss (entre 300.000 y 130.000 años AP), lo que confirmaría la dispersión europea de Rupicapra a finales del Pleistoceno Medio. Hasta ahora la única documentación conocida del rebeco durante el periodo interglaciar Riss-Würm proviene de dos zonas de elevada altitud de los Alpes suizos, lo que sugiere una restricción del rango de distribución del rebeco a las zonas más elevadas. Sin embargo, durante las glaciaciones del periodo Würm (80.000-12.000 años AP), los fósiles de rebeco llegaron a ser relativamente numerosos, y con una distribución más amplia y continua que en la actualidad (Masini, 1985; Lovari, 1987; Masini y Lovari, 1988). Los restos del Würm se encontraron principalmente en sitios de baja altitud de los sistemas montañosos principales. Esta distribución sugiere que los fríos glaciales del Würm deben haber desplazado al rebeco de las grandes alturas. Los depósitos del Pleistoceno normalmente consisten en restos fragmentados de los cuales sólo los cuernos pueden ser usados en taxonomía; lo que dificulta la clasificación de los rebecos fósiles (Masini, 1985). Se discute sobre la asignación de un fósil de los Pirineos franceses del periodo Riss al tipo pyrenaica o al rupicapra. Se conoce más sobre el tipo de los fósiles de rebeco del Würm y del Holoceno. Se identificaron fósiles del Würm temprano en la Cordillera Cantábrica y en los Pirineos, que fueron clasificados como R. pyrenaica. En los Apeninos se recuperaron fósiles posteriores, del Würm y del Holoceno, correspondientes al tipo R. pyrenaica ornata. Se describió R. rupicapra en Hungría, el arco alpino y el norte de los Apeninos en el Würm y en el Cáucaso, en fósiles del Holoceno. Se ha sugerido, por tanto, que los rebecos del tipo R. pyrenaica habrían evolucionado directamente de los individuos llegados al oeste de Europa durante el Pleistoceno Medio, mientras que R. rupicapra puede haber evolucionado en el este de Europa o en Asia Menor durante un tiempo de aislamiento geográfico. Posteriormente, y debido a la aridez creciente de las regiones del Mediterráneo y del Mar Negro, R. rupicapra se debió extender hacia el oeste no después del final del Würm rompiendo el rango de R. pyrenaica aunque no se habría extendido más allá del norte de los Apeninos y el oeste de los Alpes. Entonces, R. pyrenaica se habría separado en dos grupos: R. p. parva y R. p. pyrenaica por un lado y R. p. ornata por otro (Lovari y Scala, 1980; Masini, 1985; Masini y Lovari, 1988). Al llegar el Holoceno, el actual periodo interglaciar, los rebecos verían restringido su hábitat de nuevo y poco a poco quedarían aisladas en los puntos más elevados de Europa y Asia Menor.
Nombres comunes Castellano: rebeco, gamuza (Rupicapra spp.); sarrio, rebeco pirenaico (R. p. pyrenaica); rebeco, rebeco cantábrico (R. p. parva). Catalán: isard, sarri (R. p. pyrenaica). Euskera: sarrio, sarrioak (R. p. pyrenaica). Gallego: rebezo (R. p. parva). Aragón: sarrio. Asturias: robezu. Albanés: Dia egr, que significa "cabra salvaje" (R. rupicapra balcanica). Alemán: Gemse, gams (R. rupicapra), Pyrenäengemse (R.p. pyrenaica), Cantabrischegemse (R. p. parva). Francés: isard (R. p. pyrenaica). Griego: A g r i o g i d o, pronunciado "agriogido" y significa "cabra salvaje"(R. rupicapra balcanica). Inglés: Southern chamois (R. p.), Pyrenean chamois (R.p. pyrenaica), Cantabrian chamois (R. p. parva). Italiano: Camoscio alpino (R. rupicapra), Camoscio appenninico (R. p. ornata). Rumano: Capra niagra, que significa "cabra negra" (R. rupicapra carpatica). Turco: Cengel Boynuzlu dag kecisi, que significa "cabra de montaña de cuernos de garfio".
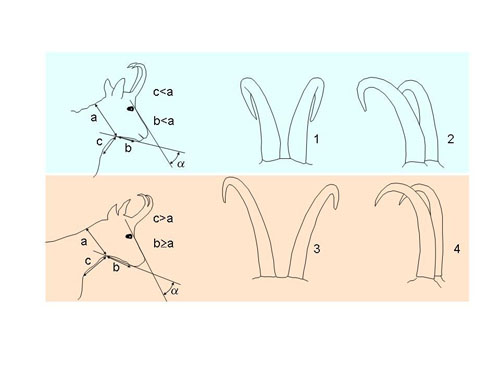
Descripción Es un miembro de la subfamilia de los caprinos y por lo tanto se asemeja a una cabra, pero son más estilizados y pequeños que estas (véase también pesos y medidas corporales). Ambos sexos tienen cuernos, los cuales son finos, negros o marrón muy oscuro, de sección prácticamente circular y sin nudosidades o quillas conspicuas (Cabrera, 1914). No hay gran diferencia en el tamaño de los cuernos entre machos y hembras (desarrollo del cuerno desde la punta a la base: machos = 156 mm, hembras = 130 mm). Los cuernos están implantados en la parte superior del cráneo sobre las órbitas oculares, y crecen perpendiculares y rectos en sus dos tercios de longitud en vista lateral (en los adultos) y después se curvan bruscamente hacia atrás y abajo en forma de garfio. Cuernos muy juntos en su base, sobre todo en los machos, éste y su mayor perímetro basal son los mejores atributos para diferenciar cráneos de machos y hembras, como también ocurre en el rebeco pirenaico (García-González y Barandalla, 2002). En vista frontal los cuernos se separan ligeramente desde la base en forma de V. Los cuernos crecen anualmente, con tasas de crecimiento rápidas desde primeros de marzo y lentas durante el invierno, produciendo la segmentación de los mismos, aunque este patrón no puede ser observado a distancia (ver Cálculo de la edad para más información sobre los cuernos). Otro carácter útil para la determinación del sexo a distancia es la relación entre el tamaño corporal y la longitud y grosor del cuello. En los machos el cuello es más robusto dando la impresión de ser más corto y menos estilizado que el de las hembras (Figura 2, izquierda).
Figura 2. Izquierda: Identificación del sexo mediante la forma de la cabeza y su relación de tamaño respecto al tamaño del cuello. Macho (arriba), hembra (abajo). Hocico de la hembra más afilado que en el macho (αhembra < αmacho), cuello de la hembra más largo que ancho (c>a) y garganta más larga o igual que la anchura del cuello (b≥a). Comparación de los cuernos de macho y hembra. Macho (1: vista frontal; 2 vista lateral), hembra (3: vista frontal; 4 vista lateral). Los cuernos de los machos son de mayor diámetro y están más juntos en la base que los de las hembras. En vista frontal los cuernos de los machos se separan en forma de “V” (1) más cerrada que en la hembras (3). En vista lateral los cuernos son más recurvados y tienden a apuntar hacia abajo en los machos de ejemplares adultos (2), los cuernos de las hembras no están tan recurvados (4). Según Pérez-Barbería y Pérez-Fernández (2009).
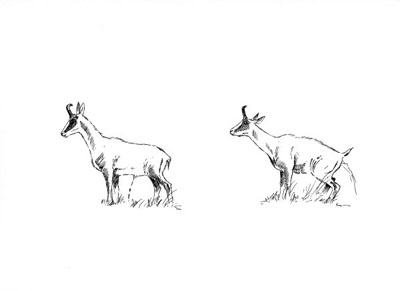
También es útil para diferenciarlos la postura de orinar (Figura 3).
Figura 3. Macho (izquierda) y hembra (derecha) de rebeco en posición de orinar. Estas posiciones son útiles para identificar el sexo del animal, y la única manera de averiguar el sexo de los cabritos de unos pocos meses de edad. Según Pérez-Barbería y Pérez-Fernández (2009). © R. Alonso.
Poseen dos glándulas cutáneas parietales situadas justo detrás de la base de los cuernos, que semejan un ombligo ligeramente protruído sobre todo en los machos durante el celo. En esta época las glándulas parietales de los machos emanan un olor cabruno-almizclado característico. Hemos observado que algunos machos usan estas glándulas para marcar las puntas de las ramas de los arbustos y marcar su territorio (Pérez-Barbería y Mutuberría, com. pers.). El cráneo es estrecho y alargado, sin fosas lacrimales, los premaxilares poco extendidos hacia arriba sin llegar a contactar con los nasales. Fórmula dentaria: I (0-0) / (3-3), C (0-0) / (1-1), PM (3-3) / (3-3), M (3-3) / (3-3) = 32 Ojos grandes. Cavidad estrecha y profunda por detrás y por encima de las pezuñas que es conspicua sólo si se flexiona la pezuña hacia adelante y se introduce la yema del dedo. El pelo es duro pero suave, corto en verano y más largo en invierno, cola parda muy oscura por arriba y desnuda por debajo. En verano el color varía entre canela y cervuno. Los machos presentan un color castaño oscuro aunque la diferencia no es tan marcada como para usarlo de atributo para distinguir los sexos. En vista frontal parecen ir provistos de un delantal negro o marrón muy oscuro que les cubre el pecho y la parte frontal de las patas delanteras hasta la altura de las rodillas, dejando libre, en forma de V, parte del cuello y la garganta que son en general de color cervuno o canela y que se fusiona con el color de las mandíbulas que son de color más claro, generalmente ocráceo. El pelaje de las orejas es casi negruzco por la parte posterior, pero por delante son de color canela-ocráceo. Una franja de color marrón oscuro va desde el hocico hasta los ojos, fundiéndose por detrás de ellos con el color marrón oscuro de las orejas. Esta franja contrasta fuertemente con una banda frontal de color canela que va desde la nariz hasta la base de los cuernos. Con forma de ceja, pero situada delante de cada ojo y aproximadamente centrada en la comisura anterior de los párpados, hay una mancha alargada de color canela-rojizo que se proyecta unos 2 cm hacia arriba y abajo. La parte superior-frontal de las patas posteriores es casi negra o marrón muy oscuro, contrastando bien con la parte por debajo de la rodilla (tibia) que es más clara, generalmente de color cervuno.
Figura 4. Izquierda, macho adulto de rebeco pirenaico con pelaje de invierno. © J. Ara. Derecha, macho adulto de rebeco cantábrico con pelaje de invierno. © A. Vázquez.
En invierno el color de las partes superiores es menos castaño y los flancos del cuerpo y la parte baja de los costados toman un tinte pardo muy oscuro o casi negruzco. El vientre también se hace más pálido (Figura 4). El color del pelaje de los animales jóvenes es más homogéneo que en los adultos, sin tanta delimitación del diseño facial, del delantal, flancos y miembros. Los colores de los animales muy viejos son menos contrastados que los descritos para adultos. Su característica señal de alarma es un resoplido corto. También patean el suelo entre 1 y 3 veces con una de las patas delanteras encarándose en la dirección de la que procede la alarma.
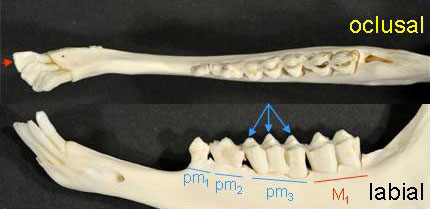
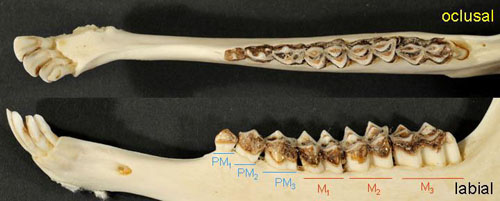
Cálculo de la edad La longevidad de los rebecos (datos de media y máxima) es en los machos de 9 a18 años y en las hembras de 10 a 21 años. La edad, junto con el sexo y el peso, es una variable decisiva para el estudio de la condición de la población, su dinámica o simplemente el tamaño del animal. Debido a la importancia de esta variable a continuación describimos diversos métodos para la estima de la edad. Su uso depende de la edad del animal y del tipo de muestra disponible (animal vivo, cráneo o dentición). En general se usa la dentición y los cuernos. Desafortunadamente la estima de la edad en vivo y a distancia sólo permite una grosera aproximación a la clase de edad, cabritos del año, igüedos de un año y adultos de 2 o más años de edad. Estima de la edad por el patrón de erupción de la dentición Método muy útil cuando sólo se dispone de las mandíbulas o maxilares del animal, las cuales permanecen intactas en condiciones de campo durante más tiempo que el cráneo con los cuernos. Si el animal cuenta con menos de 46 meses la edad se puede estimar mediante el patrón de emergencia de los dientes permanentes. Es decir, el orden en que las diferentes piezas dentales salen del alveolo a través de la encía. Se recomienda utilizar el primero de mayo como fecha de cumpleaños. En primer lugar se requiere cierta experiencia para identificar los dientes permanentes de los decíduos (Figura 5), ya que el patrón que describimos está basado en los dientes permanentes.
Figura 5. Mandíbulas en vista oclusal y labial de dos rebecos de menos de 1 año (arriba) y de 4 años (abajo). El ejemplar joven sólo tiene dos dientes permanentes, el primer incisivo y el molar primero (M1), el resto son incisivos y premolares de leche (deciduos). En vista oclusal se puede ver una abertura en la mandíbula por donde emergerá el segundo molar permanente. Las flechas señalan las tres puntas del premolar deciduo, que contrasta claramente con el primer molar permanente que tiene sólo dos puntas. Comparar todas las piezas dentales con el ejemplar adulto con dentición permanente completa. © D. Riley.
En el rebeco cantábrico el orden en que los dientes emergen es el siguiente: (M1 M1) M2 M2 I1 M3 M3 (PM2 PM3) (PM1 PM1 PM2 PM3 I2) I3 I4 [I: incisivo o canino incisiforme; PM: premolar; M: molar; los subíndices indican dientes inferiores y superíndices indican dientes superiores; los dientes que están agrupados entre paréntesis emergen aproximadamente al mismo tiempo]. El tiempo medio que transcurre desde el nacimiento hasta la emergencia de cada diente es de 2-3 meses para M1 M1, entre 9 y 13 meses para los M2 y M2, entre 13 y 15 meses para I1, entre 22 y 25 meses para los M3 y M3; I2 y los premolares inferiores y superiores emergen entre los 25 y 29 meses; el I3 a los 36-37 meses y el I4 es el último diente en emerger y lo hace entre 36 y 37 meses desde la fecha de nacimiento. Este método asegura una precisión en la estima de la edad de unos 4 meses para animales menores de 2 años de edad (Pérez-Barbería y Mutuberria 1996) (Tabla 1).
Tabla 1. Tiempo en meses, transcurrido desde el nacimiento hasta la emergencia de las diferentes piezas dentales permanentes. M: molar; PM: premolar; I: incisivo. Superíndices indican que la pieza dental es superior y subíndices que es inferior. Los índices indican el número de la pieza (e. g. M11 : primer molar inferior y primer molar superior). Según Pérez-Barbería y Pérez-Fernández (2009).
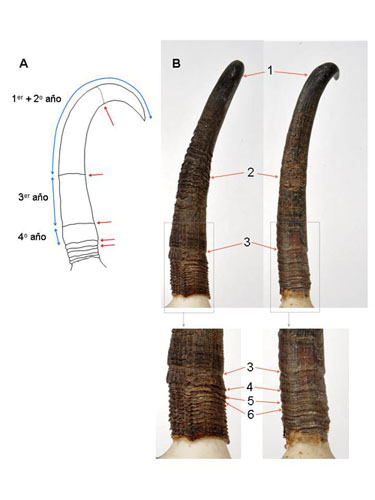
A partir de 3 años se necesita utilizar otros métodos para la estima de la edad, como por ejemplo el patrón de desgaste de los dientes, el recuento de las capas de cemento en el primer incisivo permanente o el recuento de los medrones de crecimiento de los cuernos. Este último es que el que se describe a continuación. Estima de la edad mediante los cuernosEl método más práctico y rápido para estimar la edad de animales adultos es el recuento de los medrones de crecimiento de los cuernos. Es una técnica sencilla, pero requiere la captura del animal o el cráneo con los cuernos intactos, ya que no puede aplicarse a distancia (Pérez-Barbería, 1994a; Pérez-Barbería et al., 1996). El método se basa en el crecimiento estacional de los cuernos: a partir de marzo crecen más rápido, mientras que en invierno se produce una reducción drástica de la tasa de crecimiento, excepto en los animales menores de 2 años en los que se mantiene un crecimiento significativo también durante el invierno. Estas diferentes tasas de crecimiento provoca la segmentación de los cuernos en medrones separados por finas hendiduras. Su recuento es una buena herramienta para estimar los años de vida del animal. Hay que tener en cuenta que es prácticamente imposible distinguir el primer medrón, pues generalmente la marca entre el primer y segundo medrón desaparece por la acción del desgaste mediante el frotado de los cuernos en las ramas, cortezas de los árboles o en el suelo. Consecuentemente, la primera marca aparente de ralentización del crecimiento corresponde al segundo invierno de vida (entre 1-3 meses antes de la fecha de cumpleaños, mayo) y está a unos 102 mm de la punta del cuerno en hembras y a unos 122 mm en machos. Esta marca no es tan conspicua como en el resto de los años venideros. Sería erróneo definir esta marca como una hendidura, en la mayoría de las ocasiones se percibe un aumento en el grosor de los cuernos, o un cambio de textura en la superficie de los mismos o una ligera apertura hacia afuera en la dirección de crecimiento de los cuernos (Figura 6).
Figura 6. (A) Representación idealizada de los medrones de un cuerno de un macho de ocho años. Las flechas rojas marcan las hendiduras de segmentación debidas al parón de crecimiento que tiene lugar en invierno. La marca correspondiente al primer invierno (línea punteada) no suele ser visible, aquí se representa con propósito ilustrativo (es por ello por lo que el primer y segundo medrón se miden juntos). Los medrones correspondientes a los cuatro primeros años se señalan con flechas azules. Los medrones del sexto año y en adelante tienen una longitud casi constante entre 2,4 y 1,1 mm. (B) Figuras de la base de los cuernos de un macho y hembra adultos, se señalan los medrones de crecimiento de 3 a 6 años. Observar como la longitud de los diferentes medrones varía entre años y sexos, y también entre ejemplares (no ilustrado). Cuernos de un ejemplar de la colección del PN Picos de Europa. Según Pérez-Barbería y Pérez-Fernández (2009). (C) D. Riley.
El resto de los medrones son mucho más cortos y dan la impresión de ser finos anillos superpuestos (Figura 6 y Tabla 2). A partir del sexto año de vida el cuerno crece muy poco, con un incremento entre 1,1 y 2,4 mm por año (media = 1,4 mm).
Tabla 2. Longitud en mm de los 5 primeros medrones de los cuernos de machos y hembras de rebeco cantábrico. En la práctica el primer medrón no es distinguible y por eso se muestra la longitud del primero más el segundo (Figura 3). Entre paréntesis el error estándar, n: número de ejemplares medidos. Según Pérez-Barbería y Pérez-Fernández (2009).
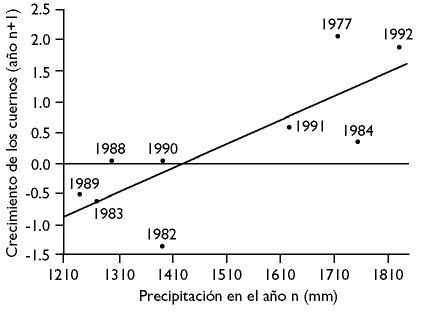
Para aplicar el método basta con contar los medrones o las hendiduras de segmentación comenzando desde la punta del cuerno hasta la base. El primer medrón o hendidura de segmentación incluye el crecimiento de los dos primeros años de vida por las razones aducidas anteriormente. Por lo tanto hay que sumar un año al número de hendiduras contadas, excepto cuando el número de hendiduras contabilizadas es cero. En tal caso hay que estimar si se trata de un ejemplar en su primer o segundo año de vida, lo cual puede calcularse por el patrón de erupción de la dentición. Si se sabe la fecha de la muerte del ejemplar entonces podría definirse si la última hendidura de segmentación debe ser contada o no. Esto es debido a que la hendidura de segmentación se produce antes (marzo) de la fecha de cumpleaños (mayo). Cabe señalar que el crecimiento de los cuernos está condicionado por las condiciones climáticas que definen la disponibilidad y calidad del recurso vegetal, y este efecto puede ser muy importante en el desarrollo de los cuernos en los primeros años de vida. Por ejemplo, el crecimiento de los medrones está positivamente relacionado con la precipitación del año precedente (Pérez-Barbería y Fernández-López, 1996) (Figura 7). Es por tanto muy importante, cuando se comparan diferencias de tamaño de cuernos entre distintas poblaciones, corregir las diferencias en el año de nacimiento de cada cuerno, de lo contrario podríamos estar detectando diferencias poblacionales en el tamaño de los cuernos que son debidas a diferencias anuales en el crecimiento de los mismos. (Figura 7).
Figura 7. Relación entre el crecimiento de los cuernos (referido a la media de crecimiento del periodo de estudio) y la precipitación. Los rebecos experimentan mayor crecimiento de los cuernos en los años que están precedidos por altos valores de precipitación (lluvia). Modificado de Pérez-Barbería y Fernández-López (1996).
Condición corporal Aunque no existe información sobre la condición corporal del rebeco cantábrico para una serie temporal larga, los estudios disponibles realizados durante dos años consecutivos (entre 1992-1993, utilizando la grasa perirrenal como indicador de condición) indican claramente que la condición corporal varía tanto estacional como anualmente. Esta variación esta causada por las condiciones meteorológicas que determinan el crecimiento y la abundancia de las plantas que constituyen su dieta, y por la competencia tanto intraespecífica como con la cabaña ganadera. En las hembras los valores más bajos de depósitos de grasa perirrenal se encontraron a la salida del invierno, aumentando hasta casi el doble entre agosto y octubre. Esta variación es mucho más acusada en machos, con mínimos entre mayo y junio y con un incremento de hasta nueve veces llegado septiembre u octubre (Pérez-Barbería, 1994a; Pérez-Barbería et al., 1998).
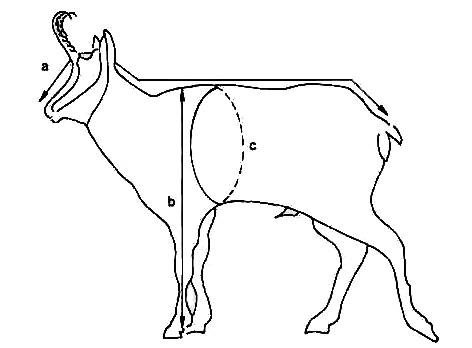
Masa corporal y tamaño La masa corporal es una medida de vital importancia en el estudio de las poblaciones de ungulados, no sólo determina la supervivencia de los individuos durante el invierno, sino que puede influir tanto en la determinación del sexo de las crías (razón sexual natal), como en la supervivencia durante su primer año de vida y su futuro estatus social (Clutton-Brock y Albon, 1982). La masa corporal también se puede emplear como indicador de condición corporal para detectar niveles de capacidad de carga poblacional. (Pérez Barbería, 2009). La figura 8 muestra el modo de tomar las medidas externas.
Figura 8. Diagrama de algunas medidas corporales. a) Longitud total (longitud del cuerpo sin la cola); b) Altura a la cruz; c) Perímetro torácico.
Pirineos La masa corporal del rebeco pirenaico adulto oscila entre 22 y 28 kg (Crampe et al., 1997; Herrero et al., 1998), siendo los machos algo más pesados que las hembras. En la tabla 3 se presentan pesos y medidas corporales para rebecos pirenaicos adultos, obtenidos en una de las Reservas del Pirineo aragonés en el año 1998. Como puede observarse no se han encontrado diferencias significativas entre sexos, excepto para la altura a la cruz, la cual refleja la altura del animal, siendo los machos más altos que las hembras. El perímetro torácico es una variable influida por la cantidad de grasa corporal y por ello más ligada al peso corporal que al tamaño. La longitud total tampoco muestra un dimorfismo sexual apreciable y sus valores son similares a los publicados para las poblaciones vecinas de Ossau y Cauterets en Francia (Appolinaire et al., 1984; Crampe, 1997). Tabla 3. Valores de algunas dimensiones corporales de los animales cazados en la Reserva de Viñamala durante el otoño de 1998 y comparación estadística entre sexos. Promedio, desviación típica (entre paréntesis), valores mínimo y máximo de la muestra y tamaño de muestra (N), p = probabilidad asociada al test de la t de Student; n.s. = no significativo; * = diferencias entre las medias significativa. (según García-González et al., 2000). Ver el diagrama de parámetros corporales biométricos en la Figura 8.
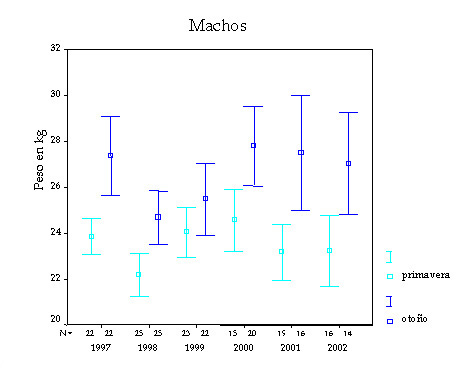
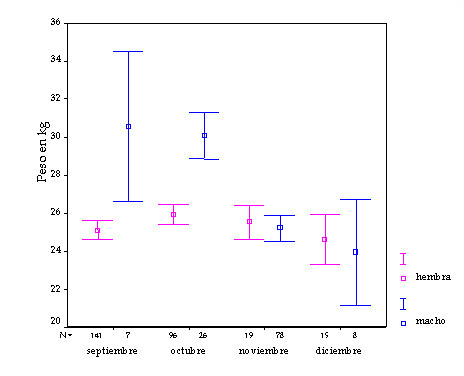
La relativa similitud de tamaños corporales entre machos y hembras, mostrada en la tabla 3, no es un hecho excepcional en el rebeco pirenaico. En la tabla 4 figuran los pesos de machos y hembras de sarrio obtenidos en varias poblaciones de los Pirineos según diversas fuentes bibliográficas. Como puede observarse en casi todas ellas no existen diferencias significativas entre machos y hembras, aunque tienden a ser un poco más pesados los machos. En realidad la similitud de pesos entre machos y hembras adultos se produce desde la mitad del otoño hasta la primavera siguiente. Los machos cazados en primavera son menos pesados que los cazados en otoño (Figura 9). En otoño, durante el celo, los machos llegan a perder hasta un 20% del peso ganado durante el verano (Figura 10), que es la proporción máxima de peso que, según algunos autores (Crampe et al., 1997), el animal podría perder sin llegar a perecer. Algunos estudios indican que la supervivencia durante el invierno depende de las reservas de grasa acumuladas durante el verano. Otros trabajos realizados en rebecos, corzos, muflones y ciervos, han demostrado además, que las diferencias de peso entre machos y hembras son tanto más pequeñas cuando la densidad es más alta o las condiciones climáticas son desfavorables (Salzmann, 1977; Pepin et al., 1996; Couilloud et al., 1999), lo que podría usarse como un bioindicador para avisarnos de que las poblaciones se acercan a niveles altos de densidad.
Figura 9. Masa corporal media (kg) de sarrios machos cazados en la Reserva de Benasque (Pirineo aragonés) en primavera y otoño durante el período 1997- 2002 (N = 239). Los números pequeños del eje horizontal indican el tamaño de la muestra; las barras verticales muestran los límites de confianza al 95% (según Herrero et al., 2003).
Figura 10. Masa corporal media (kg) de machos y hembras de sarrio durante el otoño en la Reserva de caza de Benesque (Pirineo aragonés). Valores medios mensuales durante el período 1997-2002 (N = 394). La primera fila del eje X indica el tamaño de la muestra; las barras verticales muestran los límites de confianza al 95% (según Herrero et al., 2003).
En la tabla 4 también puede observarse que existen diferencias de la masa corporal entre Reservas, macizos o valles, a veces muy próximos (Storch, 1989). Por ejemplo, en 1998 los pesos de machos y hembras cazados fueron significativamente mayores en la Reserva de Viñamala en relación a los de Benasque. Según un estudio de Crampe (1997), en el Valle de Cauterets los sarrios menores de 7 años del macizo de Péguère (calizo, exposición Sur) son más pesados que los de Mayouret (granítico, exposición Norte). Estas diferencias pueden deberse a las condiciones de los hábitats en que viven las diferentes poblaciones y que en parte reflejan diferencias en los recursos alimentarios.
Tabla 4. Comparación de la masa corporal total (kg) del sarrio en varias poblaciones pirenaicas por sexos. Valores medios, desviación estándar (entre paréntesis), valores máximos y mínimos y tamaño de la muestra (N). n.s. diferencias no significativas; *= indica diferencias significativas en las medidas.
Cordillera cantábrica Se presentan los datos biométricos de ejemplares de rebeco cantábrico en las tablas 5 (ejemplares cazados en Asturias entre agosto y octubre de 1991), 6 (ejemplares cazados en la antigua reserva nacional de caza de Picos de Europa entre 1981 y 1987) y 7 (ejemplares capturados vivos -programas de reintroducciones- en Asturias entre 1992 y 2008).
Tabla 5. Biometría del rebeco cantábrico de diferentes variables en animales de más de 3 años de edad cazados en Asturias entre agosto y octubre de 1991. Masa corporal en Kg., longitudes en cm. (F. J. Pérez-Barbería y G. Mutuberría, inédito). (*) extraído de Fernández-López y García-González (1986). sd: desviación estándar; n: número de ejemplares medidos.
Tabla 6. Biometría de los ejemplares adultos de rebeco cazados en la antigua reserva nacional de caza de Picos de Europa en el período 1981-1987. Se representa la media, la desviación típica y el tamaño de la muestra (adultos > de 3 años).
La existencia de un dimorfismo sexual más acusado en el rebeco cantábrico ha sido ya descrita en estudios craneométricos de ambas subespecies (Fernández-López y García-González, 1986; Pérez-Barbería et al., 1996). En la Tabla 7 se presentan los datos biométricos tomados a 97 rebecos capturados vivos, entre 1992 y 2008, con edades comprendidas de 3 a 14 años. Los datos de los rebecos de 0 a 2 años no han sido incluidos en dicha tabla, aunque se han obtenido pesos de 8 a 13 kg (n=7) para los rebecos de cinco a diez meses, y de 13,5 a 15,5 kg (n=2) para los rebecos de entre año y medio y dos años.
Tabla 7. Datos biométricos de rebecos capturados vivos en la cordillera Cantábrica entre 1992 y 2008. (Masa: masa corporal kg, L: longitud total, H: altura a la cruz, C: contorno de cuello, O: oreja, T: longitud metatarso, LC: longitud cuerno derecho, LI: longitud cuerno izquierdo, HC: altura cuernos, PD: perímetro base cuerno derecho, PI: perímetro base cuerno izquierdo, SS: separación zona superior cuernos, DE: distancia entre extremos cuernos, SB: separación entre cuernos en su base). Los rebecos se han repartido en dos clases de edad de 3 a 4 años y de 5 a 14 años.
Variación geográfica Según Cabrera (1914), la subespecie cantábrica (R. p. parva Cabrera, 1910) se caracteriza por su menor talla, pelaje de verano más rojo y la garganta apenas un poco más pálida que el color del cuerpo. El nombre parva, utilizado para diferenciar la subespecie cantábrica de la pirenaica (R. p. pyrenaica Bonaparte, 1845), deriva del latín parvus y significa “pequeño”. Sin embargo, Pérez-Barbería y García-González (2004) citan para el sarrio pirenaico adulto un rango de 22-28 Kg (Crampe et al., 1997; Herrero et al., 1998), el cual es muy semejante al rango de peso del rebeco cantábrico adulto (hembra = 24 Kg, macho = 30 Kg. Hay que tener en cuenta que existe una fuerte variación estacional en el peso, siendo los machos los más afectados. Los machos adultos comienzan a perder peso durante el celo debido a la disminución del tiempo dedicado a alimentarse y al esfuerzo de mantener su harén o arrebatárselo a otros. Continúan perdiendo peso a lo largo del invierno debido a la reducción de alimento disponible y quizás al incremento de la tasa metabólica para mantener la homeotermia. El peso de invierno puede ser hasta un 20% menor que el peso de verano (Crampe et al., 1997). Es por esto por lo que un análisis preciso para evaluar diferencias de tamaño bien sea entre las subespecies cantábricas y las pirenaicas, o entre subpoblaciones de la misma especie, o entre sexos, tiene que tener en consideración el año y la estación en la que se peso cada animal así como su edad. No existen grandes diferencias sexuales en la longitud total y en la altura a la cruz aunque los machos son un poco más grandes. Sin embargo, sí se han puesto de manifiesto diferencias craneométricas entre las subespecies cantábrica y pirenaica, siendo el dimorfismo sexual más acusado en el primero (Fernández-López y García-González, 1986). Se ha detectado una clina NE-SO de disminución en el tamaño y longitud del cráneo en el género a lo largo de su área de distribución (Massei et al., 1994).
Referencias Alcalá, L., Morales, J. (1997). A primitive caprine from the Upper Vallesian of La Roma 2 (Alfambra, Teruel, Aragón, Spain). C.R. Acad. Sci. Paris, 324: 947-953. Alvarez-Busto, J., García-Etxebarria, K., Herrero, J., Garin, I., Jugo, B. M. (2007). Diversity and evolution of the Mhc-DRB1 gene in the two endemic Iberian subspecies of Pyrenean chamois, Rupicapra pyrenaica. Heredity, 99 (4): 406-413. Appolinaire, J., Muller, P., Berducou, C. (1984). Capture et marquage d'isards. Documents Scientifiques du Parc National des Pyrénées, 2: 1-110. Blainville, H. de (1816). Prodrome d’une nouvelle distribution systématique du Regne animal. Bull. Sci. Soc. Philom. Paris. Cabrera, A. (1910). On a new Antelope and on the Spanish Chamois. Proc. Zool. Soc. London, 1910: 998-999. Cabrera, A. (1914). Fauna Ibérica. Mamíferos. Museo Nacional de Ciencias Naturales, Madrid. 441 pp. Christie, A. H. (1964). A note on the Chamois in New Zealand. Proceeding of the N. Z. Ecological Society, 11: 32-36. Clutton-Brock, T. H., Albon, S. D. (1982). Winter mortality in red deer (Cervus elaphus). Journal of Zoology, 198: 515-519. Corti, R. (1992). Le Chamois et l'Isard. Plaquette ONC. Poncet SA Imprimeurs, Échirolles/Eybens. Couilloud, F., Jullien, J.M., Fraty, D. (1999). Le poids des chevreaux en automne: un bioindicateur utilisable pour suivre l'évolution d'une population de chamois (Rupicapra rupicapra). Gibier Faune Sauvage, 16: 273-287. Couturier, M. A. J. (1938). Le chamois. B. Arthaud, Grenoble. Crampe, J. P. (1986). Aperçus démographiques sur une population d'isards protégée. Documents Scientifiques du Parc National des Pyrénées, 21: 1-53. Crampe, J. P. (1997). Caractéristiques bio-démographiques d'une population d'isards (Rupicapra p. pyrenaica) non-chasée dans le Parc National des Pyrénées, en vallée de Cauterets. Documents scientifiques du Parc National des Pyrénées, 31: 1-169. Crampe, J. P., Caens, J. C., Dumerc, J. L., Pepin, D. (1997). La masse corporelle comme indicateur de la condition physique hivernale de I'Isard, Rupicapra pyrenaica (Artiodactyla, Bovidae). Mammalia, 61: 73-85. Dolan, J. M. (1963). Beitrag zur systematischen Gliederung des Tribus Rupicaprini Simpson, 1945. J. Zoolog. Syst. Evol. Res., 1: 311-407. Domínguez, A., Rodríguez, F., Albornoz, J., Pérez, T. (2009). El rebeco cantábrico, filogeografía e historia evolutiva. Pp. 70-102. En: Pérez-Barbería, F. J., Palacios, B. (Eds.). El Rebeco Cantábrico (Rupicapra pyrenaica parva). Conservación y Gestión de sus poblaciones. Ministerio de Medio Ambiente, Medio Rural y Marino. Naturaleza y Parques Nacionales, Madrid. 501 pp. Fernández-López, J. M., García-González, R. (1986). Craniometrie comparée entre le chamois pyrénéen et le cantabrique. Mammalia, 50: 87-97. García-González, R., Herrero, J., García-Serrano, A. (2000). Resultados de las fichas de control de sarrio en las Reservas de Caza de Aragón. Pp. 35-43. En: Herrero, J., García-Serrano, A., Fernández de Luco, D., García-González, R., Couto, S. (Eds.). Jornadas técnicas sobre el sarrio (Rupicapra pyrenaica pyrenaica). Gobierno de Aragón, Jaca. Gentry, A. W. (1978). Bovidae. Pp. 540-572. En: Evolution of American Mammals. Maglio, V. J., Cooke, H. B. S. (Eds.). Harvard Univ. Press, Cambridge. Gentry, A. W. (2000). The Ruminant radiation. Pp. 11-25. En: Vrba, E. S., Schaller, G.B. (Eds.). Antelopes, Deer, and Relatives. Fossil Record, Behavioral Ecology, Systematics, and Conservation. Yale University Press, New Haven. González-Quirós, P. (2009). Captura y reintroducciones de rebecos en la cordillera Cantábrica. Pp. 448-473. En: Perez-Barbería, F. J., Palacios, B. (Eds.). El Rebeco Cantábrico (Rupicapra pyrenaica parva). Conservación y Gestión de sus poblaciones. Ministerio de Medio Ambiente, Medio Rural y Marino. Naturaleza y Parques Nacionales, Madrid. 501 pp. Gonzalo, J., Lucientes, J., Castillo, J. A. (1992). Bronchopulmonary nematodes in Chamois (Rupicapra pyrenaica ) in Ordesa and Monte Perdido National Park (Pyrenees of Aragon, Spain). Verh. Ber. Erkrg., 34: 367-370. Hammer, S., Nadlinger, K., Hartl, G. B. (1995). Mitochondrial-dna differentiation in chamois (genus Rupicapra) - implications for taxonomy, conservation, and management. Acta Theriologica, Supplement 3:145-155. Hassanin, A., Douzery, E. J. P. 1999. The tribal radiation of the family Bovidae (Artiodactyla) and the evolution of the mitochondrial cytochrome b gene. Mol. Phylogenet. Evol.,13: 227-243. Hassanin, A., Douzery, E. J. P. (2000). Is the newly described Vietnamese bovid Pseudonovibos spiralis a chamois (genus Rupicapra)? Naturwissenschaften, 87: 122-124. Herrero, J., García-González, R., Garin, I., García-Serrano, A., Aldezabal, A. (2000a). Plan de gestión del sarrio en la Reserva de Caza de Viñamala (Macizos de Anayet, Biñamala y Monte Perdido). Informe inédito. Sección de Caza y Pesca, Gobierno de Aragón, Zaragoza. Herrero, J., Garin, I., García-González, R., García-Serrano, A., Aldezabal, A. (1998). Plan de Caza del Sarrio (Rupicapra p. pyrenaica) de la Reserva de Caza de Benasque. Informe inédito. Sección de Caza y Pesca. Gobierno de Aragón. Herrero, J., Garin, I., García-González, R., García-Serrano, A., Aldezabal, A. (2002). El sarrio en Aragón. Prames - Gobierno de Aragón, Zaragoza. Herrero, J., Prada, C., García-Serrano, A., García-González, R. (2003). Factores que influyen en el peso del sarrio adulto Rupicapra p. pyrenaica. Pp. 91. VI Jornadas de la SECEM. SECEM, Ciudad Real. Lovari, S., Scala, C., 1980. Revision of Rupicapra genus. I. A statistical re-evaluation of Couturier’s data on the morphometry of six chamois subspecies. Boll. Zool.,47: 113–124. Lovari, S. (1987). Evolutionary aspects of the biology of chamois, Rupicapra spp. (Bovidae, Caprinae). Pp. 51-61. En: Soma, H. (Ed.). The Biology and Management of Capricornis and Related Mountain Antelopes. Croom Helm, London. Lydekker, R. (1913). Catalogue of the Ungulate Mammals of British Museum (Natural History). London. Masini, F. (1985). Würmian and Holocene Chamois of Italy. Pp. 31-44. En: Lovari, S. (Ed.). The Biology and Management of Mountain Ungulates. Croom Helm, London. Masini, F., Lovari, S. (1988). Systematics, phylogenetic relationships and dispersal of the Chamois (Rupicapra spp.). Quaternary research, 30: 339-340. Massei, G., Randi, E., Markov, G., Genov, P. (1994). Multivariate analysis of craniometric characters in Bulgarian chamois. Hystrix, 5: 17-29. Nascetti, G., Lovari, S., Lanfranchi, P., Berducou, C., Mattiucci, S., Rossi, L., Bullini, L. (1985). Revision of Rupicapra genus. III. Electrophoretic studies demonstrating species distinction of chamois populations of the Alps from those of the Apennines and Pyrenees. Pp. 56-62. En: Lovari, S. (Ed.). Biology and management of mountain ungulates.Croom-Helm, London. Nores, C., Vázquez, V. M. (1987). La conservación de los vertebrados terrestres asturianos. Madrid: Ministerio de Obras Públicas y Urbanismo, Centro de Publicaciones. Nowak, R. M. (1999). Walker's Mammals of the World. 6th edn. Johns Hopkins University Press, Baltimore. Pepin, D., Faivre, R., Menaut, P. (1996a). Factors affecting the relationship between body mass and age in the izard. Journal of Mammalogy, 77: 351-358. Pérez, T., Albornoz, J., Domínguez, A. (2002). Phylogeography of chamois (Rupicapra spp.) inferred from microsatellites. Molecular Phylogenetics and Evolution, 25: 524-534. Pérez, T., Fernández, M., Hammer, S. E., Domínguez, A. (2017). Multilocus Intron Trees Reveal Extensive Male- Biased Homogenization of Ancient Populations of Chamois (Rupicapra spp.) across Europe during Late Pleistocene. Plos One, 12 (2): e0170392. Pérez, T., Hammer, S. E., Albornoz, J., Domínguez, A. (2012). Y-chromosome phylogeny in the evolutionary net of chamois (genus Rupicapra). BMC Evolutionary Biology, 11: 272. Pérez-Barbería, F. J. (1994a). Biología, Ecología y Caracterización Genética Del Rebeco Cantábrico (Rupicapra pyrenaica parva). Universidad de Oviedo. 112 pp. Pérez-Barbería, F. J. (1994b). Determination of age in Cantabrian chamois (Rupicapra pyrenaica parva) from jaw tooth-row eruption and wear. Journal of Zoology, 233: 649-656. Pérez-Barbería, F. J., Fernández-López, J. M. (1996). Using cementum annuli to estimate cantabrian chamois age. Journal of Wildlife Management, 60: 62-67. Pérez-Barbería, F. J., Mutuberria,G. (1996). Teeth eruption pattern in Cantabrian chamois Rupicapra pyrenaica parva. Acta Theriologica, 41: 217-221. Pérez-Barbería, F. J., Mutuberria,G., Nores, C. (1998). Reproductive parameters, kidney fat index, and grazing activity relationships between the sexes in Cantabrian chamois Rupicapra pyrenaica parva. Acta Theriologica, 43: 311-324. Pérez-Barbería, F. J., Pérez-Fernández, E. (2009). Identificación, biología y ecología del rebeco cantábrico. Pp. 26-69. En: Pérez-Barbería, F. J., Palacios, B. (Eds.). El Rebeco Cantábrico (Rupicapra pyrenaica parva). Conservación y Gestión de sus poblaciones. Ministerio de Medio Ambiente, Medio Rural y Marino. Naturaleza y Parques Nacionales, Madrid. 501 pp. Pérez-Barbería, F. J., Robles, L., Nores, C. (1996b). Horn growth pattern in Cantabrian chamois Rupicapra pyrenaica parva: influence of sex, location and phaenology. Acta Theriologica, 41: 83-92. Pérez-Barbería, F. J. (2009). Necesidad de un seguimiento coordinado en la condición poblacional del rebeco cantábrico. Pp. 494-501. En: Pérez-Barbería, F. J., Palacios, B. (Eds.). El Rebeco Cantábrico (Rupicapra pyrenaica parva). Conservación y Gestión de sus poblaciones. Ministerio de Medio Ambiente, Medio Rural y Marino. Naturaleza y Parques Nacionales, Madrid. 501 pp. Price, S. A., Bininda-Emonds, O. R. P., Gittleman, J. L. (2005). A complete phylogeny of the whales, dolphins and even-toed hoofed mammals (Cetartiodactyla). Biol. Rev., 80: 445-473. Reimers, E., Nordby, O. (1968). Relationship between age and tooth cementum layers in norwegian reindeer. J. Wildl. Manage., 32: 957-961. Rodríguez, F., Pérez, T., Hammer, S.E., Albornoz, J., Domínguez, A. (2010) Integrating phylogeographic patterns of microsatellite and mtDNA divergence to infer the evolutionary history of chamois (genus Rupicapra). BMC Evolutionary Biology, 10: 222. Ropiquet, A., Hassanin, A. (2005). Molecular evidence for the polyphyly of the genus Hemitragus (Mammalia, Bovidae). Mol. Phylogenet. Evol., 36: 154-168. Salzmann, H. C. (1977). Untersuchungen zur Fortpflanzungsbiologie der Gemsen im Schweizerischen Jura. Zeitschrift für Säugetierkunde, 42: 180-188. Serdio, A. (2009). Biometría y gestión cinegética del rebeco cantábrico en la antigua reserva nacional de caza de Picos de Europa. Pp. 384-395. En: Pérez-Barbería, F. J., Palacios, B. (Eds.). El Rebeco Cantábrico (Rupicapra pyrenaica parva). Conservación y Gestión de sus poblaciones. Ministerio de Medio Ambiente, Medio Rural y Marino. Naturaleza y Parques Nacionales, Madrid. 501 pp. Shackleton, D. M., Lovari, S. (1997). Classification adopted for the Caprinae Survey. Pp. 9-14. En: Shackleton, D. M. (Ed.). Wild Sheep and oats and their relatives. Status survey and Conservation action Plan for Caprinae. IUCN/SSC Caprinae Specialist Group. Gland & Cambridge. Simpson, G. G. (1945). The principles of classification and a classification of mammals. Bulletin American Museum Natural History, 85: 1-350. Storch, I. (1989). Condition in chamois populations under different harvest levels in Bavaria. J. Wildl. Manag., 53: 925-928. Thenius, E., Hofer, H. (1960). Stammesgeschichte der Saugetiere. Springer-Verlag, Berlin.
Francisco Javier Pérez-Barbería Ricardo García-González Borja Palacios Alberti Fecha de publicación: 16-06-2004 Revisiones: 24-07-2008; 28-10-2010 Otras contribuciones: 2. Alfredo Salvador. 10-08-2017 Pérez-Barbería, F. J., García-González, R., Palacios, B. (2017). Rebeco – Rupicapra pyrenaica. En: Enciclopedia Virtual de los Vertebrados Españoles. Salvador, A., Barja, I. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||