|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Para más información sobre cada apartado hacer click en:
|
Key words: Pyrenean Chamois, Cantabrian Chamois, interactions, predators, parasites, pathogens.
Interacciones entre especies Sobre interacción con especies domésticas ver Hábitat y Ecología trófica.
Estrategias antidepredatorias En zonas sometidas a actividad cinegética evita las zonas con abundante actividad humana. Tiene preferencia por ocupar áreas próximas a riscos, fuertes pendientes y el ecotono forestal que le permiten escapar fácilmente de los depredadores y molestias humanas (ver Hábitat). Los machos tienen mayores tasas de vigilancia que las hembras (Dalmau et al., 2010). Su característica señal de alarma es un resoplido corto. También patean el suelo entre 1 y 3 veces con una de las patas delanteras encarándose en la dirección de la que procede la alarma. Ante el ataque del águila real (Aquila chyraetos), se ha observado en los Apeninos defensa cooperativa de la cría por parte de las hembras (Scornavacca y Brunetti, 2016)2.
Depredadores La única especie ibérica que depreda rebecos adultos es el lobo, aunque los cabritos también son atacados por el águila real y el zorro. Un oso pardo (Ursus arctos) detectó una cría de rebeco por su olor o por el de su madre y realizó una búsqueda intensiva en una zona de 0,5-1 ha durante 45 min hasta localizarla y capturarla (Blanco et al., 2011)2. El rebeco en la dieta del lobo1 El rebeco y el lobo (Canis lupus) comparten hábitat similares a través de prácticamente toda la Cordillera Cantábrica. Información procedente de cinco zonas distribuidas a lo largo de Asturias (sierras del noroccidente, suroccidente de Asturias, Parque Natural de Somiedo, Parque Natural de Redes y el territorio comprendido por el antiguo Parque Nacional de la Montaña de Covadonga (aPNMC) indica que el rebeco entra a formar parte de la dieta del lobo en relación a la abundancia de este ungulado (Tabla 1).
Tabla 1. Porcentaje de consumo de rebeco en la dieta del lobo en Asturias a lo largo de un ciclo anual. Frecuencia de aparición: porcentaje del número de heces de lobo en las que presencia de rebeco fue detectada; Biomasa: porcentaje de biomasa de rebeco respecto a la biomasa total de las presas ingeridas.
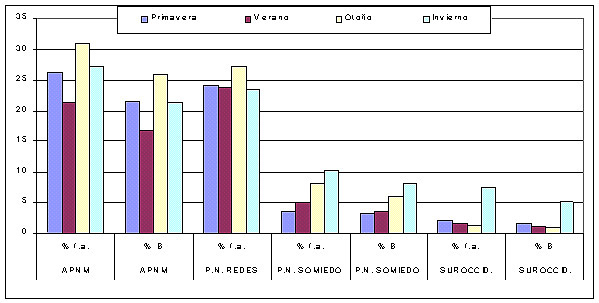
En el aPNMC el consumo de rebeco presenta cambios significativos a lo largo de todo el año, debido principalmente al distinto consumo entre primavera y verano frente al resto del año, siendo el máximo de consumo durante el otoño (Fig. 1). En el P.N. de Redes el periodo anual donde aparece un mayor consumo, al igual que en el aPNMC, fue en otoño e invierno (Fig. 1). En el Parque Natural de Somiedo el consumo de rebeco no presenta cambios significativos a lo largo de todo el año, siendo en invierno y en otoño las estaciones con mayor consumo (Fig. 1). En el suroccidente de Asturias el rebeco es consumido con mayor frecuencia, a lo largo del ciclo anual, en invierno, mientras que en el resto de las estaciones su consumo apenas supera el 2 % (Fig. 1).
Figura. 1.- Consumos estacionales de rebeco en cuatro zonas de Asturias (% f.a: frecuencia de aparición en heces; % B: porcentaje en biomasa en relación a la biomasa total consumida)
La baja densidad de rebecos en el sur-occidente asturiano permite explicar su bajo consumo. En el aPNMC y en el P. N. de Redes la influencia de las nevadas en la predación del lobo sobre el rebeco puede explicar, en parte, el importante consumo en otoño-invierno. Es importante considerar también que, especialmente en el aPNMC, existe una mortalidad de rebecos en invierno debido a las avalanchas, inanición, etc., lo que permite que esos animales sean aprovechados por los lobos como carroña. Las crías de los rebecos durante la época de partos (primavera) son especialmente vulnerables a los ataques de los lobos. En el P.N. de Somiedo se ha estudiado en detalle la selección de presa y alimentación del lobo (Llaneza, 1996). Cuando se realizó ese estudio el rebeco era el ungulado silvestre más abundante. El análisis realizado sobre selección de presa puso de manifiesto que el lobo mostraba una selección negativa, es decir, una menor preferencia sobre el rebeco, sólo superada por el vacuno (Tabla 2).
Tabla 2. Disponibilidad de especies y valores del Índice de Selección de Ivlev (I. S.), en el Parque Natural de Somiedo. N: número de ejemplares (resultados de los censos poblacionales). %: porcentaje respecto al total de especies. Según Llaneza (1996).
Esta selección negativa hacia el rebeco puede ser debida a su dificultad de captura, sobre todo en zonas muy agrestes. Se ha observado que los lobos desisten de capturar rebecos una vez que estos se encaraman a riscos de difícil acceso. En lugares donde los rebecos son muy abundantes, como el P. N. de Redes y Picos de Europa, ocupan zonas forestales y praderas subalpinas, siendo en estas zonas donde son más vulnerables a los ataques de los lobos.
Parásitos y patógenos Cordillera Cantábrica Nematodos: Muellerius sp., Neostrongylus linearis, Spiculopteragia spiculoptera (Cordero del Campillo et al., 1994)2. Ácaros: Dermacentor marginatus, Haemaphysalis punctata (Cordero del Campillo et al., 1994)2. El brote de sarna sarcóptica, que aún en la actualidad afecta al rebeco cantábrico (Fernández-Morán et al., 1997, González-Quirós et al., 2002), fue detectado por primera vez en mayo de 1993 en las proximidades del Pico Torres (Concejo de Aller, Asturias). Desde entonces el área afectada por la enfermedad se ha ido extendiendo de forma continua, habiendo sido registrados hasta 2007 un número superior a los 1500 animales afectados en las Reservas Regionales de Caza del Principado de Asturias (González-Quirós y Sánchez 2007), así como en las reservas regionales de Mampodre y Riaño en León (Peral et al., 2009). Esto convierte a la sarna sarcóptica en el proceso patológico más importante de cuantos afectan al rebeco cantábrico en fechas recientes (Rodríguez et al., 2009). A principios del año 2000 se confirmó la existencia de la enfermedad en el interior del Parque Nacional de los Picos de Europa, concretamente en el municipio leonés de Sajambre. En enero de 2002 la epidemia llegó al desfiladero de los Beyos (Río Sella) para continuar avanzando hacia el Este (Álvarez-Cienfuegos y Menéndez, 2009). En el año 2008 la sarna había sido detectada en los límites de Cantabria con León y Palencia. La sarna sarcóptica ha afectado a gran parte del núcleo de la población oriental de rebeco cantábrico (situado al este de la autopista del Huerna) sin que en 2009 hubiera todavía alcanzado la zona más oriental de su distribución en Cantabria. En 2009 el núcleo occidental de la Cordillera Cantábrica no presentaba ejemplares con sarna sarcóptica, sin embargo la expansión poblacional de este núcleo podría, en un futuro, comunicar ambas poblaciones y facilitar la transmisión de la enfermedad a la población occidental (González-Quirós y Solano, 2009). Las comunidades de Asturias y Castilla y León tomaron diversas medidas de control para frenar la progresión de la enfermedad, pero han resultado infructuosas. Por ejemplo, en las reservas leonesas de Riaño y Mampodre se abatieron entre 1999 y 2008 un total de 900 ejemplares supuestamente infectados (Peral et al., 2009). Los programas de seguimiento de la enfermedad han permitido registrar su extensión y virulencia. Después de haber transcurrido 15 años desde el inicio del brote de sarna, la enfermedad ha avanzado unos 40 kilómetros dirección Este, a una media de 2,6 km/año y a fecha de 2009 sigue su avance. Quedan libres de la enfermedad las poblaciones situadas al Oeste del foco de inicio, probablemente debido a que las menores densidades de rebecos en esta área dificultan su transmisión. En 2009 alrededor del 56% de la población ya convive con la sarna afectando al 60% de su área de distribución (Pérez-Barbería et al., 2009). (Ver Distribución). Las lesiones dérmicas se manifiestan como una inflamación epidérmica crónica con hiperqueratosis y paraqueratosis. En el rebeco cantábrico las primeras lesiones se detectan generalmente a nivel de cuello, orejas y cara, para extenderse paulatinamente pudiendo afectar a la práctica totalidad de su superficie corporal. Aparte de las alteraciones cutáneas indicadas, cabe señalar una mayor presencia de otros agentes parasitarios, un evidente deterioro de la condición corporal (menor engrasamiento perirenal) y un mayor nivel de estrés crónico (basado en el mayor tamaño de las glándulas adrenales) (Rodríguez et al., 2009). En función de las lesiones observadas y el comportamiento, los animales se pueden clasificar en cuatro grupos: Tipo 1. Imposible verificar la presencia de la enfermedad. Únicamente pausas en su actividad normal y comienzo de rascado. Tipo 2. Clara evidencia de la enfermedad. Se observan lesiones a distancia, comportamiento con continuos rascado y sacudidas. Tipo 3. El animal muestra aspecto enfermizo, movilidad limitada y lesiones extendidas. Tipo 4. Movilidad prácticamente nula y lesiones muy extendidas. (Álvarez-Cienfuegos y Menéndez, 2009). Si analizamos la afección de la sarna según sexos y clases de edad, comprobamos como la epidemia incide en mayor medida en los machos adultos, lo que explica la alteración de la razón sexual en las poblaciones afectadas. Las crías resultan poco infestadas. Estas afecciones diferenciales según sexos y clases de edad, también habían sido constatadas en algunas poblaciones alpinas de rebecos (Onderscheka, 1982), aunque no han sido observadas en otras áreas, como en los Dolomitas Italianos (Rossi et al., 2007). (González-Quirós y Solano, 2009). Entre agosto de 1997 y agosto de 1998 se marcaron 22 rebecos adultos en la Reserva Regional de Caza de Caso que no fue afectada por la sarna hasta el invierno de 1998. El objetivo del marcaje era evaluar la mortalidad debida a la sarna en una zona muy próxima al frente de avance. El tiempo medio de desaparición de los ejemplares, fue de 24,1 meses para los machos y de 33,7 meses para las hembras. En 11 de esos rebecos se diagnosticó la afección por sarna (González-Quirós y Solano, 2009). Protista: Toxoplasma gondii (Rodríguez et al., 2009). Bacterias: Entre el resto de agentes patógenos cabe destacar la presencia de anticuerpos frente a pestivirus (relevante considerando las mortalidades asociadas en poblaciones de rebeco pirenaico), así como frente a agentes bacterianos como Mycobacterium avium paratuberculosis, Leptospira interrogans y Chlamydophila abortus y un protozoo (Toxoplasma gondii). La ausencia de otros agentes patógenos estudiados y la escasa prevalencia de algunos de los procesos detectados, así como los datos de necropsia de animales muestreados aleatoriamente, indican un buen estado sanitario de las poblaciones de rebeco cantábrico en Asturias (Rodríguez et al., 2009). Virus: Se ha registrado el virus de la lengua azul en el 53,4% de una muestra de rebecos cantábricos (n= 131) obtenidos entre 2006 y 2011 (Lorca-Oro et al., 2014)2. Se ha detectado infección por encefalomielitis ovina causada por Flavovirus sp. en rebecos cantábricos muestreados entre 2007 y 2011(Martín-Hernando et al., 2013; Ruiz-Fons et al., 2014)2. Pirineos Nematodos: Capilaria bovis, Chabertia ovina, Cooperia oncophora, Haemonchus contortus, Marshallagia marschali, Marschallagia occidentalis, Nematodirus abnormalis, Nematodirus filicolis, Nematodirus oiratianus, Oesophagostomum venulosum, Ostertagia leptospicularis, Ostertagia lyrata, Ostertagia ostertagi, Skrjabinema ovis, Teladorsagia circumcincta, Teladorsagia trifurcata, Trichostrongylus axei, Trichostrongylus capricola, Trichostrogylus colubriformis, Trichostrongylus vitrinus, Trichuris globulosa, Trichuris ovis, Trichuris discolor, Trichuris skrjabini (Martínez-Guijosa et al., 2015)2. En una muestra de rebecos pirenaicos (n= 28) de otoño, los machos mostraron reducción de la condición física y mayor estrés oxidativo debido a la elevada carga de nematodos pulmonares (Protostrongylus rufescens boevi, Protostrongylus rufescens rufescens, Protostrongylus rupicaprae, Spilocaulus austriacus, Muellerius sp., Neostrongylus linearis) (Oliver-Guimerá et al., 2017)2. En machos pirenaicos se ha observado una comunidad parásitos gastrointestinales diferente a la de las hembras, con mayor prevalencia, intensidad de infección y riqueza que en estas (Martínez-Guijosa et al., 2015)2. Cestodos: Moniezia sp. (Martínez-Guijosa et al., 2015)1, Multiceps multiceps (Cordero del Campillo et al., 1994)2. Protista: Ophryoscolex monoacanthus (Cordero del Campillo et al., 1994)2, Toxoplasma gondii (Gauss et al., 2006). Se ha detectado infección por los piroplasmas Theileria sp. OT3 y Theileria ovis (García Sanmartín et al., 2007). Hongos: Se ha detectado dermatofitosis causada por Trichophyton mentagrophytes en rebecos de los Pirineos orientales (Marco et al., 2007). Bacterias: La queratoconjuntivitis (producida por Mycoplasma conjunctivae) ha sido la epizootia más extendida en las poblaciones de rebecos en los últimos años. Causa purulencias en torno a los ojos y llega a producir la ceguera total. Se extendió con virulencia a las poblaciones del Pirineo Central y occidental en la década de los 80 (Müller et GM PNP, 1984). Durante la década de los 90 apareció algún brote aislado de escasa importancia y se considera que la enfermedad sigue latente. A pesar de que la contagiosidad es muy elevada, muestra una patogenicidad reducida. Las poblaciones se recuperan adecuadamente después del brote epidémico, por lo que cualquier medida preventiva o profiláctica frente a la queratoconjuntivitis se ha demostrado inútil (Loison et al., 1996). En 2005 comenzó una epidemia de queratoconjuntivitis que duró cuatro años. Comenzó en el norte de la cordillera pirenaica y pasó también al sur. La prevalencia en adultos fue del 10,5%. Se observó la presencia de huérfanos en el 22,2% de los grupos familiares (Gelormini et al., 2017)2. Por otra parte, las neumonías causadas por Pasteurella multocida están consideradas como una patología importante de las gamuzas. Causa mortalidad, a veces elevada, en crías y jóvenes durante el verano y el otoño, principalmente. Se ha detectado Rickettsia helvetica en garrapatas (Ixodes ricinus) colectadas sobre rebecos pirenaicos (Davoust et al., 2012)2. Virus: Recientemente ha aparecido en el Pirineo catalán un nuevo agente patógeno, conocido como pestivirus, que puede causar una alta mortalidad. Fue detectado por primera vez en 2001-2002 en la Reserva de caza del Alt Pallars (Marco y Lavín, 2004). En determinados valles de esta reserva se advirtió una reducción del censo del 40%, aunque no pudo ser atribuido completamente a esta causa. Los síntomas son: debilidad y dificultad de movimiento, alopecia progresiva, hiperpigmentación de la piel, presencia de garrapatas, etc. Desde finales de los 90, en el Pirineo español se realizan controles sanitarios rutinarios de una proporción variable de los animales cazados y encontrados muertos. Este pestivirus, la enfermedad de la frontera (border disease virus, BDV, pestivirus que afecta pricipalmente a ovejas y cabras), se ha identificado en ejemplares de Pirineos encontrados muertos (Arnal et al., 2004; Hurtado et al., 2004; Frolich et al., 2005). El análisis de muestras de 116 rebecos recogidas entre 2002 y 2006 ha revelado que la infección es endémica y podría tener impacto sobre la dinámica de poblaciones de rebecos (Marco et al., 2008). El rebeco expele el virus de la frontera a través de las vías nasales, oral, fecal y urinaria (Cabezón et al., 20102). En unas zonas hay frecuente circulación del virus de la frontera con impacto negativo sobre la dinámica de poblaciones mientras que en otras no hay circulación y hay una recuperación rápida de las poblaciones (Fernández-Sirera et al., 2012)2. El seguimiento en el Parque Nacional d’Aigüestortes i Estany de Sant Maurici entre 1993 y 2009 mostró fluctuaciones de población, probablemente debido a los episodios de queratoconjuntivitis registrados en 1996-1997 y 2004-2005 y de pestivirus en 2001-2002 (Pañella et al., 2010)2. Se ha identificado un gammaherpesvirus (RpHV-1) en los pulmones de un rebeco pirenaico (Fernández-Aguilar et al., 2016)2.
Referencias Alvarez-Cienfuegos, G., Menéndez, M. (2009). Seguimiento de la sarna sarcóptica en el Parque Nacional de los Picos de Europa. Pp. 320-336. En: Perez-Barbería, F. J., Palacios, B. (Eds.). El Rebeco Cantábrico (Rupicapra pyrenaica parva). Conservación y Gestión de sus poblaciones. Ministerio de Medio Ambiente, Medio Rural y Marino. Naturaleza y Parques Nacionales, Madrid. 501 pp. Arnal, M. C., Fernández de Luco, D., Riba, L., Maley, M., Gilray, J., Willoughby, K., Vilcek, S., Nettleton, P. F. (2004). A novel pestivirus associated with deaths in Pyrenean chamois (Rupicapra pyrenaica pyrenaica). Journal of General Virology, 85 (12): 3653-3657. Blanco, J. C., Ballesteros, F., García-Serrano, A., Herrero, J., Nores, C., Palomero, G. (2011). Behaviour of brown bears killing wild ungulates in the Cantabrian Mountains, Southwestern Europe. European Journal of Wildlife Research, 57 (3): 669-673. Cabezón, O., Rosell, R., Velarde, R., Mentaberre, G., Casas-Díaz, E., Lavín, S., Marco, I. (2010). Border disease virus shedding and detection in naturally infected Pyrenean chamois (Rupicapra pyrenaica). Journal of Veterinary Diagnostic Investigation, 22 (5): 744-747. Cordero del Campillo, M., Castañón Ordóñez, L., Reguera Feo, A. (1994). Índice- catálogo de zooparásitos ibéricos. Segunda edición. Secretariado de publicaciones, Universidad de León. 650 pp. Dalmau, A., Ferret, A., Manteca, X. (2010). Vigilance behavior of Pyrenean chamois Rupicapra pyrenaica pyrenaica: Effect of sex and position in the herd. Current Zoology, 56 (2): 232-237. Davoust, B., Socolovschi, C., Revelli, P., Gibert, P., Marie, J. L., Raoult, D., Parola, P. (2012). Detection of Rickettsia helvetica in Ixodes ricinus ticks collected from Pyrenean chamois in France. Ticks and Tick-borne Diseases, 3 (5-6): 386-387. Fernández-Aguilar, X., Esperón, F., Cabezón, O., Velarde, R., Mentaberre, G., Delicado, V., Muñoz, M. J., Serrano, E., Lavín, S., López-Olvera, J. R. (2016). Identification of a gammaherpesvirus belonging to the malignant catarrhal fever group of viruses in Pyrenean chamois (Rupicapra p. pyrenaica). Archives of Virology, 161 (11): 3249-3253. Fernández Morán, J., Gómez, S., Ballesteros, F., Quirós, P., Benito, J.L., Feliu, C., Nieto, J.M. (1997). Epizootiology of sarcoptic mange in a population of cantabrian chamois (Rupicapra pyrenaica parva) in Northwestern Spain. Veterinary Parasitology 73, 163-171. Fernández-Sirera, L., Cabezón, O., Allepuz, A., Rosell, R., Riquelme, C., Serrano, E., Lavín, S., Marco, I. (2012). Two Different Epidemiological Scenarios of Border Disease in the Populations of Pyrenean chamois (Rupicapra p. pyrenaica) after the First Disease Outbreaks. Plos One, 7 (12): e51031. Frolich, K., Jung, S., Ludwig, A., Lieckfeldt, D., Gibert, P., Gauthier, D., Hars, J. (2005). Detection of a newly described pestivirus of Pyrenean chamois (Rupicapra pyrenaica pyrenaica) in France. Journal of Wildlife Diseases, 41 (3): 606-610. García Sanmartín, J., Aurtenetxe, O., Barral, M., Marco, I., Lavíin, S., García-Pérez, A. L., Hurtado, A. (2007). Molecular detection and characterization of piroplasms infecting cervids and chamois in northern Spain. Parasitology, 134 (3): 391-398. Gauss, C. B. L., Dubey, J. P., Vidal, D., Cabezón, O., Ruiz-Fons, F., Vicente, J., Marco, I., Lavin, S., Gortázar, C., Almería, S. (2006). Prevalence of Toxoplasma gondii antibodies in red deer (Cervus elaphus) and other wild ruminants from Spain. Veterinary Parasitology, 136 (3-4): 193-200. Gelormini, G., Gauthier, D., Vilei, E. M., Crampe, J. P., Frey, J., Ryser-Degiorgis, M. P. (2017). Infectious keratoconjunctivitis in wild Caprinae: merging field observations and molecular analyses sheds light on factors shaping outbreak dynamics. BMC Veterinary Research, 13: 67. González-Quirós, P., Sánchez, S. (2007). Censo de Rebeco en las Reservas de Caza de la Zona occidental de Asturias, año 2007. Informe Inédito. Consejería de Medio Ambiente y Desarrollo Rural del Principado de Asturias. González-Quirós, P., Sánchez, S., Solano, S. (2002). Programa de Seguimiento de la Evolución de la Sarna en las Poblaciones de Rebeco de las Reservas de Caza de Aller, Caso, Piloña y Ponga. Informe Inédito. Consejería de Medio Ambiente del Principado de Asturias. González-Quirós, P., Solano, S. (2009). Monitorización del brote de sarna sarcóptica en las reservas regionales de caza de Asturias. Pp. 292-319. En: Perez-Barbería, F. J., Palacios, B. (Eds.). El Rebeco Cantábrico (Rupicapra pyrenaica parva). Conservación y Gestión de sus poblaciones. Ministerio de Medio Ambiente, Medio Rural y Marino. Naturaleza y Parques Nacionales, Madrid. 501 pp. Hurtado, A., Aduriz, G., Gómez, N., Oporto, B., Juste, R. A., Lavin, S., López-Olvera, J. R., Marco, I. (2004). Molecular identification of a new pestivirus associated with increased mortality in the pyrenean chamois (Rupicapra pyrenaica pyrenaica) in Spain. Journal of Wildlife Diseases, 40 (4): 796-800. Llaneza, L. (1995). Variación de la dieta del lobo en Asturias. Consejería de Agricultura. Principado de Asturias. Informe Inédito. 35 pp. Llaneza, L. (1996). Selección de Presa y Alimentación del Lobo Ibérico (Canis lupus L.) en el Parque Natural de Somiedo. Seminario de Investigación. Universidad de Oviedo. 20 pp. Llaneza, L., Fernández, A., Nores, C. (1996). Dieta del lobo en dos zonas de Asturias (España) que difieren de carga ganadera. Doñana Acta Vertebrata, 23 (2): 201-213. Llaneza, L., Iglesias, J., Rico, M. (2000). Hábitos alimenticios del lobo en el antiguo Parque Nacional de la Montaña de Covadonga. Galemys, 12 (N.E.): 93-102. Loison, A., Gaillard, J. M., Gaillard, J. M., Jullien, J. M. (1996). Demographic patterns after an epizootic of keratoconjunctivitis in a chamois population. Journal of Wildlife Management, 60: 517-527. Lorca-Oro, C., López-Olvera, J. R., Ruiz-Fons, F., Acevedo, P., Garcia-Bocanegra, I., Oleaga, A., Gortázar, C., Pujols, J. (2014). Long-Term Dynamics of Bluetongue Virus in Wild Ruminants: Relationship with Outbreaks in Livestock in Spain, 2006-2011. Plos One, 9 (6): e100027. Marco, I., Lavin, S. (2004). El seguimiento sanitario del rebeco en Cataluña y Val d'Aran. En: Herrero, J., Escudero, E., Luco, D.F.d., García-González, R. (Eds.). El sarrio: biología, patología y gestión. Consejo Protección de la Naturaleza de Aragón, Gobierno de Aragón, Zaragoza. Marco, I., López-Olvera, J. R., Gibert, P., Abarca, L., Gauthier, D., Lavin, S. (2007). Dermatophytosis caused by Trichophyton mentagrophytes in the Southern Chamois (Rupicapra pyrenaica) in the Eastern Pyrenees. Zoonoses and Public Health, 54 (6-7): 278-280. Marco, I., Rosell, R., Cabezón, O., Mentaberre, G., Casas, E., Velarde, R., López-Olvera, J. R., Hurtado, A., Lavin, S. (2008). Epidemiological study of border disease virus infection in Southern chamois (Rupicapra pyrenaica) after an outbreak of disease in the Pyrenees (NE Spain). Veterinary Microbiology, 127 (1-2): 29-38. Martín-Hernando, M. P., Balseiro, A., Oleaga, A., Gortázar, C., Ruiz-Fons, F. (2013). Encephalitis in Cantabrian chamois (Rupicapra pyrenaica parva) caused by a flavivirus. Journal of Comparative Pathology, 148 (1): 83. Martínez-Guijosa, J., Martínez-Carrasco, C., López-Olvera, J. R., Fernández-Aguilar, X., Colom-Cadena, A., Cabezón, O., Mentaberre, G., Ferrer, D., Velarde, R., Gasso, D., Garel, M., Rossi, L., Lavín, S., Serrano, E. (2015). Male-biased gastrointestinal parasitism in a nearly monomorphic mountain ungulate. Parasites & Vectors, 8: 165. Muller, P., PNP, G. M. (1984). Keratoconjuntivite de l'isard. Documents Scientifiques du Parc National des Pyrénées, 13: 1-105. Oliver-Guimerá, A., Martínez-Carrasco, C., Tvarijonaviciute, A., Ruiz de Ybáñez, M. R., Martínez-Guijosa, J., López-Olvera, J. R., Fernández-Aguilar, X., Colom-Cadena, A., Mentaberre, G., Velarde, R., Gassó, D., Garel, M., Rossi, L., Lavín, S., Serrano, E. (2017). The physiological cost of male-biased parasitism in a nearly monomorphic mammal. Parasites & Vectors, 10: 200. Onderscheka, K. (1982) Etat actuel de la recherche sur la gale du chamois. Pp. 89-108. En: Proc. Symp. Sur le chamois. Conseil International de la Chasse et de la Faune sauvage. Ljubljana. Pañella, P., Herrero, J., Canut, J., García-Serrano, A. (2010). Long-term monitoring of Pyrenean Chamois in a protected area reveals a fluctuating population. Hystrix, 21 (2): 183-188. Peral, J.C., García, E., Paredes, F., Martínez, J.J., Gomez, C., Benito, F. (2009). Situación y gestión de las poblaciones de rebeco cantábrico en Castilla y León. Pp. 170-201. En: Perez-Barbería, F. J., Palacios, B. (Eds.). El Rebeco Cantábrico (Rupicapra pyrenaica parva). Conservación y Gestión de sus poblaciones. Ministerio de Medio Ambiente, Medio Rural y Marino. Naturaleza y Parques Nacionales, Madrid. 501 pp. Pérez-Barbería, F. J., Palacios, B., González-Quirós, P., Cano, M., Nores, C., Díaz, A. (2009). La evolución de la población del rebeco en la cordillera Cantábrica. Pp. 106-125. En: Perez-Barbería, F. J., Palacios, B. (Eds.). El Rebeco Cantábrico (Rupicapra pyrenaica parva). Conservación y Gestión de sus poblaciones. Ministerio de Medio Ambiente, Medio Rural y Marino. Naturaleza y Parques Nacionales, Madrid. 501 pp. Rodríguez, O., Oleaga, A., Prieto, M., Espí, A., Balseiro, A., Casais, R., Gortázar, C. (2009). Seguimiento sanitario del rebeco cantábrico en el Principado de Asturias. Pp. 270-290. En: Perez-Barbería, F. J., Palacios, B. (Eds.). El Rebeco Cantábrico (Rupicapra pyrenaica parva). Conservación y Gestión de sus poblaciones. Ministerio de Medio Ambiente, Medio Rural y Marino. Naturaleza y Parques Nacionales, Madrid. 501 pp. Rossi, L., Fraquelli, C., Vesco, U., Permunian, R., Sommavilla, G. M., Carmignola, G., da Pozzo, R., Meneguz, P. G. (2007). Descriptie epidemiology of a scabies epidemic in chamois in the Dolomite Alps, Italy. Eur. J. Wildl. Res., 53 (2): 131-141. Ruiz-Fons, F., Balseiro, A., Willoughby, K., Oleaga, A., Dagleish, M. P., Pérez-Ramírez, E., Havlikova, S., Klempa, B., Llorente, F., Martín-Hernando, M. P. (2014). Clinical infection of Cantabrian chamois (Rupicapra pyrenaica parva) by louping ill virus: new concern for mountain ungulate conservation? European Journal of Wildlife Research, 60 (4): 691-694. Scornavacca, D., Brunetti, C. (2016). Cooperative defence of female chamois successfully deters an eagle attack. Mammalia, 80 (4): 453-456.
Francisco Javier Pérez-Barbería Ricardo García-González Borja Palacios Alberti Fecha de publicación: 16-06-2004 Revisiones: 24-07-2008; 28-10-2010 Otras contribuciones: 1. Luis Llaneza. 28-09-2004. 2. Alfredo Salvador. 10-08-2017 Pérez-Barbería, F. J., García-González, R., Palacios, B. (2017). Rebeco – Rupicapra pyrenaica. En: Enciclopedia Virtual de los Vertebrados Españoles. Salvador, A., Barja, I. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||