|
|
||||||||||||||||
|
||||||||||||||||
|
Para más información sobre cada apartado hacer click en:
|
Key words: Roe deer, voice, activity, home range, movements, scent marking.
Actividad Los diferentes autores que estudian la actividad en el corzo hacen referencia a una alimentación en pequeños tramos de tiempo, seguidos de intervalos de descanso (A. N. C. G. G., 1992; Prior, 1995). Concretamente, Perco y Perco (1979) establecen periodos de sueño profundo en los individuos de 2 y 4 h en invierno y verano respectivamente, y de 5 y 6 h también para el invierno y verano, dormitando. Vicent et al. (1979) establecen los picos máximos de actividad durante el alba y el ocaso, coincidiendo con buena parte de los autores centroeuropeos. Los estudios que a este respecto se han llevado a cabo en la península ibérica, se refieren a las poblaciones extremeña y andaluza por Mateos-Quesada (2002) y Delibes (1996). Según este último autor, existe una media en cada individuo de 10,1 ± 0,6 de periodos de actividad y 12,8 ± 0,9 periodos de reposo al día. Además, en este mismo estudio, los diferentes picos de actividad de cada uno de los individuos sobre los que se llevó a cabo el estudio (n = 3), no coinciden entre sí, hecho que es habitual cuando se estudian poblaciones en su conjunto en base a las observaciones individuales. El trabajo llevado a cabo en Las Villuercas (centro peninsular), contempla máximos de actividad en el alba y el ocaso de cada día, además de un incremento en la actividad en las horas centrales del día. Además de ello, este estudio puso de manifiesto la diferencia entre la actividad poblacional entre la época de celo y el resto del año. En efecto, mientras que fuera del periodo de celo los picos de actividad se encontraban según lo descrito anteriormente, durante el celo existe una creciente actividad en el centro de la mañana y en el centro de la tarde, además de los incrementos en el amanecer, mediodía y anochecer (Mateos-Quesada, 2002).
Dominio vital El tamaño medio del dominio vital de individuos (dos machos y tres hembras) translocados en la Serra da Gardunha (Portugal), fue de 409,64 ha en verano y 116,20 ha en invierno (Carvalho et al., 2008)2.
Movimientos Los corzos son animales forestales que no llevan a cabo movimientos migratorios como tal (Perco y Perco, 1979). Esta afirmación no evita que se puedan dar movimientos estacionales en determinadas poblaciones debido a las circunstancias climáticas y topográficas; además de éstas, existen movimientos de dispersión a nivel individual (Kurt, 1990). De manera general y respecto a los movimientos horizontales, sólo han sido descritas en zonas septentrionales y muchas veces han sido desplazamientos de pequeños grupos o familiares en busca de alimentos en los meses más crudos. Ello no evita que hayan sido descritos en algunas ocasiones y como fruto de la llegada de inviernos extremadamente rigurosos, desplazamientos de hasta varios cientos de kilómetros en poblaciones enteras (Danilkin, 1996). En estos casos han sido observados agrupaciones de grupos familiares entre sí hasta la unión de varios cientos de individuos en un único y consensuado movimiento estacional. A pesar de ello este extremo nunca ha podido ser descrito en las poblaciones ibéricas y sí una suerte de desplazamientos altitudinales. Estos desplazamientos consisten en los movimientos que determinados individuos pueden realizar dentro del seno de una población, de sus cuarteles de verano en lo más alto de sierras y cordilleras, hasta zonas de valle una vez que aparecen las nieves. Estos movimientos suelen ser de varios cientos de metros hasta escasos kilómetros, se realizan en solitario o en grupos familiares en primera generación. Han sido observados y descritos estos movimientos dentro de la península ibérica en los estudios realizados en la cornisa cantábrica (Costa, 1992) pero no en los realizados en sierras centrales o del sur (Aragón, 1993; Delibes, 1996; Mateos-Quesada, 1998). En estos casos, los inviernos son más suaves, la nieve no alcanza las cumbres de los lugares estudiados y los corzos pueden permanecer en el área de campeo durante el ciclo anual completo. En estribaciones de los montes de Toledo, concretamente en la sierra de Las Villuercas, en inviernos extremos donde la nieve ha hecho su aparición de manera abundante, han sido observado movimientos en desplazamientos verticales; en este caso no se ha observado por parte de los machos que no se han visto obligado a estos movimientos un relajamiento de su actitud agresiva y los machos desplazados se han localizado en las fronteras territoriales de las zonas que se ven obligados a ocupar. En el caso de las hembras y debido a la actitud más permisiva en la ocupación espacial, no existen problemas de acoplamiento de las nuevas aportaciones y simplemente intentan evitar, como es habitual por otra parte, las coincidencias en el mismo lugar.
Dispersión La dinámica anual de grupos familiares, caracterizada por un gregarismo mínimo formado por hembras, las crías del año y ocasionalmente el macho, obliga a las crías a emanciparse del grupo en cuanto comienza la nueva paridera. Esto obliga a una serie de movimientos de dispersión por parte de los jóvenes que les podrá llevar varios años en el caso de los machos, y que culmina en todo caso con la ocupación de un territorio y por tanto de un nuevo sedentarismo. Las hembras tendrán menos problemas a la hora de asentarse en un territorio, en tanto que pueden ocupar un área que solape en buena parte con el territorio de su propia madre (Vicent et al., 1983); en todo caso la densidad de hembras en zonas de alta ocupación no aumenta respecto a otras áreas, por lo que deben acabar siendo expulsadas a pesar de que entre con ellas exista más permisividad que para el caso de los jóvenes machos. Respecto a los machos, pueden llegar a alcanzar un territorio a los dos años de vida, pero lo normal que es que esto suceda en su tercer año (Bideau et al., 1983a). Las características medioambientales restringen la abundancia y el proceso de dispersión de los corzos. El proceso de dispersión ha sido afectado por las precipitaciones y la estructura del paisaje en el Sistema Ibérico. Durante el proceso de expansión los corzos han colonizado zonas con precipitaciones elevadas y constantes y el paisaje se caracteriza por mosaicos de tierras agrícolas con una elevada proporción de bosques. En la fase final de la dispersión se ha asentado en zonas donde es escaso y que probablemente sirven de corredores de dispersión (Acevedo et al., 2005).1
Patrón social y comportamiento Voz El corzo tiene una serie de sonidos que son utilizados en diferentes circunstancias. Algunos de ellos son agudos y casi inaudibles, utilizados para la comunicación en corto. Otros tienen un amplio espectro, son roncos y audibles en una amplia superficie, donde varios individuos lejanos pueden percibir el mensaje. La ladra es un sonido ronco, muy sonoro y seco. Puede ser producido por todos los individuos salvo las crías, y se ha llegado a descubrir en ellos dos significados diferentes (Apollonio, datos no publicados). Un primer caso tiene funciones antidepredatorias: un individuo ve o huye de algún predador y emite este sonido de manera repetida. Serían emitidos por machos, hembras o jóvenes y albergaría al menos un par de mensajes diferentes. Un mensaje directo iría dirigido hacia el mismo depredador, haciéndole ver que ha sido descubierto y que no cuenta con el factor sorpresa; por otra parte podríamos pensar que la intensidad y la repetición de este bronco y sonoro mensaje, podría dar una idea al mismo predador de la fortaleza física de quien ladra y por tanto de la dificultad de atraparle. Una segunda función sería la de advertir a los congéneres de la presencia de este predador; en todo caso, la conducta individualista de la especie hace pensar que esta función sería indirecta y no habría intencionalidad en este sentido. También existe una ladra proferida entre machos a fin de establecer vínculos jerárquicos o de propiedad en este sexo, ajenos completamente a un posible peligro o riesgo de depredación y que pueden ser consideradas sonidos territoriales. Este tipo de ladras apoya al sistema de marcaje visual y químico que despliegan los machos en los meses de marcaje territorial, por lo que en este momento aparece un fuerte ascenso de este tipo de emisiones, así como de los intercambios sonoros entre dos y hasta tres machos para de nuevo, caer en abril coincidiendo con la disminución del propio marcaje. A finales de agosto existe un aumento en el marcaje sonoro del corzo, pero es debido sobre todo a los jóvenes machos nacidos en la primavera del año anterior y que entran en celo por primera vez. No existe por tanto, tal y como alberga el conocimiento popular, un doble celo en el corzo y ni siquiera los aumentos en los ladridos se ubican en la época de celo como tal (Mateos-Quesada, 2002). Un sonido completamente diferente al descrito hasta este momento es el de los piídos. Lo producen todos los individuos, son poco audibles, agudos, finos y prolongados. Son producidos entre machos y hembras y entre hembras y sus crías; en todo caso resulta ser un contacto íntimo entre dos o más individuos. Se desconoce la función concreta de ellos, pero es conocida la función de amenaza, la de sumisión e incluso el acercamiento protocolario entre individuos que albergan estos sonidos. A pesar de ello, el uso de estos piídos entre diferentes sexos y edades hacen suponer que la trama comunicativa de estas emisiones es mucho mayor, como mayor es la dificultad en su estudio debido a su escasa sonoridad y la dificultad de acercamiento a estos individuos. Territorialismo Habitualmente ha sido descrito el territorio como el terreno defendido por los machos en momentos previos al celo (hasta meses) y que abandonará con la conclusión de este periodo. El caso extremo en estos territorios, tanto en lo que se refiere al menor tiempo como a espacio registrado, fue estudiado en Dinamarca. En esta población se describieron territorios que casi se ceñían a la época de celo y que no albergaban una superficie en torno a la hectárea de superficie defendida (Strandgaard, 1972). En el norte de la península ibérica ha sido descrita una territorialidad estacional (Costa, 1992), pero en las poblaciones centrales la territorialidad se observa como un comportamiento permanente, en donde los machos defienden una superficie a lo largo de todo el año. También ha sido descrito territorialismo en hembras a lo largo de todo el año (Mateos-Quesada, 2002). ¿Porqué tanta diferencia respecto a otras poblaciones, incluso ibéricas? No debemos olvidar que en el norte peninsular esta territorialidad ha sido también descrita coincidiendo con los meses de verano (Costa, 1992). Partamos del hecho de que definir y defender un territorio de otros congéneres, darle a conocer y conseguir que ninguno de los rivales penetren en él, no es una tarea que exija poco esfuerzo. Una vez conseguido este propósito, la inversión para el mantenimiento de este territorio hasta la nueva época de celo quizá no sea muy elevada y quizá compense que cada macho territorial, mantenga su territorio más allá del fin del periodo de celo. Existe además un elemento que refuerza esta idea en el corzo ibérico. Han sido encontradas y descritas zonas centrales de cada territorio de machos, en los que la vegetación arbustiva ha sido casi eliminada, existe una gran cantidad de marcas del macho territorial y tienen el propósito de servir de super-marca identificatoria, sobre todo a las hembras durante la época de celo (Carranza y Mateos-Quesada, 2001). Estos lugares llamados pelaos, a diferencia de otros marcajes de menor entidad, son realizados con un enorme costo e incluso su definición puede llevarse a cabo a lo largo de varios años. Con este valor dentro de su superficie, a un macho territorial le interesa aún menos abandonar su territorio y albergar así la posibilidad de que en nuevas estaciones territoriales pudiera perder ese valor. Si es capaz con un mínimo esfuerzo de mantener su territorio y su pelao íntegro durante el periodo interreproductivo, es posible que el corzo ibérico opte por esta segunda vía, como así parece ser a tenor de lo observado. Existe además otra ventaja añadida, esta vez compartida por machos y hembras, a la hora de mantener una defensa permanente de sus territorios: si los individuos se dispersan en el espacio debido al efecto territorial, la densidad bajará y la zona será poco apetente por aquellos predadores naturales del corzo, sobre todo en lo que se refiere al lobo (Tinbergen et al., 1967). A pesar de que ahora mismo donde se llevó este estudio en sierras de Extremadura falta el lobo desde hace cuarenta años, la memoria genética donde se fija la conducta innata de la especie, no ha podido cambiar en tan reducido espacio de tiempo, y esto se comprueba al observar otras conductas antidepredatorias en esta población (Mateos-Quesada, 2002). A pesar de estos argumentos, ¿qué sucede en estas sierras que no pueda suceder en las montañas leonesas, donde no ha sido encontrado un comportamiento territorial anual?. Existe una diferencia de peso: en las poblaciones cantábricas la latitud y el frío obliga a los individuos a hacer desplazamientos verticales y a bajar en invierno a zonas menos frías, por lo que el mantenimiento territorial a lo largo del año, es imposible. Los individuos de zonas donde la nieve permanece buena parte del año deben abandonar forzosamente sus territorios, y los de abajo, deben resignarse y recibir a aquellos que proceden de estas áreas. Esta circunstancia no se da en la población extremeña, ya que las poblaciones residen en sierras de altitud media, la nieve aparece de manera muy ocasional, y por tanto son aptas para que los individuos residan en sus emplazamientos habituales sin necesidad de desplazamientos estacionales. En cualquier caso, los machos accederán a un territorio que marcarán y defenderán de otros machos. En el caso de contacto entre machos rivales, existe todo un complejo y particular protocolo de disuasión entre ellos para medir las fuerzas y evitar la lucha: saltos cabriolas, juegos de equilibrio y llamativos movimientos con la cabeza, forman parte de este protocolo que tiene como fin medirse y evitar las luchas (Goss, 1983). Las luchas entre rivales suelen ser cruentas debido a la escasa ramificación de su cuerna y a pesar de consistir éstas en empujones una vez trabados por las astas. La marcación de los territorios es permanente, pero puede comenzar a ser más intensa en los meses de enero a marzo, una vez que tuvo su mayor descenso en el mes de octubre. Que los machos marquen cuando su cuerna aún no está formada y defiendan sus territorios de rivales cuando aún no está concluido el desarrollo de su cuerna, debe ser motivo para explicar las numerosas deformaciones encontradas en las cuernas de los machos adultos (Mateos-Quesada, datos no publicados). El tamaño de los territorios estará relacionado con las condiciones del lugar, de tal forma que en ese espacio pueda alcanzar el individuo todas sus exigencias biológicas. Por otra parte, también estará influenciado por la cantidad de individuos presentes en la zona. En áreas de colonización los espacios excluyentes podrán ser más amplios que en esas mismas zonas con densidad mayor. En el centro peninsular han sido registradas áreas territoriales medias de 35 ha (n= 24) para los machos y de 25 ha (n= 50) para las hembras (Mateos-Quesada, 1998). En estas últimas existe una mayor tolerancia debido a que las relaciones entre vecinas pueden llegar a ser también de parentesco, y porque los machos con los que solapan, hacen la mayor parte del esfuerzo a la hora de eliminar a aquellos individuos sin territorio. Entre hembras no existen luchas y las relaciones de dominancia se establecen únicamente con gestos y amenazas. Esta última exposición aleja la causa de albergar hembras por parte del macho, como motivo de la territorialidad: los territorios de hembras y machos no solapan, sino que se distribuyen sin concierto entre ellos por toda la superficie (Mateos-Quesada, 1998). Este comportamiento, en suma, difiere de manera notable a los pequeños territorios defendidos durante poco tiempo en las poblaciones estudiadas en Dinamarca. Este aspecto viene a demostrar de nuevo, la capacidad de la especie para acoplar su comportamiento al hábitat que ocupa: desde llanuras de cereal de Centroeuropa, hasta el bosque mediterráneo ibérico (Maublanc et al., 1985). Marcaje Como especie de hábitat boscosos y derivada de la necesidad que tienen los individuos de comunicarse entre sí, el corzo ha desarrollado un complejo sistema de marcaje en el que cabe la posibilidad de comunicar desde varios puntos a la vez sin estar en ninguno de ellos. Este sistema de marcaje se basa fundamentalmente en olores y marcas visuales, y en menor medida en señales sonoras (Jarman, 1974; Kurt, 1968; Bobek, 1977). En estos trabajos fueron descritas tres tipos de marcas en todas las poblaciones estudiadas (Johansson et al., 1995). En el centro peninsular fueron descritas hasta seis tipos de marcas (Mateos-Quesada, 1997). Sobre ramas de pequeño grosor (media = 1,25 ± 0,89 cm DS; n = 74) se ha encontrado el descortezado y el raspado, consideradas ambas como marcas visuales. En el descortezado la eliminación de la corteza es total o casi total a lo largo del perímetro del soporte en tanto que el raspado daña únicamente un frente del perímetro y de manera poco intensa lo general leve. El arañado se produce sobre troncos de árboles y lejos de pelar la corteza en su perímetro, se producen unas incisiones lineales en uno de los frentes del perímetro con mayor o menor abundancia; aparentemente la intención del corso es la de marcar con la glándula frontal y estos arañazos más parecen fruto el propio grosor del árbol, que de la intencionalidad del animal. El frotado se produce cuando un macho roza la frente pero no la cuerna sobre un soporte vertical; el objeto de esta conducta es impregnar un soporte con la hormona producida por al glándula ubicada en la frente del individuo. Estos frotados pueden localizarse visualmente cuando un macho marca repetidamente en el mismo lugar, lo que provoca un ennegrecimiento de esa zona o una eliminación de la capa de liquen que recubre la corteza; también puede localizarse esa marca por los pelos que los individuos suelen dejar en las cortezas. Estas dos marcas, pueden encuadrarse en lo que se ha llegado a considerar como marcas químicas. El escarbado, es una eliminación somera de una capa de tierra por medio de las patas delanteras. El comido consiste en la eliminación total o casi total de las hojas de arbustos de pequeño porte y muy ramificadas. No debe confundirse con el ramoneo, pues cuando el corzo come, lo hace a la vez que anda y el daño es menor (5,41% ± 5,45 DS del total de hojas comidas; n = 56) y cuando se trata de la marca comido, la eliminación alcanza al 92,1% (± 0,57 DS; n = 18) del total de las hojas. El comido no se trata de una marca en sí, ya que no deja percepción olfativa ni visual; como veremos más adelante, la misión de esta marca será favorecer la visibilidad de las marcas visuales (descortezado y raspado) y resulta fundamental en la constitución de los pelaos. La marca comido se encuentra sobre arbustos muy ramificados y de escaso diámetro, a diferencia de los descortezados o raspados, que se encuentran en arbustos de escasa ramificación y mayor diámetro (Tabla 1).
Tabla 1. Diferencia en el número de ramas, altura y grosor de los arbustos utilizados para las marcas descortezado y raspado, y comido (Media ± DS). Según Mateos-Quesada (1998).
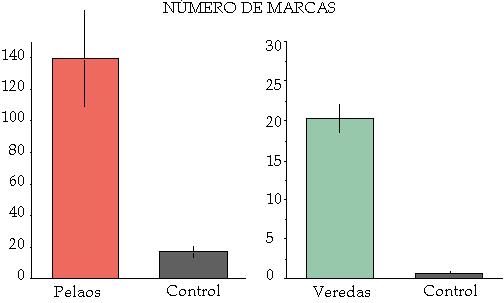
Localización y frecuencia de las marcas La búsqueda de marcas por el bosque muestra que ni todas las marcas se encuentran por igual, ni se encuentran en los mismos lugares. Parece entonces, que el corzo elige determinados lugares para poner unas u otras marcas y con mayor o menor frecuencia, hecho que se traduce en una función implícita de cada una de las marcas. En plantaciones, el corzo selecciona árboles pequeños situados en pequeños claros del interior y evita los árboles con matorrales (Ramos et al., 2006)2. Ya han sido descrito anteriormente los pelaos como superficies centradas en los territorios de cada macho donde existe una gran abundancia de marcas hasta el punto de eliminar buena parte de la vegetación existente. Estos pelaos tienen unas dimensiones medias de 2.668 m2 (± 1.808,84 m2 DS; n = 9) y en términos superficiales, albergan una significativa mayor cantidad de marcas que en superfices de dimensiones similares (Carranza y Mateos-Quesada, 2001). Otro lugar en la que la abundancia de marcas es manifiesta, se localiza en las veredas utilizadas por los individuos en sus desplazamientos por el bosque, radiando de los pelaos, en torno a los límites territoriales o conectando unos con otros. También aquí es notable la diferencia entre el número de marcas de una vereda, con un tramo similar en otro punto del bosque (Figura 1). Figura 1. Número medio de marcas en pelaos y veredas comparadas con áreas o recorridos de similares características (control). Según Mateos-Quesada (1998).
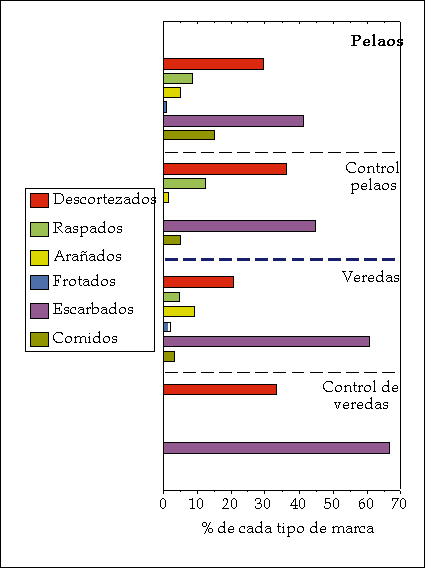
Abundancia de marcas Descritos estos tres lugares en los que existen diferencias en la cantidad de marcas aparecidas (pelaos, veredas, resto del bosque), cabe preguntarse si las diferentes marcas aparecen con la misma frecuencia en cada uno de ellos. La Figura 2 muestra que existen lugares en los que un corzo tiene preferencia por uno u otro tipo de marcas; dicho de otra manera, según el lugar en el que se encuentre el macho territorial, marcará con mayor o menor intensidad, y además dejará un tipo con preferencia ante otros.
Figura 2. Abundancia de cada tipo de marca en pelaos, veredas y sus respectivos controles. Según Mateos-Quesada (1998).
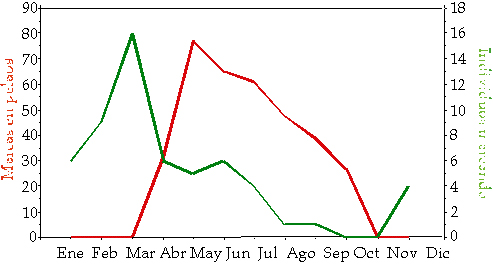
Tiempo de marcas Anteriormente pudimos ver que la territorialidad en el centro peninsular es anual, y teniendo en cuenta que el marcaje es un comportamiento relacionado con la territorialidad ¿es anual también la conducta de marcaje en el corzo? Efectivamente, así la podemos considerar, sin olvidar que buena parte de las marcas son realizadas con la cuerna, y el corzo carece de cuerna funcional durante al menos tres meses al año. Además, podemos hacer una distinción entre la aparición de marcas por el territorio del corzo y la aparición de marcas dentro del pelao de cada territorio. En este sentido, el marcaje por lugares ajenos a los pelaos tiene un momento de máxima actividad en el mes de marzo y un mínimo en el de octubre (Figura 3). El marcaje en los pelaos comienza en el mes de abril y finaliza en septiembre una vez concluido el celo y momentos previos a la caída de la cuerna, siendo inexistente en el resto del año.
Figura 3. Tiempo en el que el corzo marca en el interior del pelao (en rojo) y en el resto del territorio (en verde). Según Mateos-Quesada (1998).
Función del comportamiento de marcaje ¿Qué significado tienen todas estas marcas de manera individual y el conjunto de marcaje como sistema? Existen marcas cuya capacidad de identificar al individuo que las dejó es nula, como en el caso del descortezado, raspado y escarbado. Sin embargo estas marcas pueden indicar donde existe una marca química, que sí habla de las propiedades del individuo que las dejó pero que son difícilmente localizables (arañados y frotados): el corzo entonces para dejar un mensaje específico utiliza una marca química, y cercano a ella, una o dos visuales que sirvan para que no pase desapercibida a un posible receptor. Si acaso las señales visuales asociadas a esta marca olfativa pueden ocultarse por la vegetación de su alrededor, el corzo puede favorecer esta visibilidad mediante el uso de la marca comido. Tanto esta marca comido, como el propio descortezado (el descortezado completo de un vástago provoca la muerte y el secado de éste), tienen la capacidad de eliminar buena parte de la cobertura espacial que ofrece un arbusto de talla mediana o pequeña. Es tal la efectividad, que pueden desnudar completamente la vegetación arbustiva en un espacio donde antes existía una cobertura de matorral superior al 90% de la superficie. Existe un primer marcaje fuera de los pelaos y dispersos por el territorio. Este momento coincide con la redefinición de los territorios de machos y el aumento de las expulsiones y las agresiones entre estos. Parece evidente que este marcaje iría dirigido a los propios machos con el fin de comunicarles que el territorio donde está tiene dueño y quien es este. Para el objetivo de expulsar a otros machos y evidenciar su propiedad sobre cierto territorio, el macho también se ayuda de sonidos roncos y profundos audibles en una amplia superficie de terreno (ver apartado sobre la voz). Coincide además este momento, con la separación de las crías de un año de sus madres, lo que hace abundar el número de individuos deambulantes por territorios ajenos y por tanto debe existir por parte del macho un mayor empeño en la tarea de eliminar competidores. Y en el corzo existe un hecho probado: a mayor agresividad, mayor intensidad de marcaje. Un segundo marcaje estaría centrado en los pelaos, en abril, coincidiendo con el momento en que el territorio está libre de intrusos y decrece el marcaje por diferentes puntos del territorio. Ahora surge un marcaje centrado en los pelaos y, sabiendo que el territorio está libre de machos rivales y sólo las hembras adultas coinciden en ese espacio, forzosamente el mensaje que alberga este marcaje debe ir dirigido a ellas. Ubicados además en el centro del territorio, hace aún más improbable que un macho rival acceda a este mensaje. Estos pelaos y el mensaje contenido en ellos hablan de las cualidades del macho a las posibles hembras que solapan con su territorio: la limpieza de este y su amplitud, podrían ser señales que estuvieran relacionadas directamente con las propias cualidades físicas del macho propietario así como de su capacidad como reproductor.
Referencias Acevedo, P., Delibes-Mateos, M., Escudero, M. A., Vicente, J., Marco, J., Gortázar, C. (2005). Environmental constraints in the colonization sequence of roe deer (Capreolus capreolus Linnaeus, 1758) across the Iberian Mountains, Spain. Journal of Biogeography, 32 (9): 1671-1680. Aragón, S. (1993). El Corzo (Capreolus capreolus) en Cádiz. Caracterización y encuadre de sus poblaciones en el conjunto de la especie. Tesis Doctoral. Universidad de Sevilla. Bideau, E., Vicent, J. P., Quere, J. P., Angibault, J. M. (1983a). Occupation de lèspace chez le chevreuil (Capreolus capreolus L., 1789). Cas de mâles. Oecol. Applic., 4 (2): 163-184. Bobek, B. (1977). Summer food as the factor limiting roe deer population size. Nature, 268: 47-49. Carvalho, P., Nogueira, A. J. A., Soares, A. M. V. M., Fonseca, C. (2008). Ranging behaviour of translocated roe deer in a Mediterranean habitat: seasonal and altitudinal influences on home range size and patterns of range use. Mammalia, 72 (2): 89-94. Carranza, J., Mateos-Quesada, P. (2001). Habitat modification when scent marking: shrub clearance by roe deer bucks. Oecologia, 126: 231-238. Costa, L. (1992). Ecología del corzo en las montañas cantábricas. Modelo de gestión. Tesis doctoral. Facultad de Biología. Universidad de León. Danilkin, A. (1996). Behavioural ecology of Siberian and European roe deer. Chapman y Hall, London. Davies, N. B., Houston, A. I. (1984). Territory economics. Pp. 148-169. En: Krebs, J. R., Davies, N. B. (Eds.). Behavioural Ecology An Evolutionary Approach. Blackwell Scientific Publications, Oxford. Delibes, J. R. (1996). Ecología y comportamiento del corzo (Capreolus capreolus L. 1758) en la sierra de Grazalema (Cádiz). Tesis Doctoral. Universidad Complutense, Madrid. Goss, R. J. (1983). Deer antlers. Regeneration, function and evolution. Academic Press, New York. Jarman, P. J. (1974). The social organisation of antelope in relation to their ecology. Behav., 48: 215-267. Johansson, A., Liberg, O., Wahlström, L. K. (1995). Temporal and physical characteristics of scraping and rubbing in roe deer (Capreolus capreolus). J. Mamm., 76: 123-129. Kurt, F. (1968). Zusammenhange zwischen Verhalten und Fortplanzungssleitung beim reh (Capreolus capreolus L.) Z. fur Jagdwiss., 14 (3): 97-106. Kurt, F. (1990). Roe deer (Genus Capreolus). Grzimek´s Encyclopedia of Mammals. Mc Graw-Hill. 5: 200-212. Mateos-Quesada, P. (1997). Marcaje territorial del Corzo (Capreolus capreolus) en la sierra de Las Villuercas. Universidad de Extremadura, Cáceres. Mateos-Quesada, P. (1998). Parámetros poblacionales y sistema de apareamiento del corzo en las Villuercas. Tesis Doctoral. Universidad de Extremadura, Cáceres. Mateos-Quesada, P. (2002). Biología y comportamiento del corzo ibérico. Servicio de Publicaciones de la Universidad de Extremadura, Cáceres. Maublanc, M. L., Bideau, E., Vicent, J. P. (1985). Données préliminaires sur la tendance grégarie chez le chevreuil (Capreolus capreolus L.) en milieu ouvert, durant l'automne et l'hiver; comparaison avec le milieu forestier. Mammalia, 49 (1): 3-11. Perco, F., Perco, D. (1979). Il capriolo. Carso, Sgonico. Ramos, J. A., Bugalho, M. N., Cortez, P., Iason, G. R. (2006). Selection of trees for rubbing by red and roe deer in forest plantations. Forest Ecology and Management, 222 (1-3): 39-45. Strandgaard, H. (1972). The roe deer (Capreolus capreolus) population at Kalo and the factors regulating its size. Danish Review of Game Biology, 7: 1-205. Tinbergen, N., Impeckoven, M., Franck, D. (1967). An experiment on spacing out as a defense against predation. Behaviour, 28: 307-321. Vicent, J. P., Bideau, E., Quere, J. P., Angibault, J. M. (1983). Occupation de l'espace chez le chevreuil (Capreolus capreolus L., 1789). Cas de femelles. Oecol. Applic., 4 (4): 379-389. Vicent, J.P., Janeau, G., Quere, J.P., Spitz, F. (1979). Note sur la repartition et le rythme d'activitè du chevreuil (Capreolus capreolus) en fôret ouverte. Ann. Zool. Ecol. Anim., 11 (2):145-157.
Patricio Mateos-Quesada Fecha de publicación: 4-04-2005 Otras contribuciones: 1. Alfredo Salvador. 3-04-2007.2. Alfredo Salvador. 28-01-2011 Mateos-Quesada, P. (2017). Corzo - Capreolus capreolus. En: Enciclopedia Virtual de los Vertebrados Españoles. Salvador, A., Barja. I. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
|
|||||||||||||||
|
|
||||||||||||||||
|
|
||||||||||||||||