|
|
|
|
|
|
Para más información sobre cada apartado hacer click en:
|
Key words: Roe deer, reproduction, population structure.
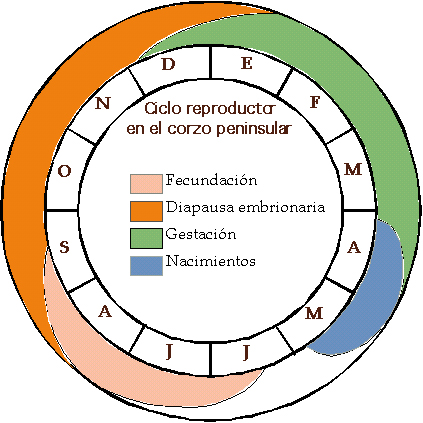
Biología de la reproducción En la Figura 1 podemos apreciar el ciclo reproductor anual en las poblaciones centrales ibéricas; la capacidad de adaptación de la especie hace sin embargo, que tanto la duración como el momento del comienzo y final de cada uno de los momentos del ciclo en la península Ibérica varíen con respecto a otras poblaciones europeas. Se han observado menores niveles de estrés en correlación con una mejor condición fuera de la estación de reproducción, pero no con una mayor productividad primaria. Por el contrario, los niveles de estrés se correlacionaron positivamente con la condición reproductiva, que fue mejor en los hábitats más productivos. En invierno, la condición reproductiva estuvo compensada frente a la condición inmune, estando desviada hacia la función inmune en hábitats menos productivos. En verano, la reducida productividad primaria limitó la condición nutricional e inmunológica pero no la condición reproductiva (Escribano-Ávila et al., 2013)2.
Figura 1. Esquema del ciclo reproductor de las poblaciones centrales ibéricas. Según Mateos-Quesada (1998).
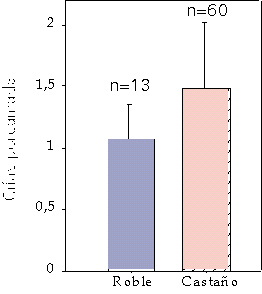
En primer lugar, tanto el momento como la duración de la época de celo, puede variar a lo largo de toda su área de distribución. Parece lógico suponer, como así es, que cuanto mayor tiempo exista para ubicar el momento de gravidez, menor sincronización habrá, al contrario de lo que sucede cuando el tiempo de ubicar el celo es menor (Mateos-Quesada, 1998). Fruto de este razonamiento tenemos en la península ibérica el celo más dilatado descrito en toda su área de distribución. Si lo habitual es que el celo se establezca en torno a veinte días sobre el centro del mes de agosto en poblaciones centroeuropeas, podemos encontrar un celo de algo más de dos meses de amplitud sobre el mes de julio en el centro peninsular. Una primavera y un verano prolongados respecto a otros lugares, permiten esta distensión, y de nuevo el corzo nos muestra su flexibilidad comportamental, para optimizar su situación respecto al medio que ocupa (Mateos-Quesada, 1998). En las poblaciones de Cádiz y Málaga, el celo tiene lugar en la primera quincena de julio y los nacimientos tienen un máximo entre mediados de abril y mediados de mayo (Braza et al., 1998). Ha sido descrito en numerosos estudios la monogamia como base en su sistema reproductivo. Ha sido observado en Dinamarca por Strandgaard en 1972, desarrollos de celo en los que más podíamos hablar de un sistema poligínico que de monogamia: los territorios eran establecidos en un estrecho terreno, eran de dimensiones reducidas y unos pocos machos cubrían a las hembras que acudían a ese lugar. Realmente existía una diferencia entre los machos que más y los que menos hembras cubrían. Si volvemos al caso peninsular, hemos de considerar territorios amplios que se conservan durante un considerable periodo de tiempo y densidades de población bajas. Si además consideramos que cada macho suele estar acompañado de una hembra, parece que se dan, como así es, las condiciones para la monogamia. Cierto es que en aquellas poblaciones cuya densidad de hembras es mayor que la de machos, todas quedan cubiertas y parirán a la primavera siguiente, pero no por ello existe una diferencia significativa entre los machos de mayor y menor éxito dentro de los que tienen opciones a cubrir, por lo que se mantiene el argumento de que estas poblaciones son monógamas y existe una monogamia obligada (Mateos-Quesada, 1998). En el cortejo, el macho persigue de manera rápida e insistente a la hembra a lo largo del bosque. Si estas carreras se centran en torno a un obstáculo o giran sobre sí mismos, quedarán plasmados en el terreno sendas en forma de ocho o de círculos llamados corros de brujas. Los machos con mayor variabilidad genética tienen mejor condición física (medida como residuos de la regresión de peso sobre talla) (Ruiz et al., 2007).1 Pocos días después de la cópula, la hembra inicia un proceso denominado diapausa embrionaria o implantación diferida, que consiste en la ralentización del mismo proceso de gravidez, muy similar a una suspensión de la propia gestación (Short y Hay, 1964). Si no se diese este fenómeno en las hembras de corzo, los corcinos nacerían en pleno invierno, con fríos extremos y una reducción importante de lo nutrientes, lo que les llevaría a una posible muerte. La reanudación de la gestación en términos normales, comenzará para las corzas ibéricas en diciembre-enero, por lo que cada hembra parirá en los meses de abril-mayo una, dos o más raramente tres crías. Las crías nacen desvalidas y durante los primeros días esperan ocultas entre la vegetación la llegada de la madre para alimentarse y ser aseadas. El número de crías oscila entre uno y más raramente tres, siendo la media de 1,46 crías por hembra parida en los montes de Las Villuercas (± 0,503; n = 62) (Mateos-Quesada y Carranza, 2000). Cuando el hábitat en el que se han desarrollado durante la gestación es de menor calidad en términos de supervivencia para el corzo (depredadores, alimentación, agua...) la media de nacimientos poblacional baja, comparado con aquellos lugares en donde la calidad del medio es mejor (Rieck, 1955; Mateos-Quesada y Carranza, 1991) (figura 2).
Figura 2. Número medio de crías observadas en camadas de menor calidad trófica (roble) comparada con aquellas de medios más favorables (castaño). Según Mateos-Quesada y Carranza (2000).
A este respecto también podemos encontrar diferencias en el sexo de los individuos nacidos según el hábitat ocupado por la madre (Mateos-Quesada y Carranza, 2000); cuando el ambiente es precario existe una mayor tendencia en el nacimiento de crías hembras (64,29% de crías hembras frente al 35,71% de machos) encontrando una tendencia similar cuando las condiciones son más favorables para la especie (54,04% de crías hembras; 45,95% de machos) Esta idea concuerda por lo postulado por Williams, 1979, Clark (1978) y Silk (1983) y que aboga por una mayor proporción de nacimientos de aquel sexo cuya variación en el éxito reproductivo es mayor, en ambientes favorables, en detrimento de aquel sexo con menor o sin variación en el éxito reproductivo. No parece necesaria la intervención del macho en el desarrollo y destete de las crías, ya que las hembras que no tienen un macho formando parte del grupo familiar, obtienen un éxito reproductor similar a aquellas que se ven continuamente acompañadas por un compañero. A pesar de ello y a diferencia de otros ungulados ibéricos, durante los momentos en los que el macho forma parte del grupo familiar, invierte en el grupo adquiriendo un papel destacado a la hora de asumir riesgos (Mateos-Quesada, 2002). Cuando los recentales son capaces de seguir a la madre permanecerán junto a ella de manera constante hasta que sean expulsadas de su lado, un año a lo máximo en las poblaciones ibéricas y coincidiendo con la nueva paridera. En todo caso, habrá crías que podrán ser expulsadas a partir del séptimo mes de su nacimiento: el momento de la expulsión podrá ser anterior en aquellas camadas formadas por dos hermanos y menor en aquellas crías hembras que nacieron solas. Las crías, una vez expulsadas del lado de la madre vagarán deambulando hasta ocupar un emplazamiento, que podrá ser de un año en el caso de la hembra, o al menos tres en el caso de los machos. En este periodo de movimientos podrán incluso asentarse en lugares de reducidas condiciones (incluso de 2.000 m2) ocultos a la presencia de los adultos, pudiendo permanecer en ellos hasta varios meses siempre que las condiciones alimenticias estén cubiertas.
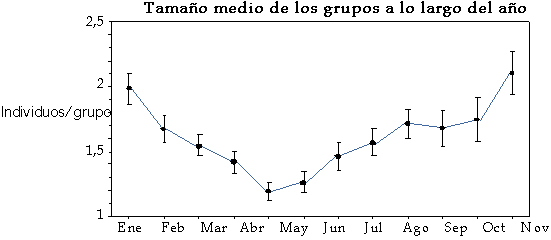
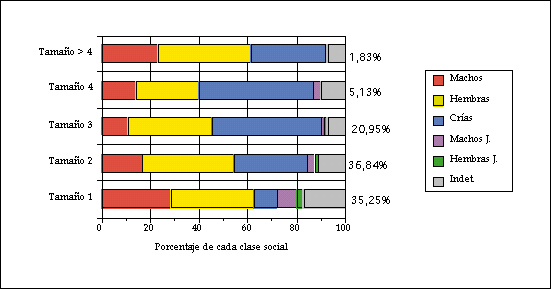
Tamaño de grupo Los estudios realizados en el contexto ibérico vienen a coincidir, salvo en leves desplazamientos de fecha debidas a la latitud, al esquema general que a continuación se reseña (Costa y Purroy, 1991; Costa, 1992; Aragón, 1993; Mateos-Quesada, 1998) (Figuras 3 y 4).
Figura 3. Tamaño medio de los grupos en el corzo en la población de Las Villuercas, centro-oeste de la península ibérica. Según Mateos-Quesada (1998).
Figura 4. Proporción de clases de edad y sexo en los componentes de cada tamaño de grupo en Las Villuercas (Cáceres). Según Mateos-Quesada (1998).
Si nos referimos en un primer momento al grupo familiar (hembras y crías), este se origina en el momento de la paridera en abril-mayo, con el nacimiento de los corcinos. Permanecerá unido hasta el destete de las crías y la expulsión de éstos del lado de la madre; los más tardíos serán expulsados momentos previos a la nueva paridera, pero desde octubre están siendo separadas las crías de las madres. Las camadas más tempranas en el momento de la separación de la madre, serán las formadas por dos hermanos; las más tardías y que podrán permanecer al lado de la madre hasta la nueva paridera, serán las formadas por una sola cría hembra. Es razonable pensar que existirán grupos formados por individuos juveniles erráticos, que comenzarán a ser vistos en octubre pero que cobran una especial importancia a partir de abril, con la llegada de la nueva paridera y las expulsiones masivas. A partir de este momento estos grupos se van diluyendo debido a la dispersión por nuevas áreas y la consolidación de nuevos territorios por parte de sus integrantes. Este es el único momento de ver a varios machos juntos, pues desde el momento en el que cumplen dos años de vida, es muy difícil ver a machos agrupados a otros congéneres del mismo sexo. ¿Cómo participa el macho territorial en el grupo familiar descrito en el párrafo anterior? Como es de suponer, durante el celo el macho establecerá contacto con la hembra; en estas horas, las crías suelen ser vistas sin la presencia de la madre, ya que esta se encuentra inmersa en el protocolo adscrito al celo (Mateos-Quesada, 2002). De manera general y salvo estos momentos en los que el macho se encuentra junto a la hembra, durante todo el celo el macho deambula en busca de hembras a las que cubrir e interceptando a posibles intrusos territoriales, siempre solo. Una vez pasada la época de cubriciones, el macho puede formar de una manera permanente parte con el grupo familiar: será parte activa de este grupo e invertirá en su propia seguridad. En estos momentos es cuando podemos llegar a encontrar grupos de cuatro individuos (hembra, dos crías y un macho), los de mayor tamaño de manera permanente que podemos encontrar en nuestros bosques ibéricos. Con el comienzo del remarcado intenso del territorio del macho, éste procederá a esta labor en solitario y de nuevo el grupo quedará formado por la hembra y sus crías.
Estructura y dinámica de poblaciones Hay pocos datos ibéricos. Los individuos son fértiles a los catorce meses de vida. En este momento es posible que las hembras queden cubiertas, pero debido al sistema territorial, los machos que alcancen esta edad deberán esperar hasta la posesión de su propio territorio para poder acceder a alguna hembra (Strandgaard, 1972). La esperanza de vida en las hembras es mayor que en los machos, debido no sólo a cuestiones ligadas con la propia biología de la especie, sino a la presión cinegética a la que los machos se ven sometidos. Si la esperanza media de vida se encuentra sobre los doce años, la encontrada en los machos del centro peninsular no supera los 3-4 años; las hembras por su parte superan ampliamente esta media e incluso han sido encontradas con edades de hasta 19 años (Mateos-Quesada, 1998). En una muestra de la sierra de Guadarrama (n= 154), la edad varió entre uno y 93 meses, con un valor medio de 34,3 meses (Horcajada-Sánchez y Barja, 2016)2. Corzos soltados en ambientes mediterráneos tuvieron una tasa de mortalidad del 12% (Rosell et al., 1996).2 La probabilidad media de supervivencia en individuos soltados en un hábitat mediterráneo de Tarragona fue de 0,72 y un tiempo medio de supervivencia de 285 días (López-Martín et al., 2009)2.
Referencias Aragón, S. (1993). El Corzo (Capreolus capreolus) en Cádiz. Caracterización y encuadre de sus poblaciones en el conjunto de la especie. Tesis Doctoral. Universidad de Sevilla. Bateman, A. J. (1948). Intra-sexual selection in Drosophila. Heredity, 2: 349-368. Braza, F., San José, C., Aragón, S., Delibes, J. R. (1998). La reproducción del corzo morisco. Revista de la Sociedad Gaditana de Historia Natural, 1: 11-15. Brown, J. L., Orians, G. H. (1970). Spacing patterns in mobile animals. Annual Review of Ecology and Sistematics, 1: 239-262. Clark, A. B. (1978). Sex ratio and local resource competition in a prosimian primate. Science, 201: 163-165. Costa, L. (1992). Ecología del corzo en las montañas cantábricas. Modelo de gestión. Tesis doctoral. Facultad de Biología. Universidad de León. Costa, L., Purroy, F. J. (1991). Demographic aspects of a population of roe deer in the Cantabrian Mountains of northern Spain. Pp. 551-554. En: Bobek, B., Perzanowski, K., Regelin, W. L. (Eds.). Global trends in wildlife management. Transactions Vol. 1. 18th IUGB Congress, Jagellonian University, Krakow. Davies, N. B. (1985). Cooperation and conflict among dunnocks Prunella modularis in a variable mating system. Anim. Behav., 33: 628-648. Escribano-Ávila, G., Pettorelli, N., Virgós, E., Lara-Romero, C., Lozano, J., Barja, I., Cuadra, F. S., Puerta, M. (2013). Testing Cort-Fitness and Cort-Adaptation hypotheses in a habitat suitability gradient for roe deer. Acta Oecologica, 53: 38-48. Horcajada-Sánchez, F., Barja, I. (2016). Local ecotypes of roe deer populations (Capreolus capreolus L.) in relation to morphometric features and fur colouration in the centre of the Iberian Peninsula. Polish Journal of Ecology, 64 (1): 113-124. Mateos-Quesada, P. (1998). Parámetros poblacionales y sistema de apareamiento del corzo en las Villuercas. Tesis Doctoral. Facultad de Veterinaria. Universidad de Extremadura. Cáceres. Mateos-Quesada, P. (2002). Biología y comportamiento del corzo ibérico. Servicio de Publicaciones de la Universidad de Extremadura, Cáceres. Mateos-Quesada, P., Carranza, J. (2000). Reproductive patterns of roe deer in central Spain. Etología, 8: 9-12. Rieck, W. (1955). Diesetzeit bei reh, rot und damwild in mittleeuropa. Z. für Jadwwiss., 1: 69-75. Rosell, C., Carretero, M. A., Cahill, S., Pasquina, A. (1996). Seguimiento de una reintroducción de corzo (Capreolus capreolus) en ambiente mediterráneo. Doñana, Acta Vertebrata, 23: 109-122. Ruiz, M. J., Roldán, E. R. S., Rey, I., Malo, A. F., Gomendio, M. (2007). Genetic variability influences physical condition in male roe deer. Galemys, 19 (Número especial): 159-168. Short, R. V., Hay, M. F. (1964). Delayed implantation in roe deer. Reprod. Fertil., 9: 373. Silk, J. B. (1983). Local resource competition and facultative adjustment of sex ratios in relation to competitive abilities. Am. Nat., 121: 56-66. Strandgaard, H. (1972). The roe deer (Capreolus capreolus) population at Kalo and the factors regulating its size. Danish Review of Game Biology, 7: 1-205. Williams, G. C. (1979). The cuestion of adaptive sex ratio in outcrossed vertebrates. Proc. R. Soc. Lond. B, 205: 567-580.
Patricio Mateos-Quesada Fecha de publicación: 4-04-2005 Otras contribuciones: 1. Alfredo Salvador. 8-08-2008; 2. Alfredo Salvador. 8-09-2017 Mateos-Quesada, P. (2017). Corzo - Capreolus capreolus. En: Enciclopedia Virtual de los Vertebrados Españoles. Salvador, A., Barja. I. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
|
|
|
|
|
|
|