|
|
|
|
|
|
Para más información sobre cada apartado hacer click en:
|
Key words: Kestrel, reproduction, clutch size, hatching asynchrony, brood sex-ratio.
Biología de la reproducción Establecimiento del territorio, cortejo y emparejamientoEl cernícalo vulgar empieza la temporada reproductora con la llegada de los individuos reproductores entre marzo y mayo dependiendo del área y de la climatología. Llegarían antes a lugares más sureños y adelantan su llegada con condiciones climatológicas invernales más benignas. Machos y hembras, al menos en Reino Unido (Village, 1990), llegarían en igual número. No obstante, si las poblaciones son migradoras parciales, es común que los machos mantengan el territorio de cría durante todo el año y las hembras lleguen más tarde (Village, 1990, aunque ver movimientos para más detalle). Los machos en ese momento compiten por los territorios de cría y es frecuente verlos luchando y defendiendo agresivamente los territorios. De hecho, si en invierno los cernícalos prácticamente pasan desapercibidos, es a partir de este momento cuando se hace más patente su presencia con gritos, llamadas y peleas entre machos. Es complejo seguir el proceso completo de emparejamiento en esta especie y algunos autores sugieren la posibilidad que las hembras no seleccionen macho y se emparejen con el primer macho disponible (Village, 1990). Al menos, Village no encontró emparejamiento en relación al tamaño, es decir, que las hembras más grandes se emparejen con los machos de mayor tamaño. Al menos en el Sistema Central, sí parece existir una asociación positiva entre el tarso del macho y la hembras aunque este patrón no es corroborado por otras variables morfológicas como el tamaño del ala o de la cola, o incluso el peso (datos propios). Es probable que no lo sea en este sentido, pero existe una alta variabilidad fenotípica en diferentes caracteres en los machos de cernícalo, no sólo en tamaño, que podrían ser señales indicadoras de calidad para las hembras. El retraso en la maduración del plumaje en miembros jóvenes de parejas de cernícalo podría ser explicado por mimetismo con las hembras o como una señal de subordinación. En experimentos en los que se presentaron reclamos, los machos atacaron más a los reclamos de machos adultos que a los de hembras y machos de un año, tanto en tratamientos con individuos que han mudado como en los que no lo han hecho. Las hembras eran más agresivas hacia reclamos de machos de un año en individuos que no han mudado. En tratamientos con individuos que han mudado, las hembras eran más agresivas hacia reclamos de hembras en comparación con reclamos de machos adultos y de un año. Además, las hembras solicitaron cópulas de reclamos que habían mudado pero no de machos que no habían mudado. Estos resultados sugieren que la hipótesis del mimetismo con las hembras puede explicar el retraso en la maduración del plumaje en machos de un año que no han mudado, pero cuando han mudado, la hipótesis de señal de subordinación explica mejor el comportamiento sexual y agonístico de los adultos hacia los machos de un año (Vergara y Fargallo, 2007)3. Durante el emparejamiento, se podrían describir tres grupos de comportamientos: llamadas, exhibiciones (o displays) y pases de presas. Las llamadas, de acuerdo a Village (1990) y a Tinbergen (1940) mostrarían llamadas de alarma y llamadas ‘señal’. Las llamadas de alarma o de agresión las emplean cuando son molestados por otras especies incluidos los humanos. Es quizá la llamada más común y más familiar, más o menos como un “kee-kee-kee” o “kik-kik-kik”. Las llamadas ‘señal’ son más indicadoras de excitación o escaso peligro. Las hembras suelen hacerlas cuando reciben alimento del macho o bien cuando solicitan la cópula. También pueden hacerlas cuando inspeccionan el nido. En cualquier caso, todas las llamadas son variables en tiempo, intensidad y circunstancia, lo que hace difícil la correcta interpretación de una u otra llamada cuando se escucha en el campo. Por otro lado, existen otros indicadores sexuales secundarios que podrían indicar la calidad del macho. Por ejemplo, en cernícalos en cautividad, está descrito que las hembras parecen seleccionar machos más ornamentados o de plumaje más brillante lustroso (Palokangas et al., 1994). No obstante, no se conoce detalladamente el proceso de selección sexual en cernícalo en poblaciones silvestres, así como los indicadores que podrían ser claves en la selección de pareja. Por otro lado, como en la gran mayoría de las aves rapaces, el macho provee presas a la hembra durante el cortejo y que en el caso de establecerse el emparejamiento, esta alimentación se mantendrá hasta que los pollos tienen aproximadamente 15 semanas. Este comportamiento se ha descrito igualmente en otras rapaces, donde se sugiere que el aprovisionamiento de presas puede ser un indicador de calidad del macho (Mougeot et al., 2002). Las cópulas frecuentes o de larga duración podrían reducir las cópulas fuera de la pareja. Sin embargo, en un estudio realizado en Campo Azálvaro (centro peninsular) se observó que los machos que tenían puestas más grandes mostraron cópulas más cortas. Tampoco se observó relación entre frecuencia de cópula y calidad del macho (Vergara y Fargallo, 2008b)3. El comportamiento agresivo en ambos sexos antes de la puesta puede ser un indicador de calidad. En experimentos en los que se presentaron reclamos a cernícalos, el comportamiento agresivo de las hembras se correlacionó positivamente con el tamaño de puesta. En machos, el comportamiento agresivo fue menor durante el periodo fértil de las hembras que durante el periodo previo. Además, en las hembras pero no en los machos, el comportamiento agresivo aumentó con la densidad de reproductores (Vergara et al., 2007)3.
Figura 1. Hembra incubando. (C) J. Martínez-Padilla.
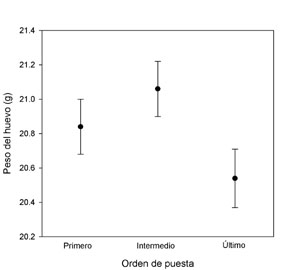
Puesta El tamaño medio de un huevo de cernícalo es de 31,78 ± 1,09 mm de ancho por 39,29 ± 1,64 mm de largo (n = 498; datos propios). El peso medio fresco (antes de iniciar la incubación) es de 20,9 ± 1,67 g (n = 498; datos propios). El peso de los huevos disminuye con el orden de puesta, aunque los primeros huevos son algo más pequeños que los huevos puestos en lugares intermedios (Figura 2).
Figura 2. Peso del huevo en relación con el orden de puesta (Según Martínez-Padilla, J., datos no publicados).
La expresión de la coloración del obispillo de las hembras está limitada ambientalmente y se correlaciona positivamente con el tamaño de puesta, por lo que podría ser un indicador de calidad (Vergara et al., 2009)3. El patrón general de puesta es de un huevo cada dos días, aunque este período es variable (Aparicio, 1994a) y puede estar relacionado con la abundancia de alimento. Así, cuando la abundancia de alimento es mayor, podría reducirse el intervalo de puesta (Aparicio, 1994a). El patrón general de variación del tamaño del huevo dependiendo del orden de puesta es variable, donde los primeros y los últimos huevos son más pequeños. No obstante, este patrón puede variar en función de dos factores. Por un lado, una mejor condición física de la hembra puede hacer incrementar el tamaño del primer huevo puesto (Aparicio, 1999). También existe dimorfismo sexual de los huevos de cernícalo vulgar, así los huevos que contienen embriones machos son mayores que las hembras (Blanco et al., 2003b). No obstante, este patrón puede variar entre años y cambiar en la misma población, así los huevos hembras en otros años pueden ser mayores que los huevos machos independientemente del orden de puesta (Martínez-Padilla, J. y Fargallo, J. A. en revisión). Tanto las consecuencias como el mecanismo que hace que las hembras cambien esta inversión en diferentes huevos dependiendo del sexo se desconocen por el momento. La coloración de los huevos es generalmente rojiza-terrosa con motas o puntos negros y viene determinada por la protoporfirina. No obstante, puede variar enormemente entre puestas, desde prácticamente blancos, hasta rojos sin apenas moteado. Igualmente, suele variar con el orden de puesta, siendo menos pigmentados los últimos huevos puestos (Figura 3). Esta pérdida de pigmentación entre los primeros y los últimos huevos puestos, sin embargo, puede ser más o menos acentuada entre puestas (Figura 3).
Figura 3. Coloración de huevos de cernícalo vulgar en relación con el orden de puesta (de izquierda a derecha). (C) J. Martínez-Padilla.
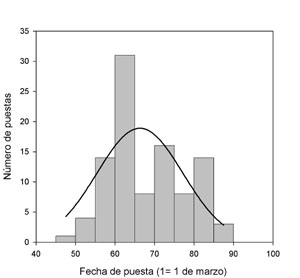
Las hembras de mayor edad y las que tienen el obispillo gris producen huevos más pigmentados. Sin embargo, las hembras que se emparejan con machos que poseen mejor condición ponen huevos muy pigmentados (Martínez-Padilla et al., 2010)3. La deposición de pigmentos en la cáscara de los huevos podría ser un mecanismo para resistir la penetración por patógenos al embrión. Sin embargo, un experimento en el que se manipuló la cantidad de protoporfirina y biliverdina de la cáscara, no encontró efectos negativos sobre el éxito de nacimiento, mortalidad de los pollos, condición física y respuesta inmune de los pollos y la probabilidad de reclutamiento (Fargallo et al., 2014)4. La fecha media de inicio de puesta en Europa es desde mediados de abril hasta mediados de mayo o incluso junio, estando las poblaciones del Sistema Central en este rango (Figura 4). No obstante, dependiendo de las características individuales, la fecha de puesta puede variar (Aparicio, 1998). Las segundas puestas son raras y probablemente dependientes de la abundancia de alimento (Fargallo et al., 1996).
Figura 4. Distribución del inicio de puesta en las poblaciones del Sistema Central durante 3 años de estudio (n = 100 puestas) (Según Martínez-Padilla, J., datos no publicados).
El tamaño medio de puesta puede variar desde los 3 huevos hasta los 7, siendo el tamaño medio de puesta de 4,75 ± 0,74 huevos y no parece variar con la latitud (Village, 1990). Lo que sí se ha descrito es la disminución del tamaño de puesta a medida que se retrasa su inicio (Aparicio, 1994b), donde los trabajos más recientes, sugieren que la abundancia de alimento es el factor fundamental que explica esta variación (Aparicio y Bonal, 2002). Además, son sutiles las variaciones en parámetros reproductivos dependiendo del hábitat (Avilés et al. 1991; Avilés et al. 2000). Incubación La realiza fundamentalmente la hembra, aunque los machos pueden cubrir los huevos, quizá para evitar pérdida de calor, durante cortos períodos de tiempo. Como en la gran mayoría de las aves, el cernícalo vulgar comienza la incubación antes de acabar la puesta, generalmente el día intermedio entre el antepenúltimo y el último huevo puesto, aunque este hecho varía según el tamaño de puesta, ya que puestas pequeñas (de 3 ó 4 huevos), suelen incubarse al final de la puesta. La consecuencia inmediata de iniciar la incubación antes de acabar la puesta es que los primeros huevos puestos se empiezan a desarrollar antes y por tanto, eclosionarán antes (Figura 5). No obstante, también se ha descrito para la especie que los huevos que contienen un embrión hembra eclosionan de media unas 12 horas antes que los huevos macho (Blanco et al., 2003a).
Figura 5. Eclosión asincrónica en cernícalo vulgar. (C) J. Martínez-Padilla.
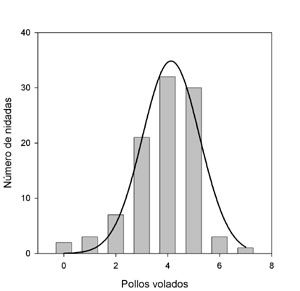
El comienzo de la incubación antes del final de la puesta impone la asincronía de nacimientos y por lo tanto, una jerarquía de talla en la pollada. El patrón de nacimientos (asincronía frente a sincronía) y la reducción de pollada por muerte de al menos alguno de los pollos pueden mediar la asignación de recursos a diferentes caracteres relacionados con la eficacia biológica. Los recursos para crecimiento pueden ser dirigidos a defensa inmunitaria en polladas asincrónicas (Martínez-Padilla y Viñuela, 2011)3. Según un estudio en el que se incrementó la abundancia de alimento antes de la puesta, las condiciones ambientales promueven un ajuste de los recursos invertidos en pollos de ambos sexos, produciéndose un acortamiento del periodo de nacimiento de las últimas hembras que nacen, lo que probablemente les proporciona ventajas competitivas con respecto a los machos (Martínez-Padilla y Fargallo, 2007).2 A pesar de que el tiempo transcurrido entre la eclosión de los primeros pollos a los últimos es relativamente corta, implica una desventaja para los últimos pollos de los últimos huevos eclosionados en la competencia con sus hermanos durante su estancia posterior en el nido. Entonces, ¿por qué las hembras no empiezan a incubar al final de la puesta evitando comprometer la supervivencia de alguno de sus pollos? Esta es la pregunta principal que se plantea responder aquellos trabajos que estudian la asincronía de eclosión en aves. Según propuso Lack (1954) en su famosa hipótesis de la reducción de nidada para explicar el significado adaptativo de la asincronía de eclosión en aves, una rápida eliminación del último pollo en la eclosión, significaría una mayor probabilidad de supervivencia del resto de la nidada en períodos de escasez de alimento. En el cernícalo vulgar se han hecho experimentos para comprobar cuál es el significado de la asincronía de eclosión y parece ser cierto que una menor asincronía está relacionada con menor abundancia de alimento siendo esta una buena estrategia para la crianza de los pollos. Sin embargo, no se sabe muy bien por qué las hembras hacen eclosionar sus huevos sincrónicamente cuando hay abundancia de alimento (Wiebe et al., 1998; Wiehn et al., 2000). Cría de los pollosUna vez que los pollos eclosionan, los padres ceban a los pollos de manera diferente. El macho es el que caza y la hembra la que cuida de los pollos durante las dos primeras semanas de vida. Este patrón parece estar fijado diferencialmente entre los machos o hembra ya que en períodos de escasez de alimento, los machos parecen fijar su esfuerzo parental al tamaño de puesta y es independiente de las condiciones de aliemento (Wiehn y Korpimäki, 1997). La hembra sin embargo, es más flexible en su esfuerzo parental y lo ajusta a las condiciones de alimento (Wiehn y Korpimäki, 1997). Una vez que los machos dan las presas a las hembras, éstas las reparten entre los pollos. Ya desde los primeros días de vida, el dimorfismo sexual de los pollos se empieza a hacer patente. No parece existir una petición de alimento más acentuada en los machos que en las hembras y lo que sí se ha descrito es que los pollos hembra reciben más comida sólo cuando las madres dan presas suficientemente pequeñas como para ser ingeridas de una vez (Fargallo et al., 2003). Unido a la asincronía de eclosión, los pollos hembra muestran más estrés que los machos cuando eclosionan más tarde que el resto de la nidada (Martínez-Padilla et al., 2004). No obstante, la competencia entre los hermanos no es cainista, es decir, que los hermanos no se eliminan entre sí por la competencia para conseguir más alimento en el nido. La manipulación experimental de los niveles de testosterona en pollos mostró que niveles elevados tendieron a afectar negativamente la condición física y a la respuesta inmune, y redujeron la expresión de la coloración gris en machos (Fargallo et al., 2007).2 Las condiciones ambientales anteriores a la formación de los huevos median la relación entre peso del huevo y la futura respuesta inmune de los pollos. Se ha observado una relación negativa entre el peso del huevo y la respuesta celular inmune en pollos. Sin embargo cuando se proporcionó alimento suplementario a las hembras la relación fue positiva (Martínez-Padilla, 2006b).2 La defensa inmune mediada por células T en pollos se correlaciona positivamente con el peso y varía entre años. Además, disminuye con la hora de muestreo, y al final del día, disminuye con el número de pollos. El efecto acumulativo de competencia entre los pollos a lo largo del día podría ser la causa de este patrón (Martínez-Padilla, 2006a).1 En relación al sesgo macho-hembra de las nidadas, se han descrito trabajos contradictorios en esta especie. Es esperable que cuando las condiciones ambientales son más favorables, más comida en todo el año o al principio de cada temporada de cría, la relación entre los sexos sea sesgada hacia hembras ya que al ser mayores, necesitan más recursos para crecer. En Finlandia se ha descrito un mayor porcentaje de hembras en períodos de abundancia de alimento (Korpimäki et al., 2000), lo que apoya la idea anterior. Sin embargo, en Holanda, se ha descrito el patrón contrario, debido según los autores a que la probabilidad de que los machos se reproduzcan al año siguiente depende negativamente de la fecha en la que eclosionaron (Daan et al., 1996; Dijkstra et al., 1990, 1998). En el sistema central, no obstante, no se han observado tendencias estacionales en la relación entre sexos durante 5 años (datos propios). Periodo de dependencia Los pollos empiezan a salir del nido a una edad media de 31 días, pero permanecen en los alrededores alimentados por los padres durante un período adicional medio de 16 días (Bustamante, 1994). En el Sistema Central (n = 100 nidadas), el número medio de pollos volados es de 3,9 (Figura 6).
Figura 6. Distribución del número de pollos volados en las poblaciones del Sistema central durante 3 años de estudio (n = 100 puestas) (Según Martínez-Padilla, J., datos no publicados).
La competición entre hermanos continúa durante el periodo posterior al primer vuelo. Los machos muestran una mayor capacidad competitiva que las hembras, capturando presas aportadas por los padres más grandes que las hembras. Entre los machos, aquellos que tienen el obispillo de color más gris capturan mayor número de presas grandes que los machos de obispillo pardo, lo que sugiere que la coloración del obispillo podría ser un indicador de calidad (Vergara y Fargallo, 2008a)3. Los padres pueden modular la duración del periodo de dependencia de los volanderos según las condiciones de alimento, aunque los machos volanderos con obispillo gris, un carácter relacionado con la capacidad competitiva, tienen periodos de dependencia más largos que los machos de obispillo pardo (Vergara et al., 2010)3. Sobre la dispersión de los pollos de esta especie se sabe muy poco. No obstante, ver el apartado de movimientos.
Estructura y dinámica de poblaciones La tasa de crecimiento de población del cernícalo se basa en la densidad de población de una especie presa, Microtus arvalis, según un estudio realizado a lo largo de 15 años en Campo Azálvaro (centro peninsular) (Fargallo et al., 2009)3. Los machos con niveles más altos de inmunidad natural tuvieron un mayor éxito reproductivo (Parejo y Silva, 2009)3. En pollos, la supervivencia hasta el vuelo se predice tanto por sus variables inmunológicas como por la inmunidad innata de sus padres (Parejo y Silva, 2009) 3. ReferenciasAvilés, J. M., Sánchez, J. M., Parejo, D. (2001). Breeding rates of Eurasian kestrels (Falco tinnunculus) in relation to surrounding habitat in southwest Spain. Journal of Raptor Research, 35 (1): 31-34. Avilés, J. M., Sánchez, J. M., Sánchez, A. (2000). Breeding biology of the Eurasian kestrel in the steppes of southwestern Spain. Journal of Raptor Research, 34 (1): 45-48. Aparicio, J. M. (1994a). The effect of variation in the laying interval on proximate determination of clutch size in the European Kestrel. Journal of Avian Biology, 25: 275-280. Aparicio, J. M. (1994b). The seasonal decline in clutch size: an experiment with supplementaru food in the Kestrel, Falco tinnunculus. Oikos, 71: 451-458. Aparicio, J. M. (1998). Individual optimization may explain differences in breeding time in the European kestrel Falco tinnunculus. Journal of Avian Biology, 29 (2): 121-128. Aparicio, J. M. (1999). Intraclutch egg-size variation in the Eurasian kestrel: advantages and disadvantages of hatching from large eggs. The Auk, 116: 825-830. Aparicio, J. M., Bonal, R. (2002). Effects of food supplementation and habitat selection on timing of lesser kestrel breeding. Ecology, 83: 873-977. Blanco, G., Martínez-Padilla, J., Dávila, J. A., Serrano, D., Viñuela, J. (2003a). First evidence od sex differences in the duration of avian embryonic period: consequences for sibling competition in sexually dimorphic birds. Behavioral Ecology, 14: 702-706. Blanco,G., Martínez-Padilla, J., Serrano, D., Dávila, J. A., Viñuela, J. (2003b). Mass provisioning to different-sex eggs within the laying sequence: consequences for adjustment of reproductive effort in a sexually dimorphic bird. Journal of Animal Ecology, 72: 831-838. Bustamante, J. (1994). Behavior of colonial common kestrels (Falcotinnunculus) during the post-fledging dependence period in southwestern Spain. Journal of Raptor Research, 28 (2): 79-83. Daan, S., Dijkstra, C., Weissing, F. J. (1996). An evolutionary explanation for seasonal trends in avian sex ratios. Behavioral Ecology, 7: 426-430. Dijkstra, C., Daan, S., Buker, J. B. (1990). Adaptive seasonal variation in the sex ratio of kestrel broods. Functional Ecology, 4: 143-147. Dijkstra, C., Daan, S., Pen, I. (1998). Fledging sex ratios in relation to brood size in size-dimorphic altricial birds. Behavioral Ecology, 9: 287-296. Fargallo, J. A., Blanco, G., Soto-Largo, E. (1996). Possible second clutches in a Mediterranean montane population of the Eurasian kestrel (Falco tinnunculus). Journal of Raptor Research, 30 (2): 70-73. Fargallo, J. A., Laaksone, T., Korpimäki, E., Pöyri, V., Griffith, S. C., Valkama, J. (2003). Size-mediated dominance and begging behaviour in Eurasian kestrel broods. Evolutionary Ecology Research, 5: 549-558. Fargallo, J. A., López-Rull, I., Miksik, I., Eckhardt, A., Peralta-Sánchez, J. M. (2014). Eggshell pigmentation has no evident effects on offspring viability in common kestrels. Evolutionary Ecology, 28 (4): 627-637. Fargallo, J. A., Martínez-Padilla, J., Toledano-Díaz, A., Santiago-Moreno, J., Davila, J. A. (2007). Sex and testosterone effects on growth, immunity and melanin coloration of nestling Eurasian kestrels. Journal of Animal Ecology, 76 (1): 201-209. Fargallo, J. A., Martínez-Padilla, J., Viñuela, J., Blanco, G., Torre, I., Vergara, P., de Neve, L. (2009). Kestrel-prey dynamic in a Mediterranean region: the effect of generalist predation and climatic factors. PLoS ONE, 4 (2): e4311. Korpimäki, E., May, C. A., Parkin, D. T., Wetton, J. H., Wiehn, J. (2000). Environmental- and parental condition-related variation in sex ratio of kestrel broods. Journal of Avian Biology, 31: 128-134. Lack, D. (1954). The Natural Regulation of Animal Numbers. Oxford University Press, Oxford. Martínez-Padilla, J. (2006a). Daytime variation in T-cell-mediated immunity of Eurasian kestrel Falcotinnunculus nestlings. Journal of Avian Biology, 37 (5): 419-424. Martínez-Padilla, J. (2006b). Prelaying maternal condition modifies the association between egg mass and T cell-mediated immunity in kestrels. Behavioral Ecology and Sociobiology, 60 (4): 510-515. Martínez-Padilla, J., Dixon, H., Vergara, P., Pérez-Rodríguez, L., Fargallo, J. A. (2010). Does egg colouration reflect male condition in birds? Naturwissenschaften, 97 (5): 469-477. Martínez-Padilla, J., Fargallo, J. A. (2007). Food supply during prelaying period modifies the sex-dependent investment in eggs of Eurasian kestrels. Behavioral Ecology and Sociobiology, 61 (11): 1735-1742. Martínez-Padilla, J., Martínez, J., Dávila, J. A., Merino, S., Moreno, J., Millán, J. (2004). Functional Ecology, 18: 426-434. Martínez-Padilla, J., Viñuela, J. (2011). Hatching asynchrony and brood reduction influence immune response in Common Kestrel Falco tinnunculus nestlings. Ibis, 153 (3): 601-610. Mougeot, F., Thibault, J. C., Bretagnolle, V. (2002). Effects of territorial intrusions, courthsip feedings and mate fidelity on the copulation behaviour of the osprey. Animal Behaviour, 64: 759-769. Palokangas, P., Korpimäki, E., Hakkarainen, H., Huhta, E., Tolonen, P., Alatalo, R. V. (1994). Female kestrels gain reproductive success by choosing brightly ornamented males. Animal Behaviour, 47: 443-448. Parejo, D., Silva, N. (2009). Immunity and fitness in a wild population of Eurasian kestrels Falco tinnunculus. Naturwissenschaften, 96 (10): 1193-1202. Tinbergen, L. (1940). Beobachtungen über die Arbeitsteilung des Turmfalken (Falco tinnunculus) wärends der Fortpflanzungszeit. Ardea, 29: 63-98. Vergara, P., De Neve, L., Fargallo, J. A. (2007). Agonistic behaviour prior to laying predicts clutch size in Eurasian kestrels: an experiment with natural decoys. Animal Behaviour, 74 (5): 1515-1523. Vergara, P., Fargallo J. A. (2007). Delayed plumage maturation in Eurasian kestrels: female mimicry, subordination signalling or both? Animal Behaviour, 74 (5): 1505-1513. Vergara, P., Fargallo, J. A. (2008a). Sex, melanic coloration, and sibling competition during the postfledging dependence period. Behavioral Ecology, 19 (4): 847-853. Vergara, P., Fargallo, J. A. (2008b). Copulation duration during courtship predicts fertility in the Eurasian kestrel Falco tinnunculus. Ardeola, 55 (2): 153-160. Vergara, P., Fargallo, J. A., Martínez-Padilla, J. (2010). Reaching independence: food supply, parent quality, and offspring phenotypic characters in kestrels. Behavioral Ecology, 21 (3): 507-512. Vergara, P., Fargallo, J. A., Martínez-Padilla, J., Lemus, J. A. (2009). Inter-annual variation and information content of melanin-based coloration in female Eurasian kestrels. Biological Journal of the Linnean Society, 97 (4): 781-790. Village, A. (1990). The Kestrel. T & A D Poyser, London. Wiebe, K., Korpimäki, E., Wiehn, J. (1998). Hatching asynchrony in Eurasian kestrels in relation to the abundance and predictability of cyclic prey. Journal of Animal Ecology, 67: 908-917. Wiehn, J., Ilmonen, P., Korpimäki, E., Pahkala, M., Wiebe, K. (2000). Hatching asynchrony in the Eurasian kestrel Falcotinnunculus. An experimental test of the brood reduction hypothesis. Journal of Animal Ecology, 69: 85-95. Wiehn, J., Korpimäki, E. (1997). Food limitation on brood size: experimental evidence in the eurasian kestrel. Ecology, 78: 2043-2050.
Jesús Martínez-Padilla Centre for Ecology and Hydrology Banchory Hill of Brathens, Banchory Aberdeenshire AB31 4BW Scotland Fecha de publicación: 10-05-2006 Otras contribuciones: 1: Alfredo Salvador. 29-01-2007; 2: Alfredo Salvador. 28-02-2008; 3. Alfredo Salvador. 13-04-2012; 4. Alfredo Salvador. 25-04-2016 Martínez-Padilla, J. (2016). Cernícalo vulgar – Falco tinnunculus. En: Enciclopedia Virtual de los Vertebrados Españoles. Salvador, A., Morales, M. B. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
|
|
|
|
|
|
|