|
|
|
|
|
|
Para más información sobre cada apartado hacer click en:
|
Key words: Kestrel, description, measurements, sexual dimorphism, variation. Identificación y morfología Halcón de mediano-pequeño tamaño. En general, como en el resto de los halcones, tiene las alas estrechas y puntiagudas al igual que la cola, comparativamente mayor a otras aves de presa. Se le diferencia fácilmente por su característico cernido. No obstante, el cernícalo vulgar es sexualmente dimórfico en plumaje y tamaño. El macho adulto presenta una bigotera oscura con la cabeza grisácea. Las partes superiores y las coberteras son moteadas sobre un fondo castaño. Tiene el obispillo y cola grises, esta última terminada con una banda negra. No obstante, los individuos de más de un año pueden presentar barras subterminales en la cola que se irán perdiendo con los años a favor del gris. La parte inferior del cuerpo y el interior de las alas es moteada sobre un fondo ocráceo. La hembra, no presenta la cabeza gris aunque hembras de más edad pueden tenerla. Muestra igualmente bigotera y un moteado más acentuado en la parte inferior del cuerpo. Presentan moteado en la parte superior del cuerpo sobre fondo castaño oscuro pero más marcado que los machos. Los jóvenes del año, se asemejan a la hembra adulta aunque el obispillo de éstos puede variar desde gris completamente a marrón en los machos. Las hembras jóvenes tienen el obispillo marrón, aunque muy ocasionalmente pueden observarse hembras jóvenes con obispillo parcialmente gris. Iris pardo oscuro. Pico azul negro en la punta y gris azulado en la base. Cera amarilla. Patas amarillas (Glutz von Blotzheim et al., 1971; Cramp y Simmons, 1980, Village, 1990). Sin embargo, existe una alta variación entre adultos e incluso entre pollos del mismo nido. Recientemente se ha sugerido que el amarillo de las patas es dependiente de carotenoides, fundamentalmente luteína (Bertacche et al., 2006). Un estudio sobre la coloración ornamental basada en carotenoides ha señalado que el matiz de la coloración naranja-amarilla del anillo ocular era heredable pero no la tonalidad ni el brillo. Se ha detectado selección direccional positiva sobre el matiz y negativa sobre la tonalidad en hembras pero no en machos, mientras que el brillo no estuvo relacionado con la eficacia biológica en ambos sexos (Vergara et al., 2015)1.
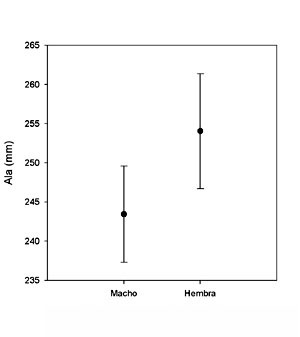
Biometría En poblaciones de España central (en todos los casos 100 hembras y 63 machos; J. Martínez-Padilla y J. A. Fargallo, datos no publicados), la longitud del ala en machos es de 243,4 ± 6,1 mm (rango = 258 – 228 mm) y de 254,1 ± 7,3 mm (rango = 270 – 227) en las hembras. El tarso en los machos de promedio es 41,7 ± 1,6 mm (rango = 44,53 – 37,15) y de 42.0 ± 1,7 mm (rango = 45,8 – 37,9). En el caso de la longitud de la cola, los machos promedian 163 ± 6,5 mm (rango = 180 – 149) y las hembras 170,2 ± 7,1 (rango = 189 – 148). La longitud media del ala de F. t. canariensis mide en machos 222 mm (rango = 213- 230; n = 15) y en hembras 234 mm (rango = 227 – 240; n = 11). La longitud media del ala de F. t. dacotiae mide en machos 223 mm (rango = 210- 233; n = 11) y en hembras 233 mm (rango = 228 – 239; n = 7) (Cramp y Simmons, 1980).
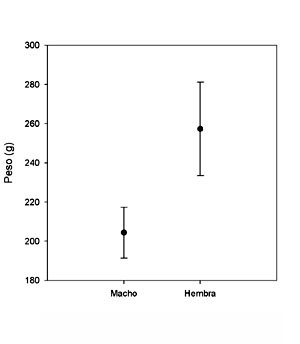
Masa corporal En España central, la masa corporal de los machos y de las hembras es 204,4 ± 13,0 g, y 257,33 ± 23,8 g respectivamente durante el período reproductor (basado en 100 hembras y 63 machos; J. Martínez-Padilla y J.A. Fargallo, datos no publicados). Bajos valores proporciona Veiga (1985) para una muestra reducida de ejemplares españoles: 159 g en machos (rango = 129-210; n = 5) y 170,2 g en hembras (rango = 125-266; n = 9). La masa corporal en otras poblaciones oscila en machos entre 136 y 252 g y en hembras entre 154 y 314 g (Cramp y Simmons, 1980). Se ha observado una covarianza genética negativa en machos adultos entre la coloración basada en melanina y la masa corporal y positiva entre la masa corporal y la respuesta inmune de los pollos. Análisis múltiples de selección mostraron un incremento de la eficacia biológica de los machos adultos con valores fenotípicos intermedios de coloración de melanina y masa corporal. En machos volanderos hubo evidencia de una selección disruptiva sobre el color gris del obispillo y de selección estabilizadora sobre la respuesta inmune (Kim et al., 2013)1.
Dimorfismo sexual En relación con el dimorfismo sexual en tamaño, machos y hembras adultas pueden diferir hasta en un 20%, pudiéndose detectar desde los primeros días de vida (Fargallo et al., 2003). A partir de individuos capturados en España central (Martínez-Padilla y Fargallo, datos no publicados. 125 adultos, 44 machos y 81 hembras), se observa que los machos son un 20,5% más ligeros que las hembras (Figura 1) y un 4,2 % más pequeños en relación a la longitud del ala (Figura 2).
Figura 1. Dimorfismo sexual en masa corporal en adultos de Cernícalo Vulgar.
Figura 2. Dimorfismo sexual en la longitud del ala en adultos de Cernícalo Vulgar. Además, los pollos macho justo antes de la emancipación (Martínez-Padilla y Fargallo, datos no publicados. 516 pollos, 255 machos y 261 hembras) son un 10,2 % más ligeros que las hembras y un 2,8 % más pequeños que las hembras en relación a la longitud del ala. Aunque son más parecidos a las hembras que a los machos, los volanderos son sexualmente dimórficos en tamaño y coloración. En ambos sexos los fenotipos más feminizados reclutan más que los menos feminizados. Los machos juveniles eran menos parecidos a los machos adultos que las hembras juveniles a las hembras adultas, lo que sugiere que la tendencia a la feminización en juveniles limita el dimorfismo sexual en adultos (López-Rull et al., 2016)1. El retraso en la maduración del plumaje de adulto permite a los machos jóvenes evitar la agresión de otros machos pero reduce las posibilidades de emparejamiento. El fenotipo óptimo de coloración de un macho joven debería permitir el emparejamiento y reducir la agresividad. La maduración diferencial de caracteres sexuales puede depender de la agresividad de machos y de hembras y los fenotipos de los machos jóvenes deberían ser una combinación que revele su sexo y provoque bajos niveles de agresividad. Se ha comprobado experimentalmente que aquellos caracteres de juveniles utilizados como modelo que provocan elevada agresividad en machos (cabeza y obispillo) estaban expresados parcialmente en machos jóvenes y solamente uno (cola) de dos caracteres (cola y dorso) que provocaron elevada agresividad en hembras estaban poco expresados (Vergara et al., 2013)1. Variación geográficaEspecie politípica, las poblaciones ibero-baleares se asignan a la subespecie F. t. tinnunculus, presente en el paleártico occidental. En las islas Canarias occidentales se encuentra la subespecie F. t. canariensis Koenig, 1890, caracterizada por su talla menor y coloración más oscura. En las islas Canarias orientales se encuentra la subespecie F. t. dacotiae Hartert, 1913, caracterizada por su pequeña talla y coloración clara.
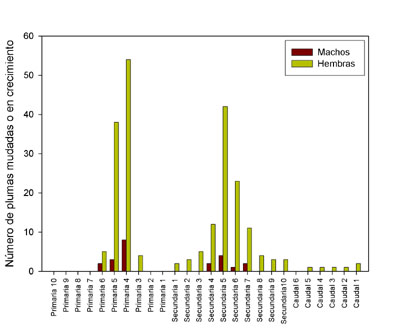
Muda En los adultos la muda postreproductiva es completa y tiene lugar de mayo al otoño. Las primarias se mudan en modo ascendente y descendente desde p4 (Glutz von Blotzheim et al., 1971; Cramp y Simmons, 1980). Los datos de España central corroboran esta información, donde al menos durante el período reproductor (durante la incubación concretamente), las hembras mudan o están mudando la p4 y p5, junto a las secundarias 5 y 6 fundamentalmente (datos propios no publicados, n = 74 adultos, 13 machos y 61 hembras) (Figura 3). Durante este período, la muda está más acentuada en las hembras que en los machos.
Figura 3. Muda durante el período reproductor. ReferenciasBertacche, V., Casagrande, S., Csermely, D., Pini, E., Bertacche, V., Tagliavini, J. (2006). Skin carotenoid concentration correlates with male hunting skill and territory quality in the kestrel Falco tinnunculus. Journal of Avian Biology, 37: 190-196. Cramp, S., Simmons, K. E. L. (Eds.) (1980). Handbook of the Birds of Europe the Middle East and North Africa. The Birds of the Western Palearctic. Vol. II. Hawks to Bustards. Oxford University Press. Fargallo, J. A., Laaksonen, T., Korpimaki, E., Poyri, V., Griffith, S. C., Valkama, J. (2003). Size-mediated dominance and begging behaviour in Eurasian kestrel broods Evolutionary Ecology Research, 5 (4): 549-558. Glutz von Blotzheim, U. N., Bauer, K. M., Bezzel, E. (1971). Hanbuch der Vögel Mitteleuropas. Band 4. Falconiformes. Aula Verlag, Wiesbaden. Kim, S. Y., Fargallo, J. A., Vergara, P., Martínez-Padilla, J. (2013). Multivariate heredity of melanin-based coloration, body mass and immunity. Heredity, 111 (2): 139-146. López-Rull, I., Vergara, P., Martínez-Padilla, J., Fargallo, J. A. (2016). Early constraints in sexual dimorphism: survival benefits of feminized phenotypes. Journal of Evolutionary Biology, 29 (2): 231-240. Veiga, J. P. (1985). Crecimiento de los pollos de Falco tinnunculus en el centro de España. Aspectos energéticos y ecológicos. Ardeola, 32 (2): 187-201. Vergara, P., Fargallo, J. A., Martínez-Padilla, J. (2015). Genetic basis and fitness correlates of dynamic carotenoid-based ornamental coloration in male and female common kestrels Falco tinnunculus. Journal of Evolutionary Biology, 28 (1): 146-154. Vergara, P., Martínez-Padilla, J., Fargallo, J. A. (2013). Differential maturation of sexual traits: revealing sex while reducing male and female aggressiveness. Behavioral Ecology, 24 (1): 237-244. Village, A. (1990). The Kestrel. T & AD Poyser, London.
Jesús Martínez-Padilla Centre for Ecology and Hydrology Banchory Hill of Brathens, Banchory Aberdeenshire AB31 4BW Scotland Fecha de publicación: 10-05-2006 Otras contribuciones: 1. Alfredo Salvador. 25-05-2016 Martínez-Padilla, J. (2016). Cernícalo vulgar – Falco tinnunculus. En: Enciclopedia Virtual de los Vertebrados Españoles. Salvador, A., Morales, M. B. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
|
|
|
|
|
|
|