|
|
|
|
|
|
Para más información sobre cada apartado hacer click en:
|
Key words: Northern pintail, activity, behaviour, courtship display, home range, commuting behaviour.
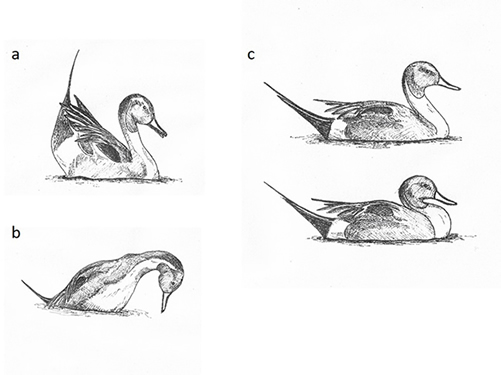
Patrón social y comportamiento Los grupos de descanso diurno durante el invierno reúnen a una gran cantidad de hembras y machos, facilitando así que tenga lugar el cortejo, la formación de parejas y finalmente el flujo de genes, al emparejarse individuos de distinto origen geográfico (Véase biología de la reproducción; Parejo et al., 2015). Los ánades rabudos comienzan el cortejo en diciembre y alrededor del 80% de los individuos están emparejados a finales de febrero (Lebret, 1950; Rodway, 2007). Durante el cortejo varios machos se congregan por lo general alrededor de una hembra emitiendo sonidos guturales y silbidos, acompañados de movimientos de cabeza y de cola 'Head-up-tail-up' (Figura 1a), y finalizan girando el pico hacia la hembra. También es frecuente que los machos giren hacia atrás la cabeza 'Turn-back-of-Head' y mientras emiten sonidos guturales y persiguen a la hembra, finalizando con silbidos al mismo tiempo que estiran el cuello e inclinan el pico hacia abajo (Figura 1b). Por parte de la hembra la exhibición de cortejo consiste en realizar movimientos con el pico y llamadas cortas y suaves en tono decreciente (decrescendo; Lorenz 1951-53). En Andalucía los cortejos en grupo se observan entre diciembre y marzo, estando esos grupos compuestos en promedio por 4,25 machos (rango = 2 − 9, n = 67) y 1,21 hembras (rango = 1 − 4, n = 67; J. A. Amat, com. pers.). La formación de la pareja relativamente temprana, en el invierno, proporciona la ventaja de alcanzar las áreas de cría, obtener las reservas de energía necesarias y anidar lo antes posible (Rodway, 2007). En las áreas de nidificación, la pareja no presenta un comportamiento agresivo, los machos suelen defender más a las hembras en las proximidades del lugar donde anidan y la pareja normalmente no se rompe (Titman y Seymour, 1981; Fox, 2005). Los machos instigan a su pareja a realizar frecuentes exhibiciones de cortejo que finalizan con la cópula (Fox, 2005). La exhibición previa a la cópula consiste en que ambos individuos suben y bajan la cabeza verticalmente 'Head-pumping' (Figura 1c; Lorenz 1951-53).
Figura 1. Posturas características del macho de ánade rabudo durante el cortejo. a) Head-up-tail-up, b) cuello estirado y pico hacia abajo mientras emite un silbido, c) head-pumping (Lorenz 1951-53). (©) Manuel Parejo.
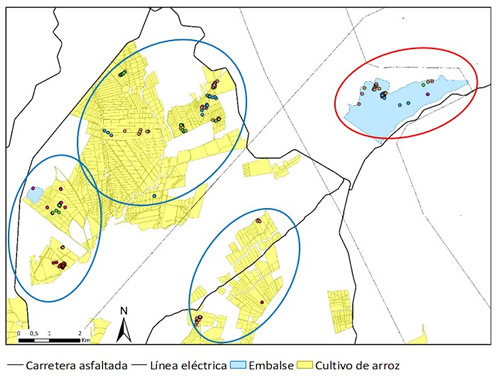
Durante esta época los ánades rabudos se dispersan por los sitios de cría, siendo esta especie la que muestra un comportamiento territorial menos acusado entre los ánades de superficie (Titman y Seymour, 1981). Probablemente a consecuencia de esto, el hostigamiento que sufren las hembras durante el período de puesta por machos distintos de su pareja es mayor que en otras especies de ánades de superficie (Titman y Seymour, 1981). Al tratar de escapar de los machos algunos huevos quedarían sin fertilizar, siendo el porcentaje de huevos infértiles mayor en el ánade rabudo que en otras especies (Amat, 1987). Normalmente en la primera semana de incubación tras completar la puesta los machos abandonan las áreas de reproducción y se desplacen a las zonas de muda, aunque en ocasiones abandonan antes de que comience la incubación (Salomonsen, 1968; Titman y Seymour, 1981). A diferencia de lo que ocurre en las áreas de reproducción, en las de invernada y parada migratoria esta especie suele congregarse formando grandes grupos pluriespecíficos (principalmente con otros ánades de superficie) para descansar durante las horas de luz (véase Interacciones entre especies), y se disgregan en pequeños grupos para forrajear durante las horas de oscuridad (Comportamiento de desplazamiento; Scott y Rose, 1996). Los grandes grupos de descanso diurno permiten a los ánades rabudos descansar, tomar baños de sol y acicalar su plumaje con mayor seguridad frente a los depredadores y además favorecen las interacciones sociales y maximizan el reparto de los recursos (Tamisier, 1985). El comportamiento de desplazamiento puede variar en respuesta a diferentes variables ambientales y según el tipo de hábitat y la fecha (Kloskowski et al., 2009; Legagneux et al., 2009; Parejo et al., 2019). En hábitat naturales es frecuente que el Ánade rabudo permanezca en las áreas de descanso durante la noche, sobre todo en fechas avanzadas de la invernada (Legagneux et al., 2009), mientras que en hábitats antrópicos mantiene los movimientos entre las zonas de descanso diurno y las de forrajeo nocturno, a lo largo de todo el invierno (Parejo et al., 2019). En Extremadura ánades rabudos marcados con transmisores GPS-GSM siguieron una rutina común durante todo el invierno: abandonaron el lugar de descanso diurno 16,1 min ± 1,9 [error estándar] después del atardecer, pasaron la noche en las áreas de forrajeo (campos de arroz inundados) y las abandonaron 29,7 min ± 1,2 [error estándar] antes del amanecer, para volver a las áreas de descanso diurno (Figura 2; Parejo et al., 2019).
Figura 2. Ejemplo de los movimientos de diferentes ánades rabudos marcados con transmisores GPS-GSM durante una semana, entre el área de descanso utilizada durante las horas de luz (círculo rojo) y las de forrajeo utilizadas durante la noche (círculos azules), en los arrozales de Extremadura (extraído de Parejo, 2018).
A lo largo del invierno estas aves presentaron una área de campeo media semanal (Polígono Convexo Mínimo) de 9,653 ha ± 1,589 [error estándar] y realizaron viajes entre las áreas de descanso y las de forrajeo de 11,4 km ± 0,6 [error estándar] (véase Parejo et al., 2019). Estos movimientos entre las áreas de descanso diurno y las de forrajeo nocturno parecen estar influidos principalmente por la superficie inundada de arrozal y la luz procedente de la Luna, así la actividad de exploración nocturna de los ánades rabudos aumentó aquellas semanas en las que la disponibilidad de tablas de arroz inundadas fue menor y la iluminación nocturna procedente de la luna fue mayor (Parejo et al., 2019). Las aves marcadas con transmisores también mostraron una alta fidelidad por las áreas de forrajeo, volviendo al mismo arrozal durante cuatro o cinco días consecutivos (véase hábitat: época no reproductora; Parejo et al., 2019).
Referencias Amat, J. A. (1987). Infertile eggs: a reproductive cost to female dabbling ducks inhabiting unpredictable habitats. Wildfowl 38, 114-116. Fox, T. (2005). Northern pintail Anas acuta. Pp. 595-599. En: Kear, J. (ed.), Ducks, geese, and swans. Oxford University Press, Oxford and New York. Kloskowski, J., Green, A.J., Polak, M., Bustamante, J. (2009). Complementary use of natural and artificial wetlands by waterbirds wintering in Doñana, south-west Spain. Aquatic Conservation: Marine and Freshwater Ecosystems 826, 815-826. Lebret, T. (1950). The sex-ratios and the proportion of adult drakes of teal, pintail, shoveler and wigeon in the Netherlands, based on field counts made during autumn, winter and spring. Ardea 38, 1-18. Legagneux, P., Blaize, C., Latraube, F., Gautier, J., Bretagnolle, V. (2009). Variation in home-range size and movements of wintering dabbling ducks. Journal of Ornithology 150, 183-193. Lorenz, K. (1951-1953). Comparatives studies on the behaviour of Anatinae. Avicultural Magazine 57, 157-182; 58, 8-17; 61-72, 86-94, 172-174; 59, 24-34, 80-91. Parejo, M. (2018). Papel de las poblaciones de aves acuáticas en humedales antrópicos del sur de Europa: Ecología de las anátidas migratorias de largas distancias invernantes en Extremadura. Tesis Doctoral. Universidad de Extremadura. Parejo, M., Gutiérrez, J.S., Navedo, J.G., Soriano-Redondo, A., Abad-Gómez, J.M., Villegas, A., Corbacho, C., Sánchez-Guzmán, J.M., Masero, J.A. (2019). Day and night use of habitats by northern pintails during winter in a primary rice-growing region of Iberia.PLoS One 14, e0220400. Parejo, M., Navedo, J.G., Gutiérrez, J.S., Abad-Gómez, J.M., Villegas, A., Corbacho, C., Sánchez-Guzmán, J.M., Masero, J.A. (2015). Geographical origin of dabbling ducks wintering in Iberia: Sex differences and implications for pair formation. Ibis 157, 536-544. Rodway, M.S. (2007). Timing of Pairing in Waterfowl I: Reviewing the Data and Extending the Theory. Waterbirds 30, 488-505. Salomonsen, F. (1968). The moult migration. Wildfowl 19, 5-24. Scott, D.A., Rose, P.M. (1996). Atlas of Anatidae Populations. In Africa and Western Eurasia. Wetlands International. Tamisier, A. (1985). Some considerations on the social requirements of ducks in winter. Wildfowl 36, 104-108. Titman, R.D., Seymour, N.R. (1981). A comparison of pursuit flights by six North American ducks of the genus Anas. Wildfowl 32, 11-18.
Manuel Parejo Fecha de publicación: 24-07-2020 Parejo, M. (2020). Ánade rabudo – Anas acuta. En: Enciclopedia Virtual de los Vertebrados Españoles. López, P., Martín, J., Amat, J. A. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
|
|
|
|
|
|
|