|
|
||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||
|
Para más información sobre cada apartado hacer click en:
|
Key words: Northern pintail, habitat, abundance, status, threats, management plans.
Hábitat Los grupos de la familia Anatidae (patos, gansos y cisnes) se encuentran estrechamente ligados a ambientes acuáticos, con diferentes preferencias en cuanto a la profundidad, la calidad del agua o la vegetación existente según la especie (Carboneras, 1992; Pernollet et al., 2015; Lehikoinen et al., 2016). El ánade rabudo puede llegar a utilizar diferentes humedales naturales a lo largo del ciclo anual, tales como marismas, lagunas o ríos (Carboneras, 1992; Fox, 2005; Zwarts et al., 2009), normalmente con aguas poco profundas lo que les facilita la obtención de alimento (Dessborn et al., 2011). En Europa, a partir del siglo XX se han producido cambios sustanciales en el uso y la gestión de la tierra, que han convertido las regiones tradicionales de invernada, parada migratoria y reproducción del ánade rabudo en una matriz de hábitats transformados por el hombre, facilitando a esta especie la utilización de humedales artificiales (p.ej., arrozales, salinas, embalses, balsas de acuicultura o lagunas artificiales; Ferrer, 1982; Martínez-Abraín, 1999; Navedo et al., 2012; Bregnballe et al., 2014; Elphick, 2015; Lehikoinen et al., 2016). Época no reproductora Los ánades de superficie presentan, al igual que gansos y cisnes, una alta fidelidad por las regiones de invernada (Robertson y Cooke, 1999), aunque tal fidelidad puede verse afectada si se producen importantes cambios en el hábitat (Mulhern et al., 1985; Guillemain et al., 2009). El ánade rabudo, como otros ánades de superficie, durante la invernada generalmente se congrega formando grupos de varios miles de individuos en zonas inundadas abiertas, que utilizan como áreas de descanso por el día, para desplazarse en pequeños grupos a las áreas de forrajeo por la noche (Ferrer, 1982; Martínez-Abraín, 1999; Legagneux et al., 2009; Parejo et al., 2019). La población europea de ánade rabudo ocupa durante el invierno mayormente zonas de marismas y embalses de riego, próximos a amplias extensiones de arrozales y otros cultivos de regadío (Ferrer, 1982; Scott y Rose, 1996; Martínez-Abraín, 1999; Zwarts et al., 2009; Molina y Prieta, 2012; Parejo et al., 2019). En la península Ibérica, los embalses fueron proporcionalmente más utilizados durante la década de 1970 cuando los humedales naturales presentaban niveles de agua más bajos, aunque en comparación con otros ánades de superficie, el ánade rabudo fue el que hizo un menor uso de esos embalses durante dicho periodo (Amat y Ferrer, 1988). En las marismas del Guadalquivir (Amat, 1980) y delta del Ebro (Ferrer, 1982) utiliza preferentemente masas de agua de gran superficie (véase también Coronado et al., 1974). Las poblaciones más importantes que invernan en la península Ibérica ocupan regiones con amplias extensiones de cultivos de arroz, que utilizan principalmente como áreas de forrajeo (Molina y Prieta, 2012). Precisamente, la proximidad de una gran superficie de arrozales (aprox. 25.000 ha) a numerosos embalses de riego ha facilitado el uso de esos embalses por importantes números de ánades rabudos en Extremadura durante las décadas recientes (Navedo et al., 2012; Parejo et al., 2019). Según Amat, (1980) el ánade rabudo se mostró más selectivo en el uso de distintos medios acuáticos en las marismas del Guadalquivir que la mayoría de especies de anátidas invernantes en esa área, utilizando principalmente grandes lucios (lagunas; Castrillo-Díaz, 1994) y las marismas de la Reserva Biológica de Doñana, sin embargo durante la migración primaveral utilizan una mayor diversidad de medios acuáticos (véase más adelante). Para alimentarse durante la noche, el ánade rabudo selecciona principalmente arrozales con rastrojo, inundados (14-20 cm de profundidad) y con grava presente en el suelo que no supere los 0,5 cm de diámetro (Parejo et al., 2019). Ocasionalmente también utilizan tablas de arroz de gran superficie, inundadas y sin rastrojo como áreas de descanso durante las horas de luz (obs. personal). A lo largo de la migración los ánades rabudos utilizan hábitats recién inundados y de carácter efímero (Cramp y Simmons, 1977), además de zonas de cultivo de arroz como por ejemplo los arrozales del delta del Ebro (Ferrer, 1982), de la Camarga francesa (Tamisier y Grillas, 1994; Tourenq et al., 2001) o del valle del Po (Longoni, 2010; Dessborn et al., 2011), que constituyen importantes áreas de parada migratoria (véase también Parejo et al., 2015). Las áreas de parada son importantes elementos en el ciclo anual del ánade rabudo, que les permiten recuperar reservas de energía para continuar su migración y además, en el caso de las paradas migratorias durante la migración de primavera, obtener nutrientes esenciales para la reproducción (Arzel y Elmberg, 2004; Arzel et al., 2006; Parejo et al., 2015). Hábitat de reproducción La población reproductora en la península Ibérica es de pequeño tamaño y está sujeta a variaciones numéricas anuales dependiendo principalmente de que las condiciones meteorológicas sean favorables (especialmente tras inviernos lluviosos). Los humedales seleccionados presentan poca profundidad y abundante vegetación subacuática, con diversas plantas herbáceas y juncos dónde ubican los nidos, aunque también en ocasiones sitúan los nidos en cultivos cercanos al agua (Molina et al., 2003; Molina, 2009), o en pequeñas islas de vegetación terrestre (denominadas vetas; véase Biología de la reproducción) en las marismas del Guadalquivir (M. Máñez, com. pers.).
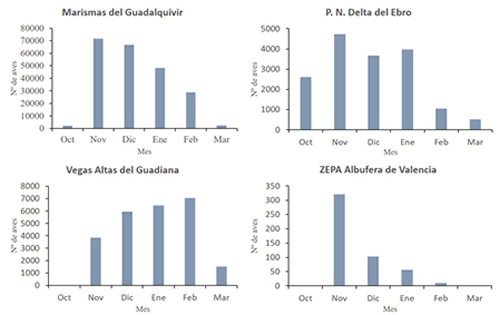
Tamaño de la población Invernada El ánade rabudo ha sido tradicionalmente una especie abundante en España durante la época no reproductora. De hecho, Chapman, (1888) lo consideró la anátida invernante más numerosa en las marismas del Guadalquivir a finales del siglo XIX. La llegada de los individuos migratorios se registra entre los meses de septiembre y octubre, mientras que el abandono de las áreas de invernada para comenzar la migración de primavera ocurre entre marzo y abril, registrándose los valores máximos de población entre diciembre y febrero (Figura 1; Amat, 1981, 1984; Ferrer, 1982; Navarro-Medina y Navarro-García, 1982; Rendón et al., 2008; Parejo, 2018). Muchos de los individuos censados en los humedales ibéricos durante las épocas de migración probablemente estén en tránsito hacia o desde otras zonas tradicionales de invernada para la población europea de ánade rabudo situadas en el Sahel (véase Distribución Geográfica; Zwarts et al., 2009).
Figura 1. Resultados de censos mensuales de ánades rabudos invernantes en las marismas del Guadalquivir (ESPN; Estación Biológica de Doñana - CSIC), Parque Natural del Delta del Ebro (Bigas y Curcó, 2016, 2018), Vegas Altas del Guadiana (datos propios), durante el invierno 2014/2015, y en la albufera de Valencia durante el invierno 2015/2016 (Giménez-Ripoll, 2017).
La importancia relativa que distintas regiones españolas tienen para el ánade rabudo durante la invernada ha variado ligeramente a lo largo de las últimas décadas. Así, en las décadas de 1960-1980, el ánade rabudo se concentraba principalmente en las marismas del Guadalquivir, delta del Ebro y albufera de Valencia (Bernis, 1964; Amat et al., 1985; Dolz-García y Gómez-López, 1988). Los censos realizados entre 1990 y 2001 pusieron de manifiesto que más del 70% de los ánades rabudos invernantes en España se concentraban en las marismas del Guadalquivir y delta del Ebro (Molina et al., 2003). Durante 1984-2004, la población invernante en la Comunidad Valenciana mostró una tendencia decreciente (Gómez-López et al., 2006), lo que contribuyó a la menor relevancia de esta región para la especie en el contexto nacional actual. De hecho, en las décadas más recientes las principales poblaciones invernantes se situaron en las marismas del Guadalquivir, Vegas Altas del Guadiana y delta del Ebro (89,42 % de la población invernante; Tabla 1) (Molina y Prieta, 2012).
Tabla 1. Población media invernante de ánade rabudo en España. Elaboración a partir de diferentes fuentes: período 1992-1994 y 2000-2002 datos obtenidos de (Martí y Del Moral, 2003; Gonzáles y Pérez-Aranda, 2011), período 2008-2010 datos obtenidos de (Molina y Prieta, 2012), período 2016-2018 datos obtenidos de la base de datos del programa de censo internacional de aves acuáticas SEO/BirdLife, (http://www.acuaticas.org; Fecha de consulta 29/02/2020), completada con datos del ESPN (Estación Biológica de Doñana – CSIC) (*) y datos propios (**).
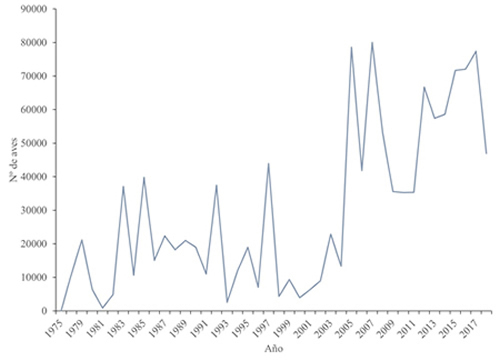
Según los censos aéreos mensuales, la población invernante en las marismas del Guadalquivir ha mostrado un fuerte incremento a partir de los inicios del presente siglo, ya que la media de los valores máximos anuales del periodo 1977/1978-1999/2000 fue de 15.000 aves frente a las 41.000 del periodo 2000/2001-2012/2013 (Máñez y Arroyo, 2014). Por otra parte, el promedio mensual de individuos censados desde avioneta a lo largo de la invernada oscila entre algo más de 12.000 ejemplares en el mes de febrero y los 18.000 de diciembre y enero para el periodo 1979/80-2012/2013 (Máñez y Arroyo, 2014). Así los datos de los últimos 50 años muestran que Doñana en la actualidad es uno de los lugares de invernada más importantes de Europa para el ánade rabudo (Figura 2).
Figura 2. Censos aéreos de ánades rabudos en el parque nacional de Doñana durante los meses de diciembre y enero de 1975-2018. Datos recopilados por Javier Bustamante Díaz (2020), fuente ESPN (Estación Biológica de Doñana - CSIC).
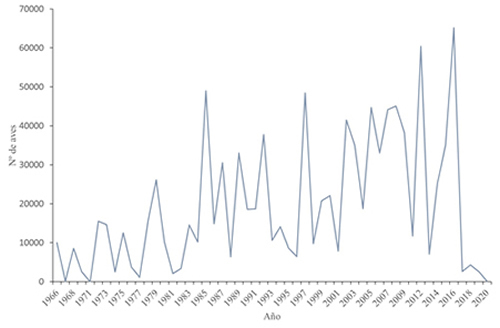
La importancia creciente de las localidades extremeñas en años recientes estaría impulsada por la creación de numerosos embalses próximos a una gran superficie de cultivos de arroz a lo largo de la década de 1990, que ha dado como resultado una redistribución parcial de los ánades rabudos invernantes en España (véase más adelante). El conjunto de humedales antrópicos de las Vegas Altas del Guadiana ha llegado a concentrar importantes poblaciones (aproximadamente el 1% de la población que migra a través de la ruta migratoria del Atlántico Este), entre 2007 y 2010 la población invernante media en las Vegas Altas del Guadiana fue de 7.235 ánades rabudos (Navedo et al., 2012), la cual se mantuvo estable con 7.350 aves de media entre 2012 y 2015 (datos propios). En los últimos años, posiblemente a consecuencia de la escasa proporción de arrozales inundados en Vegas Altas del Guadiana durante otoño e invierno, la población censada de ánade rabudo disminuyó en torno al 50% (Tabla 1), concentrándose en los humedales extremeños una población media de 3.600 aves en el invierno 2019/2020 (datos propios). Por lo tanto, Vegas Altas del Guadiana emerge como uno de los lugares de invernada más importantes para los ánades rabudos en el sur de Europa, destacando los embalses de Gargáligas (Badajoz) y Sierra Brava (Cáceres) por ser los más utilizados por esta especie. La correcta gestión y protección, mediante mecanismos legales, de estos embalses junto a los arrozales utilizados como áreas de forrajeo, garantizaría la existencia de una gran superficie de humedales artificiales, que podría mitigar la pérdida de humedales naturales para las poblaciones que los utilizan (Navedo et al., 2012; Parejo et al., 2019). El declive poblacional general de 600.000 a 400.000 individuos, que se registró en el Sahel occidental entre 1980 y 2006 (Zwarts et al., 2008), podría ser consecuencia de la redistribución parcial del ánade rabudo entre estos humedales del oeste de África, donde se contabilizaron 838.000 aves a mediados del invierno de 1987 (Scott y Rose, 1996), y los humedales del suroeste de Europa (Navedo et al., 2012). Dentro de Doñana los ánades rabudos tienden a hacer un uso mayor de humedales artificiales, con niveles de agua más estables, los años en los que la sequía afecta a los humedales naturales (Kloskowski et al. 2009). Además, aparentemente también existe una redistribución parcial de las aves entre los humedales del suroeste de la península Ibérica, de manera que los años en los que la población invernante en Doñana es más baja, coinciden con años en los que son censados altos números de ánades rabudos en Vegas Altas del Guadiana, situada a menos de 300 km de distancia (Navedo et al., 2012). Los censos realizados en los humedales españoles a mediados de enero de cada año, muestran que la población de ánade rabudo invernante ha fluctuado considerablemente a lo largo de las últimas seis décadas (p. ej., 8 aves censadas en 1971 frente a 65.173 aves en 2016; SEO/Birdlife, http://www.acuaticas.org; Fecha de consulta 29/02/2020) (Figura 3).
Figura 3. Censos de ánades rabudos en los humedales españoles durante enero de 1966-2020. Datos recopilados del censo internacional de aves acuáticas invernantes realizados simultáneamente el fin de semana más próximo al 15 de enero de cada año, fuente SEO/BirdLife (http://www.acuaticas.org).
Las variaciones interanuales en los niveles de inundación afectan tanto al número de ánades rabudos invernantes como a su distribución. Por ejemplo, las condiciones de inundación ocasionaron que el tamaño de la población invernante en el Parque Nacional de Doñana fluctúase; así, en 2008 y 2009 fueron censadas 22.000 aves mientras que en 2010 tan sólo lo fueron 8.000 (Molina y Prieta, 2012). Pero en el invierno de 2016 Doñana llegó a concentrar aproximadamente 61.000 ánades rabudos (http://www.acuaticas.org; Fecha de consulta 29/02/2020). Reproducción La población reproductora del ánade rabudo en España es muy pequeña y se encuentra sometida a notables fluctuaciones según las condiciones de los humedales (véase Hábitat: Reproducción), siendo el nivel de agua el mayor condicionante para que críe esta especie (Molina et al., 2003; Molina, 2009). El principal sitio de cría son las marismas del Guadalquivir, donde los ornitólogos que las visitaron a finales del siglo XIX y principios del XX ya señalaron a la especie como nidificante (Noble, 1902). En la década de 1950 aparecen registros de ánades rabudos criando en las marismas del Guadalquivir cuando éstas presentaban condiciones idóneas (Valverde, 1960; Mountfort y Ferguson-Lees, 1961; Bernis, 1966). Amat, (1982) estimó unas 20 parejas reproductoras en dichas marismas a final de la década de 1970. Según los datos obtenidos por Madroño et al., (2004), en esta área a lo largo de la primera mitad de la década de 1990, a consecuencia de la fuerte sequía sólo se registró un dato de reproducción con éxito en 1995 (una hembra con 7 pollos). Mientras que en la primavera de 1996, los datos del Equipo de Seguimiento de la EBD - Área de conservación del PND (EBD y PND, 1996) indicaron la existencia de unas 40 parejas reproductoras, coincidiendo con abundantes lluvias y los planes de control de depredadores realizados en el Parque Nacional de Doñana. Sin embargo, se contabilizaron 8 parejas reproductoras en 1997 y ninguna en 1998, a pesar de ser ambos años lluviosos (EBD y PND, 1998, 1997). En 2001, cuando las lluvias fueron muy uniformes, el buen nivel de inundación durante la primavera propició que criasen en el Parque Nacional de Doñana entre 40 y 45 parejas (EBD y PND, 2001). En 2007 únicamente se registraron 2 parejas nidificantes en las marismas del Guadalquivir (Molina, 2009). En los humedales de La Mancha el ánade rabudo crió en la antigüedad de forma habitual (Purroy, 1997), sin embargo en las décadas recientes se produce excepcionalmente (Madroño et al., 2004; Molina, 2009). Durante las primaveras de 1997 y 1998, se estimaron entre 18-26 y 9-16 parejas reproductoras respectivamente (Velasco, 2002, 1999). En Castilla y León se localizaron 3 parejas reproductoras en el río Moros (Segovia) en 2007 (Molina, 2009). Además, hay registros de nidificación en las provincias de Álava, Zamora y Zaragoza (De Juana y Garcia, 2015). La población mínima estimada en España durante la época de cría es de 29 parejas, mientras que en condiciones muy favorables se estima que la población reproductora podría alcanzar entre 50-100 parejas, aunque históricamente nunca se han detectado más de 45 (Molina, 2009).
Estatus de conservación Categoría global IUCN (2019): Preocupación menor (BirdLife International, 2020). Categoría Europa IUCN (2015): Preocupación menor (BirdLife International, 2015). Categoría España IUCN (2015): Preocupación menor (Comité español, UICN, 2015). Es difícil establecer una tendencia global clara de la población, debido a las fluctuaciones. A escala mundial no se ha detectado un declive de más del 30% en 10 años (o en tres generaciones) por lo que se considera en la categoría de «Preocupación menor» y se califica como una especie «En Declive», según las categorías de BirdLife para evaluar el estado de conservación de las aves (población mundial entre 4.700.000-4.800.000 individuos; BirdLife International, 2020). En el Noroeste de Europa, la población del ánade rabudo incrementó ligeramente desde 1997 hasta 2007 (Mundkur y Nagy, 2012), sin embargo, esta población ha disminuido a menos de la mitad durante los últimos años (2007-2014; WWT, 2014). La población europea (810.000 individuos; Mundkur y Nagy, 2012), presenta un declive que supera el 10% en 10 años (o en tres generaciones) por lo que se califica como una especie «En Declive» (BirdLife International, 2017). En España se consideraba «Vulnerable» en el último Libro Rojo de las Aves de España dado el reducido tamaño de la población reproductora (criterio D), 50-100 parejas reproductoras en años muy favorables (Molina et al., 2003). No obstante actualmente, en el Análisis de las especies en Lista roja de la UICN en España se considera al ánade rabudo una especie en la categoría de «Preocupación menor» (Comité español UICN, 2015). Sin embargo, en los últimos años se reproduce con regularidad tan sólo en las marismas del Guadalquivir, en tanto que humedales históricamente importantes para esta especie durante la reproducción parecen haber dejado de tener importancia (p.ej. humedales de La Mancha; véase Tamaño de la población: Reproducción). Este hecho, junto a la tendencia poblacional negativa en Europa, hace apropiada su consideración como especie en la categoría de en «En Peligro», según Molina (2009).
Amenazas Pérdida y degradación de hábitat La principal amenaza para la conservación del ánade rabudo es la alteración, transformación y destrucción de hábitats favorables. El declive poblacional de la especie en Europa se debe en gran parte a que selecciona humedales ricos en nutrientes (eutróficos) durante la época de cría, los cuales están desapareciendo a consecuencia de la continua hipereutrofización en las áreas de reproducción más importantes situadas en el noreste del continente (Pöysä et al., 2013; Lehikoinen et al., 2016). En España la continuada pérdida de humedales adecuados para la cría del ánade rabudo ha podido ocasionar una disminución de la población reproductora en años recientes. Así, muchos de los humedales de La Mancha, importantes en el contexto ibérico en el pasado (Coronado et al., 1974), han desaparecido como consecuencia de la sobreexplotación de los acuíferos. En la actualidad la población reproductora se reduce a un número variable de parejas en las marismas del Guadalquivir en función de las condiciones de inundación (véase Tamaño de la población: Reproducción; Madroño et al., 2004; Molina, 2009). Por otro lado, la transformación y la gestión inadecuada de hábitats importantes para la especie durante los meses de invierno (parque nacional de Doñana, Vegas Altas del Guadiana y Delta del Ebro) también supone una amenaza para la conservación del ánade rabudo en España y Europa (Parejo et al., 2019). En Extremadura, aproximadamente unas 6.000 ha de cultivo de arroz han sido sustituidas mayormente por frutales, almendros y olivos en cultivo intensivo, afectando de forma directa a las principales zonas que utiliza la especie como áreas de forrajeo en la región durante los meses de invierno (MAPAMA, 2017; Parejo et al., 2019). Contaminantes El plumbismo o envenenamiento por plomo (Pb) es la intoxicación resultante de la absorción de niveles peligrosos de Pb en los tejidos corporales, que afecta a numerosas especies de aves acuáticas y en especial a las anátidas (Mateo et al., 2000). La fuente más común es la ingesta de los perdigones de plomo de los proyectiles utilizados para la caza, al confundirlos con partículas de grava que los patos utilizan para facilitar la digestión del alimento (Hall y Fisher, 1985; Mateo y Guitart, 2000). Otras fuentes son la ingesta de las plomadas de pesca, balas u otros objetos de plomo, y la contaminación de las áreas de forrajeo por desechos mineros y pigmentos de pintura (Friend et al., 1999). El plumbismo afecta gravemente a la población mundial de ánade rabudo, ya que esta especie ingiere grava de entre 1-4 mm de diámetro para poder digerir las semillas (Mateo et al., 1997, 2000; Mateo, 2009), con lo que se puede confundir con los perdigones (véase Ecología trófica: Modo de alimentación). Otros metales pesados como el cromo (Cr), manganeso (Mn), cobre (Cu), zinc (Zn) o cadmio (Cd), se han encontrado en tejidos de distintas especies de anátidas (incorporados a los tejidos principalmente de forma directa a través de la ingesta de grava y arena contaminada; Beyer et al., 1999; Mateo y Guitart, 2003). Las concentraciones de estos metales pesados, cuyas fuentes son mayormente de origen antropogénico (p.ej. fertilizantes, pesticidas o desechos agrícolas e industriales), al igual que ocurre con las concentraciones de Pb, han aumentado considerablemente en los sedimentos de los ambientes acuáticos desde mediados del siglo pasado (Callaway et al., 1998; Mañosa et al., 2001). Además de los metales pesados compuestos químicos como los policlorobifenilos (PCBs) o los compuestos del grupo del dicloro difenil tricloroetano (DDTs), cuyos orígenes son también derivados de la actividad agrícola e industrial, han sido encontrado en los tejidos hepático, adiposo, medular, muscular o renal de diferentes especies de anátidas (Llorente et al., 1987). Además de causar mortalidad directa, la acumulación de diferentes contaminantes en los tejidos provoca la pérdida de la condición corporal, afectando también a la reproducción exitosa de la especie (Sanderson y Bellrose, 1986; Mateo y Guitart, 2003; Provencher et al., 2016). Aunque indudablemente hay varias causas involucradas, el envenenamiento es un factor que influye de forma directa en las tendencias negativas de las poblaciones del ánade rabudo y el resto de aves acuáticas del Paleártico occidental (Mateo, 2009; Pain et al., 2019). Caza La falta de vigilancia y de control dificulta cuantificar el grado en el que la caza ilegal afecta a esta especie en España, donde el ánade rabudo es considerado una especie cinegética. A lo largo de la primera mitad del siglo XX, esta especie ha sido tradicionalmente cazada en España llegando a números excepcionalmente altos en las temporadas 1926-27 y 1942-1943 (Bernis, 1964). En la actualidad sigue siendo considerada especie cinegética en Andalucia (Anexo III apartado A, de la Ley 8/2003, de 28 de octubre; Junta de Andalucía), donde se encuentra la mayor población invernante, sin embargo otras comunidades como Cataluña (Generalitat de Catalunya; http://agricultura.gencat.cat/, Fecha de consulta 01/01/2020) y Comunidad Valenciana (Generalitat Valenciana; http://www.agroambient.gva.es/, Fecha de consulta 01/01/2020), donde el ánade rabudo no es tan abundante, siguen permitiendo su caza (véase tamaño de la población: Invernada). Esta especie, principalmente es cazada al paso desde un puesto fijo en lagunas, embalses y marismas, en torno al amanecer y el crepúsculo (Real Federación Española de Caza; https://www.fecaza.com/, Fecha de consulta 01/01/2020). En algunas regiones como Extremadura no ha sido declarada cinegética en los últimos años (Junta de Extremadura; http://extremambiente.juntaex.es/, Fecha de consulta 01/01/2020), sin embargo, sí lo son otros ánades de superficie como el ánade azulón (Anas platyrhynchos), la cerceta común (Anas crecca) y el cuchara común (Spatula clypeata), por lo que es probable la caza de ánades rabudos por confusión, ya que las pobres condiciones de luz (véase arriba) dificultan que los cazadores sean capaces de distinguir entre las diferentes especies de ánades de superficie durante las tiradas. Según los resultados de Fouque et al., (2009) el ánade rabudo aumentó significativamente en número en las zonas protegidas con respecto a las zonas donde se practicaba la caza en distintos humedales de Francia durante el invierno, a diferencia de otras especies de ánades de superficie (cazables y protegidas) cuyas distribuciones entre las zonas de caza y las protegidas, no presentaban diferencias tan marcadas. Posiblemente se deba a que el ánade rabudo sea más sensible a las perturbaciones ocasionadas por la caza (Fouque et al., 2009). Además de en los lugares de invernada, la caza ilegal durante la migración de primavera supone una importante amenaza para la conservación del ánade rabudo en Europa (Parejo et al., 2015). La presión que la caza ejerce en los lugares de parada migratoria (Parejo et al., 2015) y en las principales poblaciones reproductoras europeas (Pöysä et al., 2013), tiene efectos negativos en la población, que unido a la mortalidad por causas naturales que la especie sufre a lo largo de la ruta migratoria puede ser también motivo del notable descenso poblacional del ánade rabudo (Pöysä et al., 2013; WWT, 2014). Cambio global Las modificaciones del paisaje ligadas a la historia de la humanidad, junto con los efectos globales del cambio climático, han provocado que los humedales sean hábitats amenazados y como consecuencia también lo sea la gran biodiversidad de especies que depende de ellos (Sebastián-González y Green, 2016; Ramírez et al., 2018). En los humedales numerosos factores como la salinidad, la profundidad del agua, el aislamiento de las zonas inundadas o el hidroperíodo, influyen directamente en la estructura de la comunidad y presencia de las diferentes especies de aves (Ramírez et al., 2018). Los efectos del cambio global alteran estas características de hábitats generando una distribución desigual de las especies de aves en función del uso y la selección de hábitat de cada una de éstas. Según los modelos de predicción obtenidos en humedales del suroeste de España por Ramírez et al. (2018), es la salinidad el principal condicionante que afecta a la distribución de los ánades de superficie, mientras que otros efectos como el aislamiento de las zonas inundadas no parece afectarles negativamente. Además el calentamiento global puede influir en la fenología y la distancia de migración, lo que afecta a los rangos de distribución geográfica y al éxito reproductor de los ánades de superficie (Guillemain et al., 2013). La disminución de la dureza de los inviernos a consecuencia del calentamiento global ha provocado que gran parte de la población europea de ánade rabudo adelante la fecha de partida de las áreas de invernada, lo que supone una llegada más temprana a las áreas de reproducción situadas en el noroeste de Europa; (Vähätalo et al., 2004; véase también Rainio et al., 2006; Parejo et al., 2015). Este hecho podría generar un desajuste entre el pico de disponibilidad de alimentos y el momento de la eclosión de los huevos, lo que puede afectar drásticamente al éxito reproductor de la especie (Thomas et al., 2001; Gaston et al., 2009), dada la importancia de los invertebrados emergentes en la dieta de pollos y adultos (véase Ecología trófica: Dieta; Dessborn et al., 2011).
Medidas de conservación El ánade rabudo cuenta con un Plan de Acción Europeo donde se describieron medidas de conservación y manejo a tomar en el período 2007-2009 y así revertir la tendencia poblacional negativa de la especie en Europa (European-Communities, 2007). Este plan se redactó con la intención de proponer nuevas versiones con objetivos revisados que tuvieran en cuenta los resultados alcanzados durante esa primera fase. Se dirigió a los Estados miembros de la Unión Europea (UE) con poblaciones reproductoras, de parada migratoria o de invernada de ánade rabudo. Cada estado debía decidir cómo implementar las medidas de gestión. El plan reconoce 10 objetivos, que se debían alcanzar en ese período de 3 años: (1) Erradicar la caza de esta especie en los Estados de la Unión Europea durante la migración de primavera y el final de la época de reproducción. (2) Estimar la población anual de la especie en los Estados miembros. (3) Restaurar y recuperar los lugares de reproducción en todos los Estados miembros donde esta especie hubiera desaparecido o estuviera en declive. (4) Identificar, conservar y realizar un uso racional de los humedales y otros hábitats donde el ánade rabudo se reproduce. (5) Designar todas las áreas de parada migratoria e invernada de importancia internacional para el ánade rabudo dentro de la Unión Europea como ZEPA (Zona de Especial Protección para las Aves). (6) Detener la degradación del hábitat y garantizar la disponibilidad de áreas de alimentación en las ZEPA de importancia internacional para la especie. (7) Establecer un mínimo de dos ZEPA de importancia internacional para la invernada y/o parada migratoria de la especie libres de perturbaciones en los Estados miembros pertinentes. (8) Llevar a cabo como parte del Censo Internacional de Aves Acuáticas, el censo anual de mediados de invierno de todas las áreas de invernada de importancia internacional para el ánade rabudo dentro de la UE, con el apoyo de las autoridades responsables de la Directiva de Aves en cada Estado Miembro. (9) Establecer un programa nacional de seguimiento para evaluar el éxito de la reproducción anual a finales del verano antes de la migración de otoño, en todos los Estados miembros con una importante población reproductora. (10) Establecer el deber de los Estados miembros con importantes poblaciones de ánade rabudo de respaldar los censos en las áreas de reproducción, parada migratoria e invernada y los análisis de los datos, para identificar las poblaciones y proporcionar estimaciones anuales de la mortalidad de dicha especie. Actualmente, este plan y el de otras 6 especies de aves consideradas cinegéticas y en situación desfavorable aparecen como vigentes y aprobados por los delegados en los Estados Miembros del Comité ORNIS y por ONGs como FACE (European Federation for Hunting and Conservation), BirdLife International, OMPO (Oiseaux Migrateurs du Palearctique Occidental) y Wetland International (European-Communities, 2007) https://ec.europa.eu/; Fecha de consulta 07/01/2020).
Referencias Amat, J. A. (1980). Biología y ecología de la comunidad de patos del Parque Nacional de Doñana. Tesis Doctoral. Universidad de Sevilla. Amat, J. A. (1981). Descripción de la comunidad de patos del Parque Nacional de Doñana. Doñana Acta Vertebrata 8: 125-158. Amat, J. A. (1982). The nesting biology of ducks in the Marismas of the Guadalquivir, southwestern Spain. Wildfowl,33: 94-104. Amat, J. A. (1984). Las poblaciones de aves acuáticas en las lagunas andaluzas: composición y diversidad durante un ciclo anual. Ardeola,31: 61-79. Amat, J. A., Díaz-Paniagua, C., Herrera, C. M., Jordano, P., Obeso, J. R., Soriguer, R. C. (1985). Criterios de valoración de zonas húmedas de importancia nacional y regional en función de las aves acuáticas. Monografías 35. ICONA, Madrid. Amat, J. A., Ferrer, X. (1988). Respuestas de los patos invernanates en España a diferentes condiciones ambientales. Ardeola, 35: 59-70. Arzel, C., Elmberg, J. (2004). Time use, foraging behavior and microhabitat use in a temporary guild of spring-staging dabbling ducks (Anas spp.). Ornis Fennica, 81: 157-168. Arzel, C., Elmberg, J., Guillemain, M. (2006). Ecology of spring-migrating Anatidae: a review. Journal of Ornithology 147: 167-184. Bernis, F. (1966). Aves Migradoras Ibéricas. Vol. I, Fascículos 1o-4o. Publicación Especial de la Sociedad Española de Ornitología, Madrid. Bernis, F. (1964). Información española sobre Anátidas y fochas (época invernal). Sociedad Española de Ornitología, Madrid. Beyer, W. N., Spann, J., Day, D. (1999). Metal and sediment ingestion by dabbling ducks. Science of the Total Environment, 231: 235-239. Bigas, D., Curcó, A. (2016). Anuari Ornitològic del delta de l'Ebre, 2014. Parc Natural del Delta de l'Ebre, Deltebre. Bigas, C., Curcó, A. (2018). Anuari Ornitològic del delta de l'Ebre, 2015. Parc Natural del Delta de l'Ebre, Deltebre. BirdLife International (2015). European red list of birds. Office for official publications of the European Communities, Luxembourg. BirdLife International (2017). European birds of conservation concern: populations, trends and national responsibilities. BirdLife International, Cambridge. BirdLife International (2020). IUCN Red List for birds. http://www.birdlife.org Bregnballe, T., Amstrup, O., Hom, T.E., Clausen, P., Fox, A.D., (2014). Skjern River Valley, Northern Europe's most expensive wetland restoration project: benefits to breeding waterbirds. Ornis Fennica 91, 231-243. Callaway, J. C., Delaune, R. D., Patrick, W. H. (1998). Heavy metal chronologies in selected coastal wetlands from northern Europe. Marine Pollution Bulletin,36: 82-96. Carboneras, C. (1992). Family Anatidae (ducks, geese and swans). Pp. 536-628. En: del Hoyo, J., Elliott, A., Sargatal, J. (Eds.). Handbook of the Birds of the World, vol. 1: Ostrich to Ducks. Lynx Edicions, Barcelona. Castrillo-Díaz, C. (1994). Toponimia del parque nacional de Doñana y su entorno (hidrónimos). Philologia Hispalensis, 9: 243-250. Chapman, A. (1888). Winter Notes in Spain. Ibis., 30: 444-461. Coronado, R., del Portillo, F., Sáez-Royuela, R. (1974). Guía de las anátidas en España. ICONA, Madrid. Cramp, S., Simmons, K. E. L. (1977). Handbook of the birds of Europe, the Middle East and North Africa : the birds of the Western Palearctic. Vol. 1: Ostrich to ducks. Oxford University Press, Oxford. De Juana, E., Garcia, E. (2015). The birds of the Iberian Peninsula. Christopher Helm, London. Dessborn, L., Brochet, A. L., Elmberg, J., Legagneux, P., Gauthier-Clerc, M., Guillemain, M. (2011). Geographical and temporal patterns in the diet of pintail Anas acuta, wigeon Anas penelope, mallard Anas platyrhynchos and teal Anas crecca in the Western Palearctic. European Journal of Wildlife Research,57: 1119–1129. Dolz-García, J. C., Gómez-López, J. A. (1988). Las anátidas y fochas invernantes en España. Pp. 55-70. En: Tellería, J.L . (Ed.). Invernada de Aves en la Penísula Ibérica. Monografías 35. ICONA, Madrid. EBD, PND (1996). (Equipo de seguimiento de los procesos naturales-Estación Biológica de Doñana (CSIC & Área de conservación del Parque Nacional de Doñana/OAPN). Informe Anual sobre Aves Acuáticas en las Marismas del Guadalquivir. Año Biológico 1995/1996. Informe inédito. EBD, PND (1997). (Equipo de seguimiento de los procesos naturales-Estación Biológica de Doñana (CSIC & Área de conservación del Parque Nacional de Doñana/OAPN). IInforme Anual sobre Aves Acuáticas en las Marismas del Guadalquivir. Año Biológico 1996/1997. Informe inédito. EBD, PND (1998). (Equipo de seguimiento de los procesos naturales-Estación Biológica de Doñana (CSIC & Área de conservación del Parque Nacional de Doñana/OAPN). Informe Anual sobre Aves Acuáticas en las Marismas del Guadalquivir. Año Biológico 1997/1998. Informe inédito. EBD, PND (2001). (Equipo de seguimiento de los procesos naturales-Estación Biológica de Doñana (CSIC & Área de conservación del Parque Nacional de Doñana/OAPN). Informe Anual sobre Aves Acuáticas en las Marismas del Guadalquivir. Año Biológico 2000/2001. Informe inédito. Elphick, C.S. (2015). A history of ecological studies of birds in rice fields. Journal of Ornithology, 156: 239-245. European-Communities (2007). Management plans for pintails (Anas acuta) 2007-2009. Office for Official Publications of the European Communities. Technical Report - 004 - 2007. Luxembourg. Ferrer, X. (1982). Invernada de anátidas en el delta del Ebro. Tesis Doctoral. Universidad de Barcelona. Fouque, C., Guilleman, M., Schricke, V. (2009). Trends in the numbers of Coot Fulica atra and wildfowl Anatidae wintering in France, and their relationship with hunting activity at wetland sites, Wildfowl,2: 42-59 Fox, T. (2005). Northern pintail Anas acuta. Pp. 595-599. En: Kear, J. (Ed.), Ducks, geese, and swans. Oxford University Press, Oxford and New York. Friend, M., Franson, J. C., Ciganovich, E. A. (1999). Field manual of wildlife diseases : general field procedures and diseases of birds. U.S. Dept. of the Interior, U.S. Geological Survey, Washington, D. C. Gaston, A. J., Gilchrist, H. G., Mallory, M. L., Smith, P. A. (2009). Changes in Seasonal Events, Peak Food Availability, and Consequent Breeding Adjustment in a Marine Bird: A Case of Progressive Mismatching. Condor,111: 111-119. Giménez-Ripoll, M. (2017). Seguimiento de la avifauna invernante en L'Albufera de Valencia. SEO/Birdlife, Madrid. Gómez-López, J. A., Díes-Jambrino, J. I., Vilalta-Vilanova, M. (2006). Las aves acuáticas de la Comunitat Valenciana, censos y evolución de las poblaciones (1984-2004). Conselleria de Territori i Habitatge, Generalitat Valenciana, Valencia. Gonzáles, R., Pérez-Aranda, D. (2011). La invernada de aves acuáticas en España, 1980-2009. SEO/Birdlife, Madrid. Guillemain, M., Hearn, R., King, R., Gauthier-Clerc, M., Simon, G., Caizergues, A. (2009). Differential migration of the sexes cannot be explained by the body size hypothesis in Teal. Journal of Ornithology, 150: 685-689. Guillemain, M., Pöysä, H., Fox, A. D., Arzel, C., Dessborn, L., Ekroos, J., Gunnarsson, G., Holm, T. E., Christensen, T. K., Lehikoinen, A., Mitchell, C., Rintala, J., Møller, A. P. (2013). Effects of climate change on European ducks: what do we know and what do we need to know? Wildlife Biology, 19: 404-419. Hall, S. L., Fisher, F. M. (1985). Heavy metal concentrations of duck tissues in relation to ingestion of spent shot. Bulletin of Environmental Contamination and Toxicology, 35: 163-172. Legagneux, P., Blaize, C., Latraube, F., Gautier, J., Bretagnolle, V. (2009). Variation in home-range size and movements of wintering dabbling ducks. Journal of Ornithology, 150: 183-193. Lehikoinen, A., Rintala, J., Lammi, E., Pöysä, H. (2016). Habitat-specific population trajectories in boreal waterbirds: alarming trends and bioindicators for wetlands. Animal Conservation,19: 88-95. Llorente, G. A., Farran, A., Ruiz, X., Albaigés, J. (1987). Accumulation and distribution of hydrocarbons, polychlorobyphenyls, and DDT in tissues of three species of Anatidae from the Ebro Delta (Spain). Archives of Environmental Contamination and Toxicology, 16: 563-572. Longoni, V., (2010). Rice wields and waterbirds in the Mediterranean region and the middle east. Waterbirds,33: 83-96. Madroño, A., González, C., Atienza, J. C. (2004). Libro Rojo de las Aves de España. Dirección General para la biodiversidad-SEO/BirdLife, Madrid. Máñez, M., Arroyo, J. L. (2014). Las aves acuáticas del censo aéreo. En: Román, J., Vilà, M. (Eds.), Censos aéreos de aves acuáticas en Doñana. Cuarenta años de seguimiento de procesos naturales. CSIC/Catarata, Madrid. Mañosa, S., Mateo, R., Guitart, R., (2001). A Review of the Effects of Agricultural and Industrial Contamination on the Ebro Delta Biota and Wildlife. Environmental Monitoring and Assessment,71: 187-205. MAPAMA (2017). Superficies y producciones anuales de cultivos. http://www.mapama.gob.es Martí, R., Del Moral, J. C. (2003). La Invernada de Aves Acuáticas en España. Dirección General de Conservación de la Naturaleza-SEO/Birdlife. Ed. Organismo Autónomo Parque Nacionales, Serie Técnica. Ministerio de Medio Ambiente, Madrid. Martínez-Abraín, A. (1999). Patrones de asociaciones de anátidas durante la invernada en un dormidero del este de España. Ardeola, 46: 163-169. Mateo, R. (2009). Lead poisoning in wild birds in Europe and the regulations adopted by different countries. Pp. 71-98. En: Watson, R. T., Fuller, M., Pokras, M., Hunt, W. G. (Eds.). Ingestion of Lead from Spent Ammunition: Implications for Wildlife and Humans. The Peregrine Fund, Idaho. Mateo, R., Guitart, R. (2003). Heavy Metals in Livers of Waterbirds from Spain. Archives of Environmental Contamination and Toxicology,44: 398-404. Mateo, R., Guitart, R. (2000). The effects of grit supplementation and feed type on steel-shot ingestion in Mallards. Preventive Veterinary Medicine,44: 221-229. Mateo, R., Guitart, R., Green, A. J. (2000). Determinants of lead shot, rice, and grit ingestion in ducks and coots. Journal of Wildlife Management,64: 939-947. Mateo, R., Martínez-Vilalta, A., Guitart, R. (1997). Lead shot pellets in the Ebro delta, Spain: Densities in sediments and prevalence of exposure in waterfowl. Environmental Pollution,96: 335-341. Molina, B., (2009). Ánade rabudo. Pp. 49-51. En: Palomino, D., Molina, B. (Eds.). Aves acuáticas reproductoras en España. Población en 2007 y método de censo. SEO/BirdLife, Madrid. Molina, B., Máñez, M., Ibáñez, F. (2003). Ánade Rabudo. Pp. 138-139. En: Martí, R., del Moral, J. C. (Eds.). Atlas de las Aves Reproductoras de España. Ministerio de Agricultura, Alimentación y Medio Ambiente-SEO/ BirdLife, Madrid. Molina, B., Prieta, J. (2012). Ánade rabudo. Pp. 86-87. En: del Moral, J. C., Molina, B., Bermejo, A., Palomino, D. (Eds.), Atlas de las aves en invierno en España 2007-2010. Ministerio de Agricultura, Alimentación y Medio Ambiente-SEO/ BirdLife, Madrid,. Mountfort, G., Ferguson-Lees, I. J. (1961). Birds of the Coto Doñana. Ibis,103: 86-109. Mulhern, J. H., Nudds, T. D., Neal, B. R. (1985). Wetland selection by Mallards and Blue-Winged Teal. Wilson Bulletin,97: 473-485. Mundkur, T., Nagy, S. (2012). Waterbird Population Estimates, Fifth edit. Wetlands International, Wageningen, The Netherlands. Navarro-Medina, J. D., Navarro-García, J. (1982). La avifauna de los embalses de El Hondo (Alicante). Mediterránea,6: 109-140. Navedo, J. G., Masero, J. A., Sánchez-Guzmán, J. M., Abad-Gómez, J. M., Gutiérrez, J. S., Sansón, E. G., Villegas, A., Costillo, E., Corbacho, C., Morán, R. (2012). International importance of Extremadura, Spain, for overwintering migratory dabbling ducks: a role for reservoirs. Bird Conservation International,22: 316-327. Noble, H. (1902). V.-Forty-four Days' Nesting in Andalucia. Ibis, 44: 67-89. Pain, D. J., Mateo, R., Green, R. E. (2019). Effects of lead from ammunition on birds and other wildlife: A review and update. Ambio,48: 935-953. Parejo, M. (2018). Papel de las poblaciones de aves acuáticas en humedales antrópicos del sur de Europa: Ecología de las anátidas migratorias de largas distancias invernantes en Extremadura. Tesis Doctoral. Universidad de Extremadura. Parejo, M., Gutiérrez, J. S., Navedo, J. G., Soriano-Redondo, A., Abad-Gómez, J. M., Villegas, A., Corbacho, C., Sánchez-Guzmán, J. M., Masero, J. A. (2019). Day and night use of habitats by northern pintails during winter in a primary rice-growing region of Iberia. PLoS One,14: e0220400. Parejo, M., Navedo, J. G., Gutiérrez, J. S., Abad-Gómez, J. M., Villegas, A., Corbacho, C., Sánchez-Guzmán, J. M., Masero, J. A. (2015). Geographical origin of dabbling ducks wintering in Iberia: Sex differences and implications for pair formation. Ibis, 157: 536-544. Pernollet, C. A., Guelmami, A., Green, A.J., Curcó, A., Dies, B., Bogliani, G., Tesio, F., Brogi, A., Gauthier-Clerc, M., Guillemain, M. (2015). A comparison of wintering duck numbers among European rice production areas with contrasting flooding regimes. Biological Conservation,186: 214-224. Pöysä, H., Rintala, J., Lehikoinen, A., Väisänen, R. A. (2013). The importance of hunting pressure, habitat preference and life history for population trends of breeding waterbirds in Finland. European Journal of Wildlife Research,59: 245-256. Provencher, J. F., Forbes, M. R., Hennin, H. L., Love, O. P., Braune, B. M., Mallory, M. L., Gilchrist, H. G. (2016). Implications of mercury and lead concentrations on breeding physiology and phenology in an Arctic bird. Environmental Pollution, 218: 1014-1022. Purroy, F. J. (1997). Atlas de las Aves de España (1975-1995). SEO/BirdLife, Lynx Edicions, Barcelona. Rainio, K., Laaksonen, T., Ahola, M., Vahatalo, A. V, Lehikoinen, E. (2006). Climatic responses in spring migration of boreal and arctic birds in relation to wintering area and taxonomy.Journal of Avian Biology, 37: 507-515. Ramírez, F., Rodríguez, C., Seoane, J., Figuerola, J., Bustamante, J. (2018). How will climate change affect endangered Mediterranean waterbirds? PLoS One, 13: e0192702. Rendón, M. A., Green, A. J., Aguilera, E., Almaraz, P. (2008). Status, distribution and long term changes in the waterbird community wintering in Doñana, south-west Spain. Biological Conservation, 141: 1371-1388. Robertson, G. J., Cooke, F. (1999). Winter Philopatry in Migratory Waterfowl. Auk,116: 20-34. Sanderson, G. C., Bellrose, F. C. (1986). A review of the problem of lead poisoning in waterfowl. Natural History Survey Special Publicaton, Illinois. Scott, D. A., Rose, P. M. (1996). Atlas of Anatidae Populations in Africa and Western Eurasia. Wetlands International. Sebastián-González, E., Green, A. J. (2016). Reduction of avian diversity in created versus natural and restored wetlands. Ecography,39: 1176-1184. Tamisier, A., Grillas, P. (1994). A review of habitat changes in the Camargue: An assessment of the effects of the loss of biological diversity on the wintering waterfowl community. Biological Conservation, 70: 39-47. Thomas, D. W., Blondel, J., Perret, P., Lambrechts, M. M., Speakman, J. R. (2001). Energetic and fitness costs of mismatching resource supply and demand in seasonally breeding birds. Science,291: 2598-600. Tourenq, C., Bennetts, R. E., Kowalski, H., Vialet, E., Lucchesi, J. L., Kayser, Y., Isenmann, P. (2001). Are ricefields a good alternative to natural marshes for waterbird communities in the Camargue, southern France? Biological Conservation,100: 335-343. Comité Español de la UICN (2015). Análisis de las especies en Lista roja de la UICN en España: una llamada urgente a la acción. Vähätalo, A. V, Rainio, K., Lehikoinen, A., Lehikoinen, E. (2004). Spring arrival of birds depends on the North Atlantic Oscillation. Journal of Avian Biology,35: 210-216. Valverde, J. A. (1960). Vertebrados de las Marismas del Guadalquivir: introducción a su estudio ecológico. Archivos del Instituto de Aclimatación de Almería 9: 1-168. Velasco, T. (2002). Aves acuáticas nidificantes en los humedales de la provincia de Ciudad Real. Año 1998. Anuario Ornitológico Ciudad Real 1995-2001: 35-50. Velasco, T. (1999). La mancha húmeda en 1997 situación de su avifauna acuática. En: Otero, C. (Ed.). Patrimonio natural y propiedad rural en España. Exlibris Ediciones, S. L., Madrid. WWT (2014). Pintail decline rings alarm bells. Wildfowl Wetlands Trust. Zwarts, L., Bijlsma, R. G., van Der Kamp, J., Wymenga, E. (2009). Living on the Edge: wetlands and birds in a changing Sahel. KNNV Publishing, Zeist, The Netherlands.
Manuel Parejo Fecha de publicación: 24-07-2020 Parejo, M. (2020). Ánade rabudo – Anas acuta. En: Enciclopedia Virtual de los Vertebrados Españoles. López, P., Martín, J., Amat, J. A. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
|
|||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||