|
|
|
|
|
|
Para más información sobre cada apartado hacer click en:
|
Key words: Yellow-necked Mouse, identification, description, size, variation. Origen y evolución El ratón leonado es un micromamífero perteneciente al orden Rodentia, familia Muridae, subfamlia Murinae y género Apodemus Kaup, 1829. El género Apodemus parece estar más próximo al género Tokudaia que a los géneros Mus, Rattus o Micromys (Michaux et al., 2002), y consta de 15 especies (Liu et al. 2004) ampliamente distribuidas por el mundo. Las especies del género Apodemus pueden clasificarse en dos subgrupos: el Apodemus, que incluiría a A. agrarius, A. semotus y A. peninsulae y el subgrupo Sylvaemus que englobaría A. uralensis, A. flavicollis, A. alpicola, A. sylvaticus y A. hermonensis. Siendo la posición de A. mystacinus ambigua, ya que podría incluirse en Sylvaemus o en un subgénero diferente, Karstomys (Michaux et al., 2002). La separación entre estos grupos taxonómicos (Apodemus y Sylvaemus) parece que ocurrió hace 7 u 8 millones de años, y dentro de cada subgénero alrededor de 5.4-6 m.a. en el caso de Apodemus y 2.2-3.5 en las especies del subgénero Sylvaemus (Michaux et al., 2002). En la península ibérica habitan dos especies con una elevada similitud morfológica: el ratón leonado (Apodemus flavicollis Melchior, 1834) y el ratón de campo (Apodemus sylvaticus Linnaeus, 1758), sus características externas tan parecidas hacen que la diferenciación solo sea posible a través de técnicas bioquímicas, genéticas y de análisis morfométrico (Britton-Davidian et al., 1991; Arrizabalaga et al., 1999; Michaux et al., 2001; Torre et al., 2002; Çolak, 2006; Sozio et al., 2018). Ambas especies pertenecen al subgénero Sylvaemus (Michaux et al., 2002; Hoofer et al., 2007) y solo comparten distribución en el tercio norte peninsular (Arrizabalaga y Torre, 2007). En España, A. sylvaticus se cita desde finales del Plioceno y Pleistoceno Inferior, y A. flavicollis aparece desde el final del Pleistoceno Inferior (Sesé, 1994; Sesé y Sevilla, 1996). A pesar del alto grado de similitud morfológica, las dos especies poseen una historia filogeográfica muy diferente. Durante la última glaciación del cuaternario, el ratón leonado se extinguió en la península ibérica, parece ser que debido a la pérdida de masa forestal y a la baja supervivencia que muestra esta especie durante la climatología adversa del invierno (Michaux et al., 2005), mientras que A. sylvaticus sobrevivió y recolonizó casi toda Europa, probablemente debido a una mayor plasticidad de la especie (Michaux et al., 2005). Por el contrario, las poblaciones de A. flavicollis que sobrevivieron a la glaciación se localizaban en los Balcanes e Italia, parte de Italia, en Turquía y Oriente próximo. Fue desde las poblaciones relictas de los Balcanes desde donde recolonizó Europa tras la última glaciación (Michaux et al., 2004; Michaux et al., 2005).
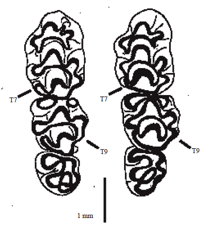
Descripción Se trata de un micromamífero muy similar al ratón de campo, pero algo más grande que este (Arrizabalaga y Torre, 2007), sobre todo las orejas y la cola (Rodríguez, 1993). El pelaje es de color pardo-rojizo en la zona dorsal y blanco puro en la ventral. Presenta una mancha ocre pectoral que a veces llega a rodear el cuello formando un collar (Blanco, 1998; Arrizabalaga y Torre, 2007). La cola es larga y ancha en su base, con entre 170-230 anillos (Van den Brink y Barruel, 1971; Schilling et al., 1987; Arrizabalaga y Torre, 2007), está finamente recubierta de pelos y presenta un patrón de bicolor con la parte dorsal oscura y la ventral clara (Blanco, 1998), presentando glándulas exocrinas en el tercio proximal (Stoddart, 1973). Los individuos juveniles y subadultos son más oscuros y grisáceos en su dorso. Pueden distinguirse del género Mus a través de la longitud del pie, que es siempre superior a 20 mm (Arrizabalaga y Torre, 2007). No presenta dimorfismo sexual. Las hembras poseen tres pares de mamas: uno pectoral y dos inguinales. Fórmula dentaria: 1.0.0.3/1.0.0.3. Ausencia del tubérculo 9 del M2 y con un tubérculo 7 bien desarrollado en el M1. El género Apodemus presenta normalmente un número diploide de cromosomas, A. flavicollis presentan 48 cromosomas acrocéntricos (2n = 48) (Yalkovskaya et al., 2018), habiéndose encontrado cromosomas supernumerarios en algunas poblaciones europeas (Britton-Davidian et al., 1991; Nadjafova et al., 1993; Zima y Macholán, 1995; Ramalhinho y Libois, 2002). En Polonia, diferentes tejidos de A. flavicollis han sido estudiados mediante cromatografía para determinar su contenido en carotenoides. Se han descrito 10 carotenoides diferentes en el caso de los machos y hasta 14 en el caso de las hembras. Los compuestos predominantes fueron el β-caroteno y la astaxantina, y los exclusivos de las hembras fueron α-caroteno, luteína, isozeaxantina, violaxantina y criptoflavina (Czeczuga y Malzahn, 1980).
Diferencias entre A. flavicollis y A. sylvaticus Existen algunos caracteres morfométricos que diferencian al ratón leonado del ratón de campo. Ambos presentan molares de tipo tubercular y la misma fórmula dentaria, sin embargo A. flavicollis presenta los tubérculos cuatro y siete del primer molar separados y el tubérculo nueve del segundo molar ausente o muy reducido. En A. sylvaticus, los tubérculos cuatro y siete se encuentran casi unidos y el nueve bien desarrollado (Pasquier, 1974; Arrizabalaga et al., 1999; Torre et al., 2015).
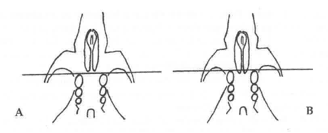
Ceña, 2004 propone un nuevo criterio para separar A. flavicollis y A. sylvaticus: la posición relativa del borde posterior del foramen palatino respecto a una línea teórica que uniría el borde anterior del primer molar superior. Si el borde del foramen se sitúa a nivel o por encima de dicha línea se trataría de ratón leonado, mientras que si desciende bajo ella es un ratón de campo (Fig. 2).
Figura 2. Vista ventral del cráneo de (A) Apodemus flavicollis y (B) Apodemus sylvaticus. Se aprecia la posición relativa del foramen palatino respecto a una línea teórica que pase junto al borde anterior de los primeros molares, y que permite diferenciar ambas especies (Ceña, 2004).
En poblaciones de la República Checa, las medidas craneales han demostrado ser un criterio eficaz (98.3% de precisión) para discriminar entre ambas especies. En concreto, las medidas comparadas fueron la longitud condilobasal (CBL), la longitud de la bula timpánica (BUL) y la longitud de la línea dentaria inferior (Barciová y Macholán, 2009):
Según estudios llevados a cabo en Italia, el ratón leonado muestra un mayor peso y mayor longitud de los pies traseros que el ratón de campo, pudiendo estos caracteres ayudar a la separación entre ambas especies en condiciones de campo. No obstante, la eficacia de estos predictores varía según la época del año (Bartolommeiet al., 2016). - A. flavicollis: P: 26.3 ± 7.0 g; Pie: 23.2 ± 1.1 mm - A. sylvaticus: P: 22.4 ± 5.9 g; Pie: 21.5 ± 1.2 mm (Bartolommeiet al., 2016). Estudios histológicos del encéfalo de A. flavicollis y A.sylvacitus llevados a cabo en Dinamarca hallaron asimetrías solo en el caso de A. flavicollis, concretamente en la zona del hipocampo denominada subículo, que resultó ser mayor en el hemisferio izquierdo (Slomianka y West, 1987). En Italia, se ha podido discriminar con éxito entre A. sylvaticus y A. flavicollis mediante técnicas bioacústicas analizando el sonido que emiten los individuos durante la captura y manipulación (Ancillotto et al., 2017)
Tamaño y masa corporal CC: 85,0-130,0 mm; C: 90,0-135,0 mm; P: 22,0-27,0 mm; O: 16,0-19,0 mm (Van den Brink y Barruel, 1971; Blanco, 1998; Arrizabalaga y Torre, 2007). Masa corporal: 20,0-50,0 g (Arrizabalaga y Torre, 2007). En Navarra, los machos juveniles pesaron entre 9,0 y 33,0 g, los machos subadultos entre 20,3 y 34,0 g y los machos adultos 21,0-37,5 g. Durante el invierno, los machos juveniles alcanzaron una masa corporal elevada mientras que en verano solo los machos adultos presentaron una masa corporal superior a 20 g. En el caso de las hembras, los ejemplares inmaduros tuvieron un peso entre 11,1 y 25,2 g, mientras que las adultas pesaron más de 18,8 g. La hembra adulta no gestante con mayor masa corporal fue de 35,6 g (Gosálbez y Castién, 1995). En Suecia también se detectaron diferencias importantes en el peso entre hembras (27,0 ± 1,37 g) y machos (34.7 ± 1,57 g) (Bergstedt, 1965). En Italia, se detectó una disminución de la masa corporal durante la segunda mitad de la temporada reproductora, probablemente explicada por la captura de las primeras crías de ese año (Stradiotto, 2008).
Variación geográfica El ratón leonado parece presentar cierta tendencia al incremento de tamaño con la latitud de acuerdo con la regla de Bergmann, mientras que en el ratón de campo, por el contrario, el tamaño parece disminuir con la latitud, de ahí que en las poblaciones del norte de la península ambas especies muestren un tamaño similar, dificultándose la diferenciación por su tamaño (Alcántara, 1991; Blanco, 1998; Arrizabalaga y Torre, 2007). La variación geográfica de A. flavicollis en Europa ha sido revisada por Ursin (1956), encontrándose diferencias significativas entre poblaciones diferentes pero sin hallar un patrón claro a gran escala en cuanto a caracteres morfométricos. Lo que sí parece presentar variación geográfica es la mancha pectoral, apareciendo como un collar completo y más prolongado caudalmente en las poblaciones del norte de Europa mientras que en el centro y sureste dicho collar suele encontrarse reducido a una simple mancha pectoral. Pueden encontrarse formas intermedias con el collar menos ancho y la mancha pectoral más pequeña, como sucedería en poblaciones de Dinamarca y Estonia.
Referencias Alcántara, M. (1991). Geographical variation in body size of the wood mouse Apodemus sylvaticus L. Mammal Review, 21 (3): 143-150. Ancillotto, L., Mori, E., Sozio, G., Solano, E., Bertolino, S., Russo, D. (2017). A novel approach to field identification of cryptic Apodemus wood mice: calls differ more than morphology. Mammal Review, 47 (1): 6-10. Arrizabalaga, A., Torre, I. (2007). Apodemus flavicollis (Melchior, 1834). Pp. 445-448. En: Palomo, L. J., Gisbert, J., Blanco, J. C. (eds). Atlas y Libro Rojo de los Mamíferos Terrestres de España. Dirección General para la Biodiversidad -SECEM-SECEMU, Madrid. Arrizabalaga, A., Torre, I., Catzeflis, F., Renaud, F., Santalla, F. (1999). Primera citació d’Apodemus flavicollis (Melchior, 1834) al Montseny. Determinació morfològica i genètica. III i IV Trobada d’Estudiosos del Montseny, Diputació de Barcelona: 193-195. Barciová, L., Macholán, M. (2009). Morphometric key for the discrimination of two wood mice species, Apodemus sylvaticus and A. flavicollis. Acta Zoologica Academiae Scientiarum Hungaricae, 55 (1): 31-38. Bartolommei, P., Sozio, G., Bencini, C., Cinque, C., Gasperini, S., Manzo, E., Prete, S., Solano, E., Cozzolino, R., Mortelliti, A. (2016). Field identification of Apodemus flavicollis and Apodemus sylvaticus: a quantitative comparison of different biometric measurements. Mammalia, 80 (5): 541-547. Bergstedt, B. O. (1965). Distribution, reproduction, growth and dynamics of the rodent species Clethrionomys glareolus (Schreber): Apodemus flavicollis (Melchior) and Apodemus sylvaticus (Linne) in southern Sweden. Oikos, 16 (1-2): 132-160. Blanco, J. C. (1998). Mamíferos de España. Vol. 2. Planeta, Barcelona. Britton-Davidian, J., Vahdati, M., Benmehdi, F., Gros, P., Nancé, V., Croset, H., Guerassimov, S., Triantaphyllidis, C. (1991). Genetic differentiation in four species of Apodemus from southern Europe: A. sylvaticus, A. flavicollis, A. agrarius and A. mystacinus (Muridae, Rodentia). Zeitschrift für Säugetierkunde, 56 (1): 25-33. Ceña, A. (2004). Distribución y determinación del ratón leonado Apodemus flavicollis (Melchior, 1834) en La Rioja. Galemys, 16 (1): 65-68. Çolak, R. (2006). Importance of superoxide dismutase in distinguishing Apodemus flavicollis and Apodemus sylvaticus (Mammalia: Rodentia) in Thrace. Pakistan Journal of Biological Sciences, 9 (11): 2153-2155. Czeczuga, B., Malzahn, E. (1980). Carotenoid contents in mammals I. Apodemus flavicollis and Clethrionomys glareolus. Acta Theriologica, 25: 501-509. Gosálbez, J., Castién, E. (1995). Reproductive cycle, abundance and population structure of Apodemus flavicollis (Melchior, 1834) in the western Pyrenees. Mammalia, 59 (3): 385-396. Hoofer, S. R., Gaschak, S., Dunina-Barkovskaya, Y., Makluk, J., Meeks, H. N., Wickliffe, J. K., Baker, R. J. (2007). New information for systematics, taxonomy, and phylogeography of the rodent genus Apodemus (Sylvaemus) in Ukraine. Journal of Mammalogy, 88 (2): 330-342. Liu, X., Wei, F., Li, M., Jiang, X., Feng, Z., Hu, J. (2004). Molecular phylogeny and taxonomy of wood mice (genus Apodemus Kaup, 1829) based on complete mtDNA cytochrome b sequences, with emphasis on Chinese species. Molecular Phylogenetics and Evolution, 33 (1): 1-15. Michaux, J. R., Chevret, P., Filippucci, M. G., Macholan, M. (2002). Phylogeny of the genus Apodemus with a special emphasis on the subgenus Sylvaemus using the nuclear IRBP gene and two mitochondrial markers: cytochrome b and 12S rRNA. Molecular Phylogenetics and Evolution, 23 (2): 123-136. Michaux, J. R., Kinet, S., Filippucci, M. G., Libois, R., Besnard, A., Catzeflis, F. (2001). Molecular identification of three sympatric species of wood mice (Apodemus sylvaticus, A. flavicollis, A. alpicola) in western Europe (Muridae: Rodentia). Molecular Ecology Notes, 1 (4): 260-263. Michaux, J.R., Libois, R., Filipucci, M.G. (2005). So close and so different: comparative phylogeography of two small mammal species, the yellow-necked fieldmouse (Apodemus flavicollis) and the woodmouse (Apodemus sylvaticus) in the Western Paleartic region. Heredity, 94: 52-63. Michaux, J. R., Libois, R., Paradis, E., Filippucci, M. G. (2004). Phylogeographic history of the yellow-necked fieldmouse (Apodemus flavicollis) in Europe and in the Near and Middle East. Molecular Phylogenetics and Evolution, 32 (3): 788-798. Nadjafova, R. S., Bulatova, N. S., Chasovlikarova, Z., Gerassimov, S. (1993). Karyological differences between two Apodemus species in Bulgaria. Zeitschrift für Säugetierkunde, 58: 232-232. Pasquier, L. (1974). Dynamique evolutive d'un sousgenre de Muridae, Apodemus (Sylvaemus). Étude biomètrique des caractères dentaires de populations fossiles et actuelles d'Europe occidentale. Thèse 3ème Cycle, Université de Montpellier. Ramalhinho, M. G., Libois, R. (2002). First report on the presence in France of a B-chromosome polymorphism in Apodemus flavicollis. Mammalia, 66 (2): 300-303. Rodríguez, J. L. (1993). Guía de campo de los mamíferos terrestres de España. Omega, Barcelona. Schilling, D., Singer, D., Diller, H. (1987). Guía de los mamíferos: 181 especies de Europa. Omega, Barcelona. Sesé, C. (1994). Paleoclimatical interpretation of the Quaternary small mammals of Spain. Geobios, 27 (6): 753-767. Sesé, C., Sevilla, P. (1996). Los micromamíferos del Cuaternario peninsular español: Cronoestratigrafía e implicaciones bioestratigráficas. Revista Española de Paleontología, Nº Extraordinario: 278-287. Slomianka, L., West, M. J. (1987). Asymmetry in the hippocampal region specific for one of two closely related species of wild mice. Brain Research, 436 (1): 69-75. Sozio, G., Curini, V., Pascucci, I., Cammà, C., Di Domenico, M. (2018). A new fast real-time PCR method for the identification of three sibling Apodemus species (A. sylvaticus, A. flavicollis, and A. alpicola) in Italy. Ecology and Evolution, 8 (10): 4807-4814. Stoddart, D. M. (1973). Preliminary characterisation of the caudal organ secretion of Apodemus flavicollis. Nature, 246 (5434): 501. Stradiotto, A. (2008). Spatial behaviour of the yellow-necked mouse (Apodemus flavicollis, Melchior 1834) at contrasting population density and resource availability. Doctoral dissertation, Università degli Studi di Parma. Torre, I., Arrizabalaga, A., Díaz, M. (2002). Ratón de campo (Apodemus sylvaticus Linnaeus, 1758). Galemys, 14 (2): 1-26. Torre, I., Fernández, L., Arrizabalaga, A. (2015). Using barn owl Tyto alba pellet analyses to monitor the distribution patterns of the yellow-necked mouse (Apodemus flavicollis Melchior 1834) in a transitional Mediterranean mountain. Mammal Study, 40 (3): 133-143. Ursin, E. (1956). Geographical Variation in Apodemus sylvaticus" and A. flavicollis (Rodentia, Muridae)" in Europe, with special reference to Danish and Latvian populations. Biologiske Skrifter, Det Kongelige Danske Videnskabernes Selskab, 8 (4): 1-46. Van den Brink, F. H., Barruel, P. (1971). Guía de campo de los mamíferos salvajes de Europa Occidental. Omega. Barcelona. Yalkovskaya, L. E., Sibiryakov, P. A., Zykov, S. V. (2018). Genetic Variability in the Yellow-Necked Field Mouse (Sylvaemus flavicollis Melch., 1834, Muridae, Rodentia) at the Eastern Border of the Range. Russian Journal of Genetics, 54 (6): 643-651. Zima, J., Macholán, M. (1995). B chromosomes in the wood mice (genus Apodemus). Acta Theriologica, 3: 75-86.
Mª Carmen Hernández Fecha de publicación: 10-04-2019 Hernández, M. C (2019). Ratón leonado – Apodemus flavicollis. En: Enciclopedia Virtual de los Vertebrados Españoles. López, P., Martín, J., Barja, I. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http: //www.vertebradosibericos.org/
|
|
|
|
|
|
|