|
|
|
|
|
|
Para más información sobre cada apartado hacer click en:
|
Key words: Balearic Shearwater, habitat, abundance, status, threats.
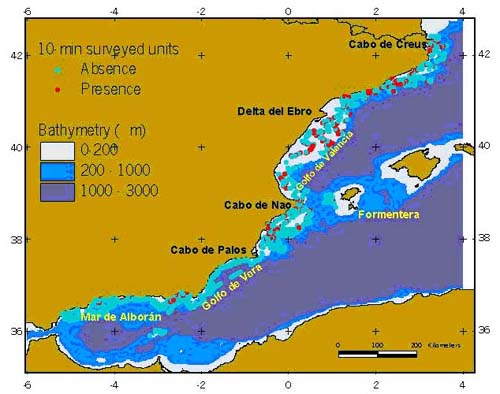
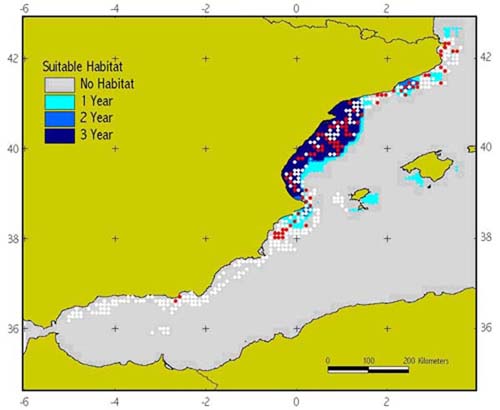
Hábitat El hábitat de la pardela balear en particular, y las aves marinas en general, se podría dividir en el hábitat de nidificación y el de alimentación, tanto durante el periodo reproductor como el no reproductor. Hábitat de nidificación La Pardela Balear nidifica en grietas, cuevas y agujeros, formando colonias relativamente pequeñas, desde una sola pareja aislada a cuevas que suelen albergar varias parejas, a diferentes alturas sobre el nivel del mar, que incluyen nidos a bastante altura en los acantilados de gran tamaño (Ruiz y Martí, 2004). Las colonias de cría se localizan en tramos de acantilado rocoso de todo el litoral balear, no sólo en islotes sino también en las grandes islas como Formentera, Mallorca o Menorca, aunque existen también citas de nidificación tierra adentro (de hasta 500 m de la costa) en Eivissa y Cabrera (Alcover et al., 1994; Aguilar, 2000; Arcos y Oro, 2004). Es muy posible, atendiendo a los restos fósiles de especies ancestrales, que las pardelas nidificaran en muchas zonas de las islas principales, no únicamente en las costas acantiladas sino incluso en playas y en el interior. Las pardelas pueden nidificar sobre sustrato duro o blando (en ocasiones llegando a excavar ligeramente) y aportan pequeñas piedras, huesos u objetos que encuentran en las cercanías. Hábitat de alimentación En el mar, su hábitat oceanográfico está asociado a aguas costeras de la plataforma continental (profundidades menores de 200 m, Figura 1) caracterizado por sistemas de frentes oceanográficos en áreas cercanas a las colonias de cría, en la franja latitudinal de 38º - 42º N (Louzao et al., 2004, 2006). Los frentes oceanográficos son zonas de interfase de masas de agua de diferentes características donde se pueden agregar los organismos marinos, tanto las presas como sus depredadores. Las zonas en donde las pardelas se alimentan con mayor frecuencia son las de la bahía de Palma, la zona del Delta del Ebro y los alrededores del cabo de la Nao (Figura 2).
Figura 1. Distribución de la Pardela Balear (Puffinus mauretanicus) durante el período reproductivo, en la que se observa una mayor frecuencia de pardelas en zonas con una profundidad inferior a los 200 m, con independencia de la distancia a la costa (Louzao et al., 2006).
Figura 2. Los puntos rojos indican presencia de pardelas en alguno de los años de muestreo y los puntos blancos indican ausencia. Las zonas se colorean según las predicciones del modelo espacial: las áreas grises son áreas no aceptables en ninguno de los 3 años de estudio, mientras que las áreas azules son las seleccionadas por la pardelas según si lo han sido uno, dos o los tres años de estudio, según la intensidad de azul. Se observa una mayor frecuencia de uso en las zonas del Delta del Ebro y los alrededores del cabo de la Nao (Louzao et al., 2006).
Durante la época de reproducción se alimentan en las zonas productivas más próximas a los sitios de nidificación (cabo de Creus, delta del Ebro y cabo de la Nao) (Louzao et al., 2011)1. Vuelan siguiendo un corredor relativamente estrecho hacia zonas neríticas de la plataforma continental de la Península Ibérica, preferentemente a distancias de la costa menores de 20 km. Durante cada travesía recorren entre 203 y 2.109 km, con una duración de entre 15,6 h y 309,2 h (Meier et al., 2015)1. A finales de la época de reproducción se alimenta también a lo largo de la costa norteafricana, especialmente en el oeste de Argelia y noreste de Marruecos (Louzao et al., 2012)1. Por el hecho de frecuentar zonas de alta productividad marina y sus hábitos tróficos oportunistas, se la encuentra asociada a los pesqueros, principalmente a los arrastreros que suelen descartar grandes cantidades de comida (Arcos y Oro, 2002b).
Tamaño de población Aguilar González (1997b) estimó las poblaciones de pardela balear en 3.300-5000 parejas1. La estima realizada en 2005 calculó en 2.000-2.400 el número de parejas reproductoras, con 350-550 parejas en Mallorca, 50-100 parejas en Cabrera, 100-175 parejas en Menorca, 200-300 parejas en Ibiza y menos de 1.000 parejas en Formentera (Rodríguez-Molina y Mc-Minn-Grivé, 2005). Las poblaciones de pardela balear fueron estimadas en 2011 en 3.193 parejas, de ellas 900 parejas en Mallorca, 449 parejas en Cabrera, 405 parejas en Menorca, 747 parejas en Ibiza y 692 parejas en Formentera (Arcos 2011)1. Censos realizados desde barcos a lo largo de la plataforma continental de la Península Ibérica durante el periodo 2003-2005 y censos realizados desde tierra en el Estrecho de Gibraltar durante el periodo 2007-2010 dan una estima de población consistente entre años de unas 25.000 aves (Arcos et al., 2012; Arroyo et al., 2016)1.
Estado de conservación Categoría global IUCN (2015): CR A4bcde (BirdLife International, 2015)1; En Peligro Crítico A4bce (Birdlife International, 2008). Categoría España IUCN (2004): En Peligro Crítico; CR A3ace+4ace; B2ab(ii,iii,iv,v); E (Arcos y Oro, 2004). Se justifica su inclusión en esta categoría por su pequeña área de reproducción, tamaño pequeño de población y rápido declive, sobre todo por depredación en las colonias de reproducción por mamíferos introducidos y mortalidad en el mar debida a la presión pesquera, especialmente palangres. Se ha estimado una probabilidad de extinción superior al 50% en las próximas tres generaciones (unos 54 años) (Arcos y Oro, 2004; Birdlife International, 2008). Un estudio más reciente predice un tiempo para la extinción en 61 años (intervalo de confianza 95%: 55-69) (Genovart et al., 2016)1.
Factores de amenaza Las aves marinas son los únicos depredadores marinos que sufren amenazas tanto en el ecosistema marino como en el terrestre, principalmente de origen antropogénico. Así, en las colonias de cría el consumo humano, el uso y la modificación del hábitat de nidificación y las especies introducidas son las mayores amenazas para la pardela balear, mientras que en el mar la pesca y la contaminación son los aspectos más relevantes en cuanto a su conservación. Al igual que otras especies longevas, la mortalidad adulta es el parámetro demográfico que más afecta a la tasa de crecimiento poblacional. Por tanto, la identificación de los factores que afectan negativamente la supervivencia adulta y el diseño e implementación de medidas correctoras efectivas deben ser actuaciones prioritarias en las estrategias y programas de conservación para garantizar la viabilidad de la pardela balear. Sin embargo, amenazas que afectan directamente al éxito reproductor, así como amenazas indirectas para la especie, también pueden ser importantes a largo plazo (Arcos y Oro, 2004). En las colonias de cría, la recolección de pollos y adultos para consumo humano y la pérdida y degradación del hábitat eran las causas principales del fuerte declive y extinción local de algunas poblaciones de pardela balear hasta hace pocas décadas (Aguilar, 1997; Mayol et al., 2000). La distribución actual de las colonias de pardela balear está probablemente condicionada por la presencia de especies depredadoras (Ruiz y Martí 2004). Las ratas afectan a la productividad de la especie, al igual que ocurre en otras islas mediterráneas (Martin et al. 2001; Palmer y Pons, 2001; Rufino et al., 2009), mientras que los gatos asilvestrados y mustélidos pueden tener un mayor impacto al depredar directamente sobre adultos (existe un caso de depredación de 21 ejemplares no juveniles de pardela balear en un mes en una colonia de 150-200 parejas reproductoras; Ruiz y Martí, 2004). La presencia de depredadores introducidos también podría aumentar las tasas de dispersión y de años sabáticos, aunque se desconocen sus efectos en la dinámica de población (Arcos y Oro, 2004). Otro depredadores podrían ser la gaviota patiamarilla Larus michahellis, aunque no está cuantificado su impacto (Arcos y Oro, 2004; Oro y Martínez-Abraín, 2007) y el halcón peregrino (García, 2009), pero no se debe equiparar estas depredaciones con las ocasionadas por los carnívoros introducidos, mucho más severas. La ocupación humana y las actividades recreativas, debido al aumento de la población residente y visitante, también son una amenaza importante para la especie, ya que impiden la colonización o recolonización de zonas aparentemente propicias limitando el hábitat de cría (Mayol et al., 2000; Arcos y Oro, 2004). Existen evidencias de que el exceso de luz del alumbrado en las costas cercanas a las colonias de cría reduce las vocalizaciones de las aves, probablemente para evitar atraer a los depredadores (Ruiz y Martí, 2004). La iluminación artificial desorienta a los volanderos y los atrae al interior de las islas, donde se exponen a los depredadores introducidos. Durante el periodo 1999-2013 fueron rescatados en las islas Baleares un total de 304 volanderos de las especies Puffinus mauretanicus, Calonectris diomedea e Hydrobates pelagicus, provocando la muerte del 8,5%. La proporción de los encontrados en las islas representa entre el 0,13% y el 0,56% de los volanderos producidos anualmente (Rodríguez et al., 2015)1. Algunos autores señalan que la Pardela Balear tiene más dificultades en recolonizar hábitat adecuado de cría en comparación con otras especies afines, como la Pardela Cenicienta (Aguilar, 2000). En el mar, la pesca es una de las mayores amenazas, ya que las capturas incidentales en el palangre podría ser responsables de la alta mortalidad adulta estimada (Valeiras y Camiñas, 2003; Oro et al., 2004; Fig. 3). Se piensa que la alta mortalidad adulta estimada es debida a la captura incidental en este arte de pesca. Los hábitos gregarios de la pardela balear y su frecuente asociación a los barcos de pesca puede resultar en ocasionales, pero muy importantes, eventos de mortalidad (Arcos et al., 2008). Por ejemplo, existen evidencias de la captura de 50 individuos en una sola línea de palangre en la costa catalana. Si todos los individuos capturados hubieran sido adultos reproductores habría desaparecido la mitad de los individuos de una colonia de tamaño medio (alrededor de 50 parejas reproductoras, Arcos et al., 2008). La pardela balear es una especie longeva y los factores que afectan a la supervivencia adulta influyen de forma crucial en su dinámica de población. Así, la especie podría verse condenada a la extinción si no se toman urgentemente medidas de conservación. Durante el período 2000-2008 se registró en el Mediterráneo occidental la captura de pardelas baleares en pesca pelágica de albacora (Thunnus alalunga), con una tasa de 0,005 aves/1.000 anzuelos (García-Barcelona et al., 2010)1.
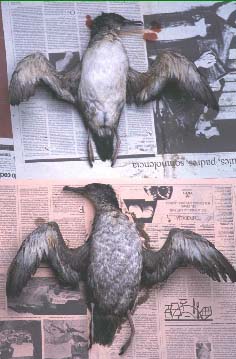
Figura 3. Individuos de Pardela balear capturados en una línea de palangre en la costa catalana. © M. Luzao
La reducción de sus principales presas y la degradación del ecosistema marino, principalmente debida a la pesca de arrastre, son otras de las amenazas importantes para la especie (Arcos y Oro, 2004; Arcos et al,. 2008). La pardela balear explota de forma importante los descartes de pesca durante la época reproductora, probablemente relacionado con una fuerte disminución de algunas especies de pequeños peces pelágicos como el boquerón (Arcos y Oro, 2004). Sin embargo, el aumento de otras especies como la alacha Sardinella aurita podría compensar dicha disminución (Arcos y Oro, 2004), aunque en los últimos años el declive parece afectar a la mayoría de especies de pequeños pelágicos con una reducción generalizada de su biomasa (Arcos et al., 2008). La pesca de arrastre es muy poco selectiva y un mayor control sobre ella es deseable para la preservación de los ecosistemas marinos, y la reducción de los descartes es un punto clave en este proceso. En este sentido, las estrategias de gestión pesquera prioritarias en la Unión Europea están encaminadas a la reducción de los descartes de pesca aumentando la selectividad de las artes. Éstas medidas serán beneficiosas a largo plazo para la recuperación del ecosistema marino, pero a corto plazo su reducción podría afectar a la pardela balear. Se podrían dar efectos de competencia por los recursos y depredación sobre especies de aves marinas de menor tamaño y más especializadas. Así, la pardela balear se podría ver forzada a obtener el total de su alimento de los clupeidos, cuya disponibilidad actual se encuentra mermada considerablemente. Por tanto, la escasez de descartes podría afectar negativamente a la ecología de la pardela balear, así como influir en la estructura de la comunidad de las aves marinas. Predecir la respuesta de las comunidades de aves marinas a las regulaciones es complejo y requiere de largas series temporales de datos para discernir el efecto de estas medidas de factores ambientales. En el levante Mediterráneo, se implementan vedas temporales de pesca durante dos meses cada año, pero éstas parecen responder principalmente a cuestiones socioeconómicas (Arcos et al., 2008). De hecho, su solapamiento temporal con la época reproductora de las aves marinas del delta del Ebro resulta en una baja productividad, aunque se desconoce en detalle su efecto sobre la biología reproductiva y dinámica de población de la pardela balear (Louzao et al., 2006 y 2008). Las regulaciones pesqueras deberían integrar a las aves marinas, incluyendo la pardela balear, para paliar tanto el potencial impacto de la sobreexplotación de sus presas naturales como el de la reducción de los descartes (Arcos y Oro, 2004; Arcos et al. 2008). No hay que olvidarse de otras amenazas como la contaminación por metales pesados y organoclorados (Ruiz y Martí, 2004). Análisis de plumas de adultos han revelado contaminación por plomo y niveles especialmente altos de mercurio y selenio. Pese a que los Procellariiformes suelen presentar niveles relativamente altos de mercurio, la Pardela Balear muestra valores relativamente elevados (Arcos y Oro, 2003). En el Mediterráneo los niveles de mercurio son son elevados (Cossa et al., 1997) y en el delta del Ebro, una de las áreas más importantes de alimentación durante la reproducción, los niveles de mercurio en los descartes de pesca son más elevados que en sus presas naturales (Arcos et al., 2002; Arcos y Oro, 2004). Por tanto, los niveles de mercurio detectados podrían acercarse al límite tolerado por la especie, que pasaría a ser susceptible frente a episodios puntuales de contaminación (vertidos) (Arcos y Oro, 2004). Los niveles de selenio podrían atenuar el efecto del mercurio aunque también afectar negativamente la reproducción (Arcos y Oro 2004). Los niveles de organoclorados no eran críticos, pero indicaban que la especie estaba afectada por compuestos orgánicos de origen industrial (Ruiz y Martí, 2004). En cuanto a la contaminación por hidrocarburos, no se conoce ningún caso de elevada incidencia, pero el alto gregarismo de la especie la hace muy vulnerable a vertidos puntuales. Por ejemplo, si el hundimiento del Prestige se hubiese producido cuando el grueso de la población se encontraba en aguas gallegas (verano) la mortalidad hubiera sido alarmante (Ruiz y Martí, 2004). Las amenazas asociadas a las áreas de migración e invernada son relativamente poco conocidas (Arcos y Oro, 2004). Se han detectado altas concentraciones de mercurio y bifenilos policlorados (PCB) en pardelas baleares invernantes en las costas de Portugal (Costa et al., 2016)1. La ingestión y acumulación de restos de plástico flotantes en el mar representa una amenaza para la pardela balear. Se han encontrado en promedio 3,6 restos de plástico con un peso medio de 5,5 mg en el contenido estomacal del 70% de las pardelas baleares examinadas (n= 46) (Codina-García et al., 2013)1. Se ha sugerido que el incremento de la presencia de pardelas baleares en el noreste del Atlántico desde mediados de los años 90 se correlaciona con el incremento registrado de la temperatura del mar (Wynn et al., 2007), y del plancton (copépodos) y de las presas de las pardelas (boquerón y sardina) (Luczak et al., 2011)1. Se ha citado al cambio climático como un determinante del cambio en la distribución invernal de la especie en el Atlántico (Wynn et al., 2007), pero este apunte ha sido criticado y puesto en duda (Votier et al., 2008).
Medidas de conservación El Govern de les Illes Balears elaboró en 1997 el primer Plan de Recuperación para la especie (Aguilar, 1997) cuya ejecución la realizó SEO/Birdlife (1998-2001), a través del proyecto Life B-4/3200/97/246. Se constató que la viabilidad de la población dependía de la productividad, pero principalmente de la supervivencia adulta y que la disponibilidad del hábitat de nidificación no era un factor limitante. Se actualizó la estima de la población reproductora y se avanzó en el conocimiento de los principales parámetros demográficos. Así, entre otros, se procedió a mejorar la calidad del hábitat de reproducción controlando los depredadores, reduciendo las molestias y protegiendo legalmente todas las colonias de cría declarándolas como Zonas de Especial Protección para las Aves (ZEPA). Después del proyecto, se identificaron futuras actuaciones prioritarias (Ruiz y Martí, 2004): (1) control de depredadores introducidos, (2) valoración de la contaminación de selenio y mercurio durante el ciclo anual, (3) control de expolios y molestias, (4) estimar y disminuir la mortalidad en el palangre, (5) cumplir con los planes de gestión de las ZEPAs, (6) analizar la influencia de la sobreexplotación de los recursos pesqueros y (7) declarar ZEPAs en el medio marino. Cuando una especie se asigna a la categoría de En Peligro Crítico en el Catálogo Nacional, la comunidad/es autónoma/s correspondiente está obligada a elaborar y aprobar un Plan de Recuperación (Ley 4/1989). Por tanto, a partir del primer Plan y los resultados del proyecto Life, el Govern de les Illes Balears presentó en 2003 el segundo Plan de Recuperación (2003-2008) de la pardela balear. El objetivo general es invertir la tendencia demográfica de la especie, frenando su regresión actual y favoreciendo el incremento de sus efectivos, disminuyendo los factores que provocan la mortalidad adulta, incrementar la productividad de las colonias, mantener las colonias existentes y recuperar las preexistentes, y mejorar el conocimiento actual de la biología de la especie. También es prioritario sensibilizar a la sociedad del interés de la especie, principalmente en Formentera, y promover la participación de todos los sectores implicados en la recuperación de la especie. El esfuerzo realizado por las Administraciones y entidades implicadas, tanto en la elaboración de los Planes de Recuperación como en su ejecución, es muy loable. Sin embargo, un estudio demográfico detallado y puesto al día regularmente es crucial para estudiar la viabilidad e implicaciones de conservación para esta especie amenazada endémica de las Islas Baleares (Oro et al. 2004), al igual que el estudio de su ecología en el ecosistema marino, analizando su asociación al hábitat de alimentación y la interacción con las actividades antropogénicas que se desarrollan en el Mediterráneo occidental. Existen otros proyectos dedicados a la conservación de la Pardela Balear, como la impulsada por SEO/BirdLife, la Secretearía General de Pesca Marítima y la Consellería de Medi Ambient de la Comunidad Valenciana para evaluar el impacto de la pesca de palangre en las islas Columbretes (Arcos y Oro, 2004). En vista de la elevada mortalidad adulta que experimenta la Pardela Balear, se han propuesto las siguientes medidas de conservación prioritarias (listadas en orden de importancia) -Capturas accidentales. -Control de depredadores. El condicionamiento aversivo mediante cloruro de litio representa un método útil para proteger colonias de nidificación de pardelas baleares en aquellos casos en los que la erradicación o el control de depredadores no es posible (Latorre et al., 2013)1. -Protección efectiva de las áreas de nidificación. -Acción directa del hombre (expolios). -Sobreexplotación pesquera. -Reducción de descartes y veda de arrastre. -Aves petroleadas y posibles riesgos. -Contaminación por metales pesados. -Competencia con otras especies. -Zonas Especialmente Protegidas de Importancia para el Mediterráneo (ZEPIM). Las zonas de alimentación preferidas coinciden con las áreas protegidas recientemente, lo que pone de manifiesto la necesidad de su manejo adecuado (Meier et al., 2015)1. -Investigación aplicada a la conservación. Se han establecido parcelas en la isla de Sa Dragonera (Mallorca) para monitorear tendencias de población a largo plazo (Morgan et al., 2013)1.
Referencias Aguilar, J. S. (1997). Biología y conservación de la pardela balear Puffinus mauretanicus. Documents Tècnics de Conservació. Conselleria de Medi Ambient, Ordenació del Territori i Litoral (Govern Balear), Palma de Mallorca. Aguilar González, J. S. (1997b). Pardela Mediterránea. Puffinus yelkouan. Pp. 30-31. En: Purroy, F. J. (Coord.). Atlas de las aves de España (1975-1995). Lynx Edicions, Barcelona. 580 pp. Aguilar, J. S. (2000). La población de Pardela Balear (Puffinus mauretanicus) en el Parque Nacional del archipiélago de Cabrera. Pp. 33-44. En: Pons, G. X. (Ed.). Las aves del Parque Nacional marítimo-terrestre del archipiélago de Cabrera (Islas Baleares, España). GOB-Ministerio de Medio Ambiente, Madrid. Alcover, J. A., McMinn, M., Altaba, C. R. (1994). Eivissa: a pleistocene oceanic-like island in the Mediterranean. Research & Exploration, 10: 236-238. Arcos, J. M. (Compiler) (2011). International species action plan for the Balearic shearwater, Puffinus mauretanicus. SEO/BirdLife & BirdLife International. 49 pp. Arcos, J. M., Arroyo, G. M., Bécares, J., Mateos-Rodríguez, M., Rodríguez, B., Muñoz, A. R., Ruiz, A., De la Cruz, A., Cuenca, D., Onrubia, A., Oro, D. (2012). New estimates at sea suggest a larger global population of the Balearic Shearwater Puffinus mauretanicus. Pp. 84-94. En: Yésou, Baccetti, N., Sultana, J. (Eds.). Ecology and Conservation of Mediterranean Seabirds and other bird species under the Barcelona Convention. Proceedings of the 13th Medmaravis Pan-Mediterranean Symposium. Alghero (Sardinia). 14-17 Oct. 2011. Medmaravis, Alghero. 232 pp. Arcos, J. M., Louzao, M., Oro, D. (2008). Fishery Ecosystem Impacts and Management in the Mediterranean: Seabirds Point of View. Pp. 1471-1479. En: Nielsen, J. L., Dodson, J. J., Friedland, K., Hamon, T. R., Musick, J., Verspoor, E. (Eds). Reconciling Fisheries with Conservation: Proceedings of the Fourth World Fisheries Congress. American Fisheries Society, Symposium 49. Bethesda, Maryland. Arcos, J. M., Oro, D. (2003). Pardela Balear, Puffinus mauretanicus. Pp. 88-89. En: Martí, R., del Moral, J.C. (Eds.). Atlas de las Aves Reproductoras de España. Dirección General de Conservación de la Naturaleza-SEO/BirdLife, Madrid. Arcos, J. M., Oro, D. (2004). Pardela Balear, Puffinus mauretanicus. Pp. 46-50. En: Madroño, A., González, C., Atienza, J. C. (Eds.). Libro Rojo de las Aves de España.,. Dirección General para la Biodiversidad-SEO/BirdLife, Madrid. Arcos, J. M., Ruiz, X., Bearhop, S., Furness, R. W. (2002). Mercury levels in seabirds and their fish prey at the Ebro Delta (NW Mediterranean): the role of trawler discards as a source of contamination. Marine Ecology Progress Series, 232: 281-290. Arroyo, G. M., Mateos-Rodríguez, M., Muñoz, A. R., De la Cruz, A., Cuenca, D., Onrubia, A. (2016). New population estimates of a critically endangered species, the Balearic Shearwater Puffinus mauretanicus, based on coastal migration counts. Bird Conservation International, 26 (1): 87-99. BirdLife International (2015). Puffinus mauretanicus. The IUCN Red List of Threatened Species 2015: e.T22728432A82342251. Codina-García, M., Militao, T., Moreno, J., González-Solís, J. (2013). Plastic debris in Mediterranean seabirds. Marine Pollution Bulletin, 77 (1-2): 220-226. Cossa, D., Martín, J. M., Takayanagi, K., Sanjuán, J. (1997). The distribution and cycling of mercury species in the western Mediterranean. Deep Sea Res. Pt II, 44:721-740. Costa, R. A., Torres, J., Vingada, J. V., Eira, C. (2016). Persistent organic pollutants and inorganic elements in the Balearic shearwater Puffinus mauretanicus wintering off Portugal. Marine Pollution. Marine Pollution Bulletin, 108 (1-2): 311-316. García, D. (2009). Predation on the endemic Balearic shearwater Puffinus mauretanicus by peregrine falcon Falco peregrinus. Alauda, 77 (3): 230-231. García Barcelona, S., Ortiz de Urbina, J. M., de la Serna, J. M., Alot, E., Macías, D. (2010). Seabird bycatch in Spanish Mediterranean large pelagic longline fisheries, 2000-2008. Aquatic Living Resources, 23 (4): 363-371. Genovart, M., Arcos, J. M., Alvarez, D., McMinn, M., Meier, R., Wynn, R. B., Guilford, T., Oro, D. (2016). Demography of the critically endangered Balearic shearwater: the impact of fisheries and time to extinction. Journal of Applied Ecology, 53 (4): 1158-1168. Latorre, L., Larrinaga, A. R., Santamaria, L. (2013). Rats and Seabirds: Effects of Egg Size on Predation Risk and the Potential of Conditioned Taste Aversion as a Mitigation Method. Plos One, 8 (9): e76138. Louzao, M., Arcos, J. M., Hyrenbach, D., Abelló, P., Gil de Sola, L., Oro, D. (2004). Resultados preliminares sobre el hábitat de alimentación de la Pardela Balear en el Levante Ibérico Peninsular. Anuari Ornitològic de les Balears, 19: 61-67. Louzao, M., Arcos, J. M., Hyrenbach, K. D., Abelló, P., Gil De Sola, L., Oro, D. (2006). Oceanographic Habitat of the Critically Endangered Balearic Shearwater: Identifying Suitable Marine Protected Areas. Ecological Applications, 16: 1683-1695. Louzao, M., Delord, K., García, D., Boue, A., Weimerskirch, H. (2012). Protecting Persistent Dynamic Oceanographic Features: Transboundary Conservation Efforts Are Needed for the Critically Endangered Balearic Shearwater. Plos One, 7 (5): e35728. Louzao, M., Igual, J. M., McMinn, M., Aguilar, J. S., Triay, R., Oro, D. (2006). Breeding performance of the critically endangered Balearic Shearwater: improving the conservation diagnosis. Marine Ecology Progress Series, 318: 247-254. Louzao, M., Navarro, J., Forero, M. G., Igual, J. M., Genovart, M., Hobson, K. A., Oro, D. (2011). Exploiting the closest production area: geographical segregation of foraging grounds in a critically endangered seabird. Marine Ecology Progress Series, 429: 291-301. Luczak, C., Beaugrand, G., Jaffre, M., Lenoir, S. (2011). Climate change impact on Balearic shearwater through a trophic cascade. Biology Letters, 7 (5): 702-705. Martin, J. L., Thibault, J.-C., Bretagnolle, V. (2000). Black Rats, Island Characteristics, and Colonial Nesting Birds in the Mediterranean: Consequences of an Ancient Introduction. Conservation Biology, 14: 1452-1466. Mayol, J., Aguilar, J. S., Yésou, P. (2000). The Balearic Shearwater Puffinus mauretanicus: status and threats. Pp. 24-37. En: Yésou, P., Sultana, J. (Eds.). Monitoring and conservation of birds, mammals and sea turtles of the Mediterranean and Black seas. Environment Protection Department, Malta. Meier, R., Wynn, R. B., Votier, S. C., McMinn Grivé, M., Rodríguez, A., Maurice, L., Emiel Van Loon, E., Jones, A. R., Suberg, L., Arcos, J. M., Morgan, G., Josey, S. A., Guilford, T. (2015). Consistent foraging areas and commuting corridors of the critically endangered Balearic shearwater Puffinus mauretanicus in the northwestern Mediterranean. Biological Conservation, 190: 87-97. Morgan, G., McMinn, M., Wynn, R., Meier, R., Maurice, L., Sevilla, B., Rodríguez, A., Guilford, T. (2013). Establishing repeatable study plots on Sa Dragonera, Mallorca to assess population trends of the local breeding Balearic Shearwaters Puffinus mauretanicus. Seabird, 26: 32-41. Oro, D., Aguilar, J. S., Igual, J. M., Louzao, M. (2004). Modelling demography and extinction risk in the endangered Balearic shearwater. Biological Conservation, 116: 93-102. Oro, D., Martínez-Abraín, A. (2007). Deconstructing myths on large gulls and their impact on threatened species. Animal Conservation, 10: 117-126. Palmer, M., Pons, G. X. (2001). Predicting rat presence on small islands. Ecography, 24: 121-126. Rodríguez, A., García, D., Rodríguez, B., Cardona, E., Parpal, L., Pons, P. (2015). Artificial lights and seabirds: is light pollution a threat for the threatened Balearic petrels? Journal of Ornithology, 156 (4): 893-902. Rodríguez-Molina, A., Mc-Minn-Grivé, M. (2005). Population and distribution of the breeding colonies of the Balearic Shearwater Puffinus mauretanicus. 2nd International Manx Shearwater Workshop. Abstracts. Belfast, U K. Ruffino, L., Bourgeois, K., Vidal, E., Duhem, C., Paracuellos, M., Escribano, F., Sposimo, P., Baccetti, N., Pascal, M., Oro, D. (2009). Invasive rats and seabirds after 2,000 years of an unwanted coexistence on Mediterranean islands. Biological Invasions, DOI 10.1007/s10530-008-9394-z Ruiz, A., Martí, R. (Eds.) (2004). La pardela balear. SEO/BirdLife-Conselleria de Medi Ambient del Govern de les Illes Balears. Madrid. Valeiras, J., Camiñas, J. A. (2003). The incidental capture of seabirds by Spanish drifting longline fisheries in the western Mediterranean Sea. Scientia Marina, 67: 65-68. Votier, S. C., Bearhop, S., Attrill, M. J., Oro, D. (2008). Is climate change the most likely driver in range expansion of a critically endangered top predator in northeast Atlantic waters? Biology Letters, 4: 204-205. Wynn, R. B., Josey, S. A., Martin, A. P., Johns, D. G., Yesou, P. (2007). Climate-driven range expansion of a critically endangered top predator in northeast Atlantic waters. Biology Letters, 3: 529–532.
Daniel Oro1, Maite Louzao1, 2 y Meritxell Genovart1 Fecha de publicación: 22-06-2009 Otras contribuciones: 1. Alfredo Salvador. 22-09-2016 Oro, D., Louzao, M., Genovart, M. (2016). Pardela Balear – Puffinus mauretanicus. En: Enciclopedia Virtual de los Vertebrados Españoles. Salvador, A., Morales, M. B. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
|
|
|
|
|
|
|