|
|
|||||||||||||
|
|||||||||||||
|
Para más información sobre cada apartado hacer click en:
|
Key words: Storm Petrel, habitat, abundance, status, threats.
Hábitat de nidificación El paíño europeo es un ave pelágica que únicamente visita tierra firme para reproducirse o en busca de una pareja y/o lugar apto para la cría (Warham, 1990). La mayor parte de los individuos visitan tierra firme a partir de su segundo año de vida (tercer año de calendario, 3ac), tras permanecer su primer año en mar abierto (Okill y Bolton, 2005; Hernández et al., 2017). Sus colonias de cría pueden albergar desde unos pocos individuos (p.ej. Islas Columbretes, Castellón, España) a cientos (p.e. Isla de Benidorm, Alicante, España; Mínguez, 1994) o miles de parejas (p.ej. Isla de Marettimo, Italia; LoValvo y Massa, 2000). La mayoría de las colonias de cría se localizan en islas e islotes, siendo escasísimas las colonias encontradas en acantilados continentales. En la Península Ibérica se han localizado dos, una en Cabo Ogoño y otra en San Juan de Gaztelugatze, Bizkaia (Zuberogoitia y Torres, 1998; Franco et al., 2004). Ver más detalles en el apartado de distribución geográfica. Una característica común a todas las colonias de cría de la especie es la ausencia o inaccesibilidad de ratas a las zonas de reproducción (de León et al., 2006; Martin et al., 2000; Mínguez y Vigil, 1995). Sus nidos generalmente se localizan en grietas, fisuras, pequeñas cavidades, cuevas, derrubios de piedras de tamaño medio y grande o bajo la vegetación (Figura 1; Scott, 1970; Ramos et al., 1997; Ratcliffe et al., 1998).
Figura 1. Ejemplar adulto incubando en una de las fisuras típicas del islote de Aketx, Bizkaia (© I. Zuberogoitia).
Hábitat de alimentación Existe muy poca información precisa relativa a las áreas de alimentación del paíño europeo. En aguas españolas se sabe que el paíño europeo presenta una distribución heterogénea durante la temporada reproductora, con las principales agregaciones localizadas en zonas de borde de la plataforma continental (entre los 200 y 1000 metros de profundidad). En el Mediterráneo destaca su presencia en la plataforma del delta del Ebro-Columbretes y el Cabo de la Nao, y su ausencia en aguas Baleares. En el Atlántico, la especie presenta las mayores concentraciones en el golfo de Vizcaya (Bécares et al., 2011). Resulta habitual observar paíños alimentándose en periodo reproductor a partir de las 4 ó 5 millas de la costa cantábrica (Figura 2; G. Ocio y J. Andrés, com. pers). Durante 2018 se han empezado a publicar los primeros datos referentes a desplazamientos y áreas de alimentación en periodo reproductor para la especie obtenidos mediante GPS. En High Island (Galway, Irlanda), la distancia máxima entre la colonia y la zona de alimentación fue de 336 km (Critchley et al., 2018). También se han estudiado los viajes de alimentación durante la incubación y el periodo de crianza del pollo en la colonia de Mousa en Escocia (Tabla 1; Oppel et al., 2018).
Tabla 1. Capacidad de desplazamiento (mediana y rango) del paíño europeo en Moussa (Escocia, UK) durante la temporada reproductora. Las distancias hacen referencia a viajes individuales de alimentación, el tamaño del área explotada se basa en el Polígono Mínimo Convexo del 95% alrededor de todas las localizaciones de los individuos de la colonia (datos extraídos de Oppel et al., (2018).
Figura 2. Nada más salir de la franja costera cantábrica, a partir de las 3 millas, se pueden observar fácilmente durante el verano a los paíños alimentándose (© J. Andrés).
AbundanciaVer apartado “Distribución geográfica”. Estado de conservaciónA nivel mundial la especie se incluye en la categoría de “preocupación menor” (BirdLife International, 2018). En el Libro Rojo de las Aves de España la especie se clasifica como “Vulnerable” (Mínguez, 2004) y según el Real Decreto 439/1990 que regula el Catálogo Nacional de Especies Amenazadas, está considerada "De interés especial". En cuanto a los catálogos regionales la especie se clasifica en las siguientes categorías:
Es una especie común a lo largo de la costa atlántica; sin embargo, la subespecie mediterránea podría haber sufrido un acentuado declive debido al resultado de la actividad turística y la introducción de depredadores en islas (Martin et al., 2000; Mínguez et al., 2003). Desafortunadamente existen pocos datos para poder evaluar sus tendencias poblacionales. A la hora de evaluar el estado de conservación de la especie es necesario disponer de estimas fiables de la evolución de sus tamaños poblacionales en el tiempo o, alternativamente, contar con estimas robustas de sus parámetros demográficos como pueden ser la supervivencia o éxito reproductor (Oro, 2014). Como especie longeva, la supervivencia adulta es el parámetro demográfico que más afecta a la tasa de crecimiento poblacional (Sæther y Bakke, 2000; Sanz-Aguilar et al., 2009a). Por tanto, la identificación de los factores que amenazan la supervivencia adulta, así como el diseño e implementación de medidas correctoras efectivas, deben ser actuaciones prioritarias en las estrategias y programas de conservación para garantizar la viabilidad de sus poblaciones (Rodríguez et al. 2019).
Amenazas y medidas de conservaciónDepredadores En las colonias de cría la modificación del hábitat y la introducción de especies exóticas son las mayores amenazas para el paíño europeo (Martin et al., 2000; Mínguez et al., 2003; Rodríguez et al. 2019). La distribución actual de sus colonias, en islas e islotes libres de depredadores, podría ser el resultado de la introducción histórica en islas de especies depredadoras como las ratas (Martin et al., 2000; de León et al., 2006). La presencia de ratas en colonias de cría de Procellariiformes como pardelas o albatros afecta principalmente a su productividad, al depredar huevos y/o pollos. Sin embargo, a diferencia de otras especies de mayor tamaño, las ratas depredan también sobre paíños adultos, afectando a la supervivencia en esta clase de edad, e impidiendo por ello que puedan coexistir poblaciones viables de paíños en lugares con presencia de ratas (Martin et al., 2000; de León et al., 2006). Tras desratizaciones de islas e islotes se comienza a observar (re)colonizaciones por parte del paíño europeo. Es el caso de la observación de la especie en las islas Shiants en Escocia (https://www.rspb.org.uk/about-the-rspb/about-us/media-centre/press-releases/project-celebrates-churring-storm-petrels-on-the-shiants/), en la Isla de Montecristo en Italia (https://www.restoconlife.eu/2015/06/20/uccello-delle-tempeste-a-montecristo/) y la confirmación de su reproducción en los islotes de Conills y Rates del archipiélago de Cabrera (http://www.caib.es/pidip2front/jsp/ca/fitxa-convocatoria/stronges-detecten-noves-cologravenies-de-nonetes-per-primera-vegada-a-les-illes-balearsstrong). Asimismo, tras desarrollar acciones de desratización en la isla Conejera, en Cantabria a finales de la década de 2010s, los paíños recolonizaron de nuevo la isla (Gobierno de Cantabria, 2008). Lamentablemente, las ratas volvieron a colonizar esta isla unos años más tarde, cuando se dejó de realizar el necesario control preventivo. Actualmente, los paíños están ausentes en esta isla (Gobierno de Cantabria, 2017). En el islote de Aketx, Bizkaia, donde hay una población de conejos domésticos Oryctolagus cuniculus introducidos décadas antes de comenzar con los estudios de población de la especie (finales de los ochenta), se pudo comprobar que en aquellas grietas donde accedían los conejos no había nidos de paíños. Se localizaron, además, restos de paíños y de gaviotas devorados por los conejos (datos propios no publicados). En Canarias (La Graciosa y Lobos) y en Bretaña (Francia) también se ha documentado la depredación por gatos asilvestrados Felis silvestris catus (Lorenzo y Barone, 2007; Bernard Cadiou, com. pers.). En la Isla de Benidorm, pescadores ancianos aseguran que cuando eran niños la isla estaba llena de ratones (y también de paíños). En Isla Grosa (Murcia) fue descrita como abundantísima a mediados del siglo XIX por el naturalista Ángel Guirao (1859). Sin embargo, en la actualidad apenas crían una decena de parejas lo cual probablemente se debe a la presencia de roedores que debieron habitar la isla durante la presencia militar. Al parecer, los propios militares introdujeron culebras para erradicar los roedores, lo cual, de ser cierto, fue exitoso porque en la actualidad la isla está desratizada. Sin embargo, a pesar de que hace varias décadas que no hay roedores, la población no ha aumentado lo que probablemente se deba a la presencia de las culebras. En los últimos años se ha documentado la depredación por culebra bastarda Malpolon monspessulanus El visón americano Neovison vison está considerado como una de las principales amenazas para la conservación de las poblaciones de varias especies de aves marinas (Craik, 1997). En Galicia ha tenido repercusión sobre la población reproductora de cormorán moñudo Phalacrocorax aristotelis (Velando y Munilla, 2008). Se desconoce el efecto que pueda tener sobre las colonias de paíños. Entre las especies no introducidas destaca la depredación que diversas especies de láridos, como la gaviota patiamarilla Larus michahellis o la gaviota sombría Larus fuscus, ejercen sobre individuos adultos y pollos de paíño europeo en sus colonias de cría (Figura 3; Oro et al., 2005; Sanz-Aguilar et al., 2009b; Libois et al., 2012; Matovic et al., 2017). Esta causa de mortalidad se debe principalmente a la depredación por parte de individuos oportunistas especializados (Oro et al., 2005), que encajan perfectamente en lo que se conoce como ‘individuos problema’ (Swan et al., 2017). Una vez reconocidos como tales, deben ser sustraídos de forma urgente del ambiente natural para garantizar la efectividad de la medida en la gestión de poblaciones silvestres afectadas por estos ’individuos problema’ (Swan et al., 2017). En la Isla de Benidorm, la eliminación selectiva de gaviotas especialistas se tradujo en aumentos sustanciales de la supervivencia (16%), el éxito reproductor (23%) y el tamaño poblacional (ver Supervivencia y dinámica poblacional) del paíño (Sanz-Aguilar et al., 2009b; Tenan et al., 2014). Además, la instalación de cajas nido en zonas de nidos muy expuestos (Figura 4) redujo las probabilidades de depredación, aumentando tanto la supervivencia adulta como el éxito reproductor (Libois et al., 2012). Sin embargo, nuestras observaciones en colonias de paíño donde se han instalado cajas nido apuntan a que no se ocupan de igual forma en todas las colonias. Tienden a ocuparse aquellas cajas situadas en emplazamientos donde existían nidos naturales y en algunos casos, como en la Isla Mitjana (Alicante), han comenzado a ocuparse tras más de 10 años desde su instalación.
Figura 3. Egagrópila de gaviota patiamarilla con restos de un paíño europeo depredado en la isla de Benidorm (© A. Sanz-Aguilar).
Figura 4. Cajas nido (n=42) instaladas en la cueva pequeña de la isla de Benidorm. En 2018 un 88% de las cajas se encontraron ocupadas por adultos reproductores (© M. Gomila).
En colonias del norte de Europa, el págalo grande Stercorarius skua es también uno de los principales depredadores del paíño (Votier et al., 2004a). Entre las aves rapaces, el halcón de Eleonora Falco eleonorae es una de las especies que mayor presión de depredación mantiene sobre los paíños (Martínez-Abraín et al., 2005; de León et al., 2007). En un estudio de esta especie llevado a cabo en las Islas Canarias (entre 2000 y 2002) se vio que la frecuencia de ocurrencia del paíño europeo en la dieta suponía un 5% (de León et al., 2007). La estrategia de caza del halcón de Eleonora le permite cazar en alta mar, donde se mueven durante el día los paíños mientras se alimentan, o incluso durante la noche (Buij y Gschweng, 2017), por lo que podrían capturar a los paíños cuando se mueven cerca de las colonias de cría. El halcón peregrino Falco peregrinus, por otro lado, también ejerce una ligera presión sobre la especie. Así, en Bizkaia se constató la depredación de 2 paíños por parte de halcones peregrinos, los cuales sitúan sus nidos en acantilados costeros e islotes y cazan desde estas paredes hacia el mar, pudiendo salir más de 5 km mar adentro en sus lances de caza, interceptando las zonas de alimentación y flujo de los paíños (Zuberogoitia et al., 2002, 2013). Las rapaces nocturnas son otro de los potenciales grupos de depredadores. El búho campestre Asio flammeus, por ejemplo (Glue, 1977). Existen evidencias de depredación por búho campestre en Bretaña (Francia; Bernard Cadiou com. pers.) e incluso hay documentales y videos en youtube mostrando imágenes de búhos campestres en las Islas Galápagos depredando sobre los paíños locales cuando acceden a los lugares de nidificación (p.ej., The internet IBC Bird Collection, 2018). En las islas Baleares se documentó la depredación de paíños por parte de lechuzas comunes Tyto alba, las cuales se mueven entre islotes y capturan a los paíños cuando llegan a las colonias de cría, dándose casos puntuales de depredación intensa (Guerra et al., 2014). Finalmente, también se ha documentado depredación de paíños por garza real Ardea cinerea en Bretaña (Francia) (Cadiou, 2013) y Cabo Verde, en este caso paíño pechialbo, que también es depredado por cuervos (Jacob González-Solís com. pers.).
Disponibilidad de alimento En el mar la disponibilidad de alimento puede estar ligada a la intermitencia en la reproducción (Hemery et al., 1986) y la productividad de las colonias (Hemery et al., 1986; Ramírez et al., 2016). En la colonia de Benidorm se ha descrito que el paíño comienza la reproducción en el momento de máxima disponibilidad de zooplancton, y alimenta a los pollos cuando la disponibilidad de larvas de peces es máxima (Ramírez et al., 2016). Se ha demostrado que el ajuste de la fenología, tanto a nivel individual como interanual, al momento de máxima disponibilidad de alimento tiene repercusiones en el éxito de eclosión y reproductor (Ramírez et al., 2016). En la colonia de Marettimo (Italia) se ha descrito que el reclutamiento (inicio de la reproducción) se reduce en años con malas condiciones y baja disponibilidad de alimento, y que la baja disponibilidad de alimento en las zonas de invernada podría propiciar la no reproducción (sabáticos) de adultos reproductores (Soldatini et al., 2014).
Contaminación La contaminación de los mares por vertidos y mareas negras produce mortandad en las poblaciones de paíños, tanto en las áreas de reproducción como en las de invernada. La mortandad puede ser directa, debido al consumo de substancias tóxicas y al deterioro del plumaje como consecuencia de la impregnación con hidrocarburos, y los consecuentes problemas de hipotermia y debilidad, o puede ser indirecta, como resultado de una reducción en la disponibilidad de alimento que va parejo a una merma en el número de parejas que inicia la reproducción y una disminución en el éxito reproductor (Trivelpiece et al., 1984; Jenssen, 1994; Azkona et al., 2006). En España ha habido varios episodios de mareas negras debido al hundimiento de buques petroleros o vertidos accidentales. Los más significativos de los últimos veinticinco años fueron el del Mar Egeo (1992) que afectó 200 km de la costa coruñesa y el Prestige (2002) que afectó a toda la cornisa cantábrica, incluyendo las costas francesas, además de las costas atlánticas gallegas y portuguesas. Pero, además, ha habido mareas negras de menor entidad que afectaron varios kilómetros de costa causados por hundimientos de barcos y vertidos (ver p. ej. http://www.puertoalgeciras.org/2007/07/cronologa-de-las-mareas-negras-ms.html), así como mareas producidas en países vecinos que tuvieron consecuencias en los mares españoles, como el caso del Erika (1999) que afectó a 400 km de costas francesas, con graves consecuencias para las aves que migraban o invernaban en el Golfo de Bizkaia. Por ejemplo, en el caso del Erika se recogieron 74.000 aves petroleadas en las costas francesas, de las que 32.000 eran especies marinas, principalmente arao común Uria aalge (80%; Cadiou et al., 2004). En el caso del Prestige se recogieron 23.180 aves procedentes de las costas portuguesas, españolas y francesas (García et al., 2003; Castege et al., 2007). Estas cifras fueron subestimas de la magnitud real de las catástrofes, debido al elevado número de cadáveres que desaparecen en el mar y nunca son recuperados (Castege et al., 2007). A pesar de la magnitud de estos impactos, el número de bajas directas de paíños europeos fue escaso (p.ej., 19 ejemplares en el caso del Prestige, García et al., 2003). Si bien, durante las campañas llevadas a cabo en Aketx (Bizkaia) en el periodo reproductor de 2003 y 2004, se detectaron ejemplares con el plumaje manchado por hidrocarburos (Azkona et al., 2006). Además, la condición corporal de las aves durante los periodos reproductores de 2003 y 2004 fue significativamente peor que en años anteriores, recuperándose posteriormente en 2005 y 2006 (Azkona et al., 2006). Por otra parte, en la temporada reproductora de 2003 y 2004 se detectó un descenso notable de los intentos de reproducción y un éxito reproductor muy bajo (16%). No obstante, en 2006 la colonia recuperó los valores habituales antes del Prestige (Azkona et al., 2006). Datos de campo sugieren que una parte de la población reproductora adulta podría haber evitado la reproducción durante la marea negra, manteniéndose en áreas fuera de la influencia de la misma y regresando a reproducirse una vez superado el problema (Zabala et al., 2011a). No obstante, existen ciertas discrepancias sobre este caso particular (Arce et al. 2011; Zabala et al. 2011b). En Aketx, de hecho, no se observó una variación en la supervivencia de individuos residentes en el período evaluado (Zabala et al., 2011a; Zuberogoitia et al., 2016). Otro tipo de contaminación con efectos indeseados para el paíño es la contaminación lumínica. Las luces artificiales pueden confundir a los paíños, atrayéndolos a zonas habitadas o provocando colisiones. Como sucede con otras especies de Procellariiformes, la contaminación lumínica por desorientación afecta fundamentalmente a los individuos jóvenes que abandonan las colonias de reproducción (Rodríguez y Rodríguez, 2009; Rodríguez et al., 2015). Además, la contaminación lumínica en zonas de cría podría incrementar la depredación por parte de especies diurnas como los láridos, tal y como sucede en una de las colonias de la Isla de Benidorm (cueva 1) que recibe la luz del paseo marítimo de esta ciudad (Oro et al., 2005). Campañas en redes sociales pueden ayudar a recuperar los individuos jóvenes desorientados por la luz. Hasta la fecha se desconocen los efectos que la ingestión de plásticos y microplásticos puedan tener sobre el paíño europeo. Sin embargo, estudios recientes han evidenciado que la presencia de plásticos en paíños encontrados muertos en Australia y Nueva Zelanda es sustancialmente superior a la encontrada en otras especies de aves marinas (Laureen Roman, com. pers.).
Molestias Las molestias causadas por humanos son análogas a las generadas por depredadores, ambas repercutiendo en el tiempo y energía que los individuos deben dedicar a otras actividades, como la alimentación, el cuidado de la progenie o la búsqueda de pareja (Frid y Dill, 2002). Las molestias humanas en colonias de aves marinas pueden tener diferentes efectos, tanto comportamentales como fisiológicos, incluyendo una reducción de la productividad y éxito reproductor, e incluso abandonos de la zona de reproducción (Carney y Sydeman, 1999). En la colonia de Moussa en Shetland (UK) se observó que la mortalidad de pollos en áreas expuestas a la presencia de turistas era mayor que en zonas más alejadas, aunque no se detectaron diferencias en el éxito reproductor (Watson et al., 2014). Además, experimentos con el paíño de Leach Oceanodroma leucorhoa revelaron que molestias directas continuadas como la captura diaria o semanal de los reproductores pueden generar deserción de los nidos: menor éxito reproductor y menor fidelidad al nido, como se demostró experimentalmente (Blackmer et al., 2004). Sin embargo, las aves longevas tienen el potencial de habituarse a las molestias (Burger y Gochfeld, 1999). De hecho, estudios en colonias italianas no han detectado que los paíños se encuentren estresados ante las potenciales molestias derivadas del ruido de barcos turísticos, si no que parecen estar habituados (Soldatini et al., 2015). En España, son pocos los islotes e islas donde se reproduce el paíño europeo en los que está permitido el acceso a turistas. Uno de ellos, la isla de Benidorm, alberga una importante población de la especie, pero las principales colonias se encuentran en zonas de exclusión, donde no está permitido el acceso a turistas. Sin embargo, en Benidorm parece que algunos individuos pudieran estar bastante habituados a la presencia de turistas, ya que se han detectado paíños reproduciéndose en zonas con intensa presencia humana (datos propios). La colonia de nidificación en los acantilados de Ogoño (Bizkaia) está expuesta a la visita de escaladores, ya que se han detectado escaladas y descensos en antiguas vías cercanas a la colonia, desarrollándose esta actividad durante la primavera y el verano. Estas actividades pueden llegar a afectar a la colonia de cría de los paíños en el caso de que los escaladores accediesen a las cuevas (Garaita, 2015; Garaita y Del Villar, 2008). En el año 2010 se publicó la Regulación de la Escalada en Bizkaia donde se inventariaban todas las zonas de Bizkaia susceptibles de ser escaladas, quedando prohibido la escalada en la mayor parte de los acantilados de Ogoño con el fin de proteger a las aves nidificantes entre las que se encuentra el paíño. Anteriormente se procedió a la colocación de carteles informativos de la prohibición de la escalada y la espeleología en la cara norte del acantilado. A pesar de todo, en los siguientes años se detectaron escaladas y rápeles ilegales en fechas de reproducción de las aves, por lo que se procedió a desequipar varias de las vías existentes (Garaita, 2016).
Pesca Las aves marinas pueden verse afectadas por la actividad pesquera tanto directa como indirectamente. La captura incidental en artes de pesca, como el palangre, afecta gravemente a algunas poblaciones y especies de aves marinas (Cooper et al., 2003; Velando y Munilla, 2008; Rodríguez et al. 2019). Sin embargo, debido a su pequeño tamaño y el de sus presas (ver apartado Ecología trófica), el paíño europeo no es susceptible de ser capturado incidentalmente en palangres. Tampoco se han descrito capturas accidentales para esta especie en redes de enmalle (ydelis et al., 2013). Por otra parte, las pesquerías suministran importantes cantidades de alimento a las aves marinas en forma de descartes pesqueros, que pueden influenciar la demografía, comportamiento y funcionamiento de las comunidades de aves marinas (Real et al., 2018). En el caso del paíño europeo se ha observado un uso poco frecuente de descartes pesqueros (Valeiras, 2003; Bicknell et al., 2013). Han sido observados tras arrastreros faenando sobre el talud continental de la flota de Santa Pola que pescan gamba principalmente, siendo avistados en la mayoría de los lances, aunque en bajo número (Sallent et al., 2006). A pesar de que los descartes no representarían un alto porcentaje de su dieta, cambios en la política de descartes (reducción/desaparición) podrían ocasionar un aumento de la depredación de paíños por especies generalistas como las gaviotas (Bicknell et al., 2013), tal y como se ha demostrado en el caso del aumento de depredación de aves marinas por págalos ante la escasez de descartes (Votier et al. 2004a, b). Finalmente, el paíño podría verse afectado por las pesquerías debido a potenciales procesos de sobreexplotación pesquera y reducción de recursos.
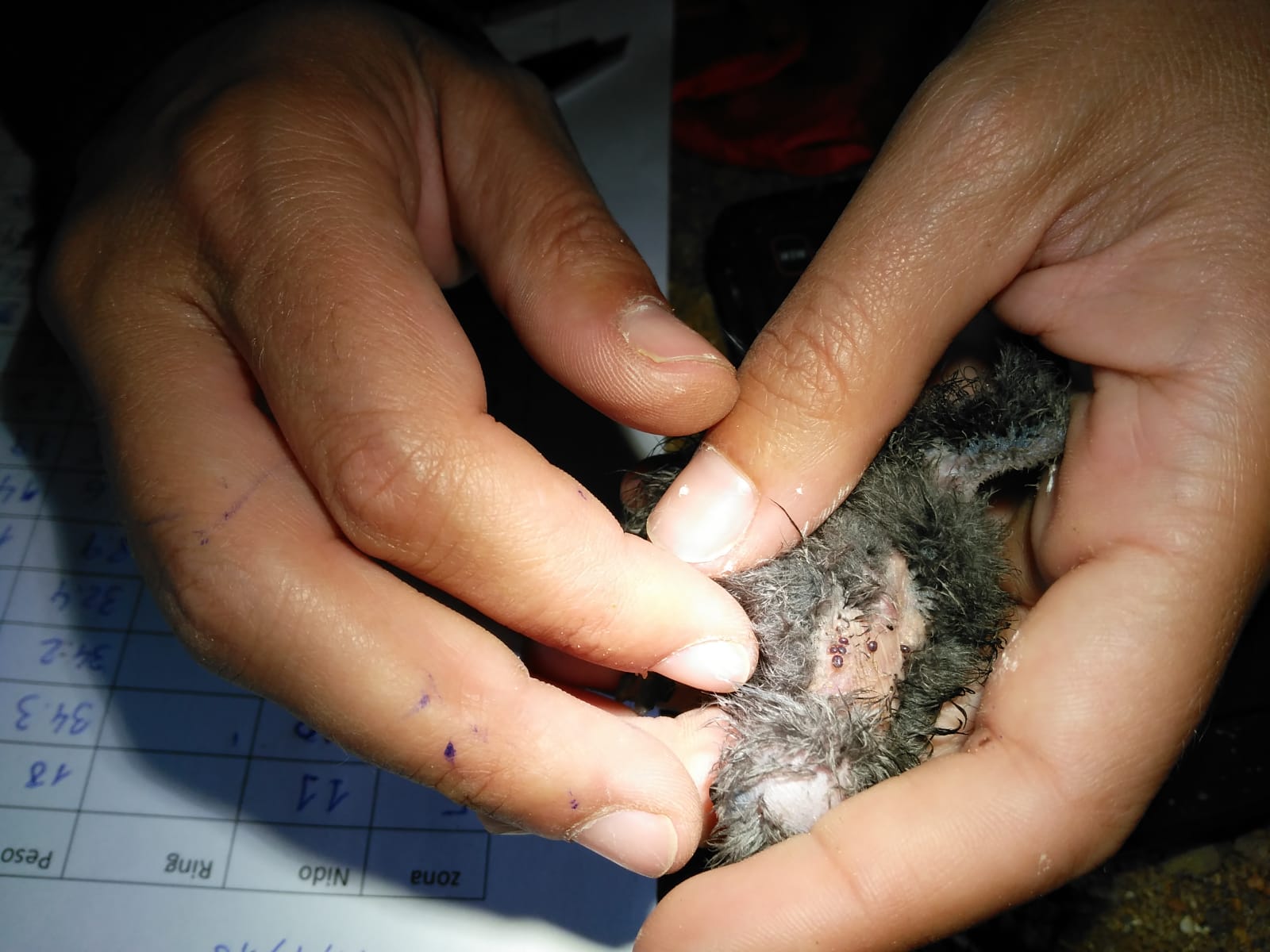
Parásitos El potencial efecto de los parásitos en el paíño europeo está poco estudiado. Merino et al (1999) indican que los ectoparásitos pueden tener un efecto negativo en el crecimiento y supervivencia de los pollos. Evidencias recientes apuntan a que altas densidades de garrapatas blandas Ornithodoros maritimus en la colonia de s’Espartar (Ibiza) pueden ser las responsables de la alta mortalidad de pollos de paíño detectada en dicha colonia (Figura 5; Sanz-Aguilar et al., 2018b, c).
Figura 5. Larvas de Ornithodoros maritimus parasitando un pollo de paíño europeo en la colonia de s’Espartar (Ibiza) (© V. Picorelli).
Destrucción/modificación del hábitat Uno de los factores de modificación del hábitat que afectan al paíño europeo es el aumento de la contaminación lumínica en los alrededores de las colonias de cría (ver apartado “contaminación”). Hoy en día, las colonias de paíño se localizan en entornos protegidos donde no está permitido el desarrollo urbanístico, aunque en el pasado este aspecto podría haber condicionado la desaparición de lugares de cría aptos para la especie (Mínguez et al., 2003). En algunas colonias se han descrito fenómenos de destrucción del hábitat de nidificación por pisoteo y desestabilización del terreno asociados al aumento de la cabaña ovina (en islotes de Irlanda y Reino Unido (Mitchell y Newton, 2004) o cormoranes (en Bretaña, Francia: Cadiou et al., 2010). También las tormentas de gran intensidad pueden desestabilizar o modificar su hábitat de reproducción (Cadiou et al., 2010). La instalación de cajas nido se ha utilizado en algunas colonias como una medida de conservación para evitar el deterioro del hábitat de nidificación.
Cambio climático El cambio climático puede afectar a los paíños tanto de forma directa como indirecta, a través de efectos en el ecosistema marino (Keogan et al., 2018; Mauck et al., 2018). Las condiciones meteorológicas tienen un efecto directo en factores como la supervivencia y la reproducción del paíño, tanto durante el periodo invernal como en el reproductor (Matovic et al., 2017). En concreto, los episodios meteorológicos extremos son uno de los elementos más importantes del cambio climático que podría afectar a los paíños (Jentsch et al., 2007). El cambio climático está provocando alteraciones en los patrones de las perturbaciones y puede alterar la frecuencia e intensidad de los denominados ciclones subtropicales (Knutson et al., 2010; Baatsen et al., 2015). Las ciclogénesis explosivas son una variedad de estos ciclones (Elkins, 2010). Blomqvist y Peterz (1984) sugirieron que los petreles, que viven en el océano abierto, podrían evitar volar dentro de los centros de los ciclones y, posiblemente, podrían evitar de forma activa las grandes perturbaciones (Fiedler et al., 2013). No obstante, estos sucesos afectan a las cadenas tróficas marinas y al complejo de intercambio de procesos en los ecosistemas (Thompson y Ollason, 2001; Frederiksen et al., 2007; Rossoll et al., 2012). Así, la prolongada incapacidad de alimentarse durante periodos de grandes perturbaciones asociadas a fuertes vientos, debilitarían a los paíños. La pérdida de peso debido al consumo de la grasa corporal causa la pérdida de aislamiento térmico frente a medios húmedos y fríos (el océano abierto, Elkins, 2010). Además, los cambios en la abundancia de presas durante el periodo pre-reproductor y durante la cría de los pollos, puede resultar en variaciones de la condición corporal de los adultos, afectando su calidad como reproductor y su propia supervivencia (Soldatini et al., 2014). Estos episodios extremos están aumentando en frecuencia y en intensidad (Easterling et al., 2000) y llegan a las costas atlánticas y cantábricas de la península ibérica con gran virulencia (fuertes vientos con rachas mantenidas por encima de 100 km/h, grandes olas y fuertes precipitaciones). Así, en la colonia vizcaína de Aketx se encontró una relación entre la aparición de este tipo de eventos en las costas cantábricas durante finales del invierno y primavera, y el retraso en el comienzo de la muda, además de un éxito reproductor más bajo en el paíño europeo (Zuberogoitia et al., 2016). Asimismo, en los años en los que se registraron estos fenómenos meteorológicos extremos, se observó también un incremento significativo de aves juveniles (2ac) en la colonia, que podría responder a un mayor número de individuos jóvenes prospectando la colonia o una menor reproducción (toma de sabáticos) de individuos experimentados. Los adultos reproductores evitarían reproducirse en años meteorológicamente adversos, primando la supervivencia propia a la reproducción (Soldatini et al., 2016; Zuberogoitia et al., 2016). Matovic et al. (2017) describieron para una población de paíño atlántica (Enez Kreiz, Bretaña, Francia) que la supervivencia adulta se relacionaba con las condiciones de las áreas de invernada en el atlántico sur (zona de Benguela) a través del índice de Santa Elena, y con las condiciones oceanográficas experimentadas durante la migración en el Atlántico (índice wENSO, relacionado con el fenómeno del Niño-la Niña), de la misma manera que influía en la supervivencia de otras especies de aves marinas como la pardela cenicienta Calonectris diomedea (Genovart et al., 2013). En zonas de cría, tormentas y oleaje de gran intensidad pueden ocasionar la destrucción de nidos y/o modificación de zonas de reproducción por inundación y/o movimiento de rocas (Cadiou et al., 2010). En el mar, las tormentas pueden ocasionar el desplazamiento de individuos a gran distancia tierra adentro (De Juana y García, 2015). De hecho, la especie se denomina en inglés “storm petrel” en referencia a la aparición de individuos varados en playas después de las tormentas. Los factores meteorológicos, la lluvia y temperaturas bajas, afectan también a las colonias del Mediterráneo. En concreto, Soldatini et al. (2014) encontraron un efecto directo de estos dos factores sobre la supervivencia de los pollos y relacionaron la supervivencia de adultos con las condiciones ambientales del invierno (temperatura superficial del mar) previo en el mar de Alborán, sugiriendo que esta zona podría representar una de las zonas de invernada de la especie en el Mediterráneo. En relación a los paíños reproductores de la isla Benidorm no se ha podido asociar su supervivencia ni éxito reproductor a la temperatura del mar (Hernández et al., 2017) pero sí aparece una relación entre su supervivencia y el índice de Oscilación del Mediterráneo Occidental (WeMOI; Matovic et al., 2017). Es posible que los paíños mediterráneos experimenten condiciones oceanográficas más benignas que los paíños atlánticos, lo que podría conferirles ventajas en su supervivencia (Matovic et al., 2017). Finalmente, el aumento del nivel del mar asociado al cambio climático podría afectar a zonas de reproducción situadas a poca altura sobre el nivel del mar, haciéndolas más susceptibles a los efectos del oleaje y tormentas marinas (Figura 6; Madeiros et al., 2012).
Figura 6. Los ciclones extratropicales azotan el Cantábrico con fuerza. En el invierno de 2014 hubo una sucesión de ellos, registrándose olas de más de 20 m de altura que, como la de la foto en San Juan de Gaztelugatxe, golpearon con extrema virulencia el litoral (© J. Isasi).
Referencias Arce, F., Orizaola, G., Navedo, J.G. (2011). Storm petrel’s breeding skipping in response to oil-spill pollution: Raising concerns over Zabala et al. (2011) methodological approach. Marine Pollution Bulletin, 62: 2576-2577. Azkona, A., Zuberogoitia, I., Martinez, J.A., Etxezarreta, J., Iraeta, A., Castillo, I., Zabala, J., Hidalgo, S. (2006). Short-term effects of the prestige oil spill on a colony of European storm--petrels Hydrobates pelagicus. Dong wu xue bao.[Acta zoologica Sinica], 52(6): 1042-1048. Baatsen, M., Haarsma, R.J., Van Delden, A.J., De Vries, H. (2015). Severe autumn storms in future western Europe with a warmer Atlantic Ocean. Climate Dynamics, 45: 949-964. Bécares, J., Rodríguez, B., Torrent, J., Barros, Á., Romai, C.D., Ruiz, A., Arcos, J.M. (2011). Distribución del paíño europeo Hydrobates pelagicus en aguas peninsulares españolas durante el periodo reproductor. En: Valeiras, X., Muñoz, G., Bermejo, A., Arcos, J.M. y Paterson, A.M. (Eds.). Actas del 6o Congreso del GIAM y el Taller internacional sobre la Ecología de Paiños y Pardelas en el sur de Europa Boletín del Grupo Ibérico de Aves Marinas, 34. Bicknell, A.W., Oro, D., Camphuysen, K.C., Votier, S.C. (2013). Potential consequences of discard reform for seabird communities. Journal of Applied Ecology, 50: 649-658. BirdLife International (2018). Species factsheet: Hydrobates pelagicus. Descargado de http://www.birdlife.org on 10/09/2018. Blackmer, A.L., Ackerman, J.T., Nevitt, G.A. (2004). Effects of investigator disturbance on hatching success and nest-site fidelity in a long-lived seabird, Leach’s storm-petrel. Biological Conservation, 116: 141-148. Blomqvist, S., Peterz, M. (1984). Cyclones and pelagic seabird movements. Marine ecology progress series. Oldendorf, 20: 85-92. Buij, R., Gschweng, M. (2017). Nocturnal hunting by Eleonora’s Falcons Falco eleonorae on their breeding and non-breeding grounds. Acta Ornithologica, 52: 35-49. Burger, J., Gochfeld, M. (1999) Role of human disturbance in response behavior of Laysan albatrosses (Diomedea immutabilis). Bird Behavior, 13: 23-30. Cadiou, B. (2013). Nocturnal predation by the Grey Heron Ardea cinerea on the European Storm-petrel Hydrobates pelagicus. Seabird, 26: 93-95. Cadiou, B., Bioret, F., Chenesseau, D. (2010). Response of breeding European Storm Petrels Hydrobates pelagicus to habitat change. Journal of Ornithology, 151: 317-327. Cadiou, B., Riffaut, L., McCoy, K.D., Cabelguen, J., Fortin, M., Gélinaud, G., Le Roch, A., Tirard, C., Boulinier, T. (2004). Ecological impact of the “Erika” oil spill: Determination of the geographic origin of the affected common guillemots. Aquatic Living Resources, 17: 369-377. Carney, K.M., Sydeman, W.J. (1999). A review of human disturbance effects on nesting colonial waterbirds. Waterbirds, 22: 68-79. Castege, I., Lalanne, Y., Gouriou, V., Hemery, G., Girin, M., D’amico, F., Mouches, C., D’Elbee, J., Soulier, L., Pensu, J. (2007). Estimating actual seabirds mortality at sea and relationship with oil spills: lesson from the “Prestige” oilspill in Aquitaine (France). Ardeola, 54: 289-307. Cooper, J., Baccetti, N., Belda, E.J., Borg, J.J., Oro, D., Papaconstantinou, C., Sánchez, A. (2003). Seabird mortality from longline fishing in the Mediterranean Sea and Macaronesian waters: a review and a way forward. Scientia Marina, 67: 57-64. Craik, C. (1997). Long-term effects of North American Mink Mustela vison on seabirds in western Scotland. Bird Study, 44: 303-309. Critchley, E.J., Grecian, W.J., Kane, A., Jessopp, M.J., Quinn, J.L. (2018). Marine protected areas show low overlap with projected distributions of seabird populations in Britain and Ireland. Biological Conservation, 224: 309-317. De Juana, E., Garcia, E. (2015). The birds of the Iberian Peninsula. Bloomsbury Publishing. London, UK. De León, A., Mínguez, E., Harvey, P., Meek, E., Crane, J.E., Furness, R.W. (2006). Factors affecting breeding distribution of Storm-petrels Hydrobates pelagicus in Orkney and Shetland. Bird Study, 53: 64-72. De León, L., Rodríguez, B., Martín, A., Nogales, M., Alonso, J., Izquierdo, C. (2007). Status, distribution, and diet of Eleonora’s falcon (Falco eleonorae) in the Canary Islands. Journal of Raptor Research, 41: 331-336. Easterling, D.R., Meehl, G.A., Parmesan, C., Changnon, S.A., Karl, T.R., Mearns, L.O. (2000). Climate extremes: observations, modeling, and impacts. Science, 289:2068-2074. Elkins, N. (2010). Weather and bird behaviour. Bloomsbury Publishing. London, UK. Fiedler, P.C., Redfern, J.V., Van Noord, J., Hall, C., Pitman, R.L., Ballance, L.T. (2013). Effects of a tropical cyclone on a pelagic ecosystem from the physical environment to top predators. Marine Ecology Progress Series, 484: 1-16. Franco, J., Etxezarreta, J., Galarza, A., Gorospe, G., Hidalgo, J. (2004) Seabird populations. En: Borja, A., Collins, M. (Eds.). Oceanography and Marine Environment of the Basque Country. Elsevier Oceanography Series, Amsterdam, pp.515–529. Franco Ruiz, A., Rodríguez de los Santos, M. (2001). Libro Rojo de los Vertebrados Amenazados de Andalucía. Consejería de Medio Ambiente, Junta de Andalucía.https://www.juntadeandalucia.es/medioambiente/portal_web/web/servicios/centro_ de_documentacion_y_biblioteca/fondo_editorial_digital/documentos_tecnicos/Libro_rojo_ertebrados/documento_completo.pdf Frederiksen, M., Furness, R.W., Wanless, S. (2007). Regional variation in the role of bottom-up and top-down processes in controlling sandeel abundance in the North Sea. Marine Ecology Progress Series, 337: 279-286. Frid, A., Dill, L. (2002). Human-caused disturbance stimuli as a form of predation risk. Conservation Ecology, 6: 11. Garaita, R. (2015). El Paíño europeo (Hydrobates pelagicus) en Urdaibai. Informe 2015. Biodibertsitatea eta Paisaia Zaintzeko Atala / Sección de Biodiversidad y Paisaje. Iraunkortasuna eta Ingurune Naturala Zaintzeko Saila / Departamento de Sostenibilidad y Medio Natural. Bizkaiko Foru Aldundia / Diputación Foral de Bizkaia. Informe inédito. Garaita, R. (2016). El paíño europeo Hydrobates pelagicus en Urdaibai. Informe 2016. Biodibertsitatea eta Paisaia Zaintzeko Atala / Sección de Biodiversidad y Paisaje. Iraunkortasuna eta Ingurune Naturala Zaintzeko Saila / Departamento de Sostenibilidad y Medio Natural. Bizkaiko Foru Aldundia / Diputación Foral de Bizkaia. Informe inédito. Garaita, R., Del Villar, J. (2008). El paíño europeo (Hydrobates pelagicus) en Urdaibai. Gobierno Vasco. Departamento de Medio Ambiente y Ordenación del Territorio. Informe inédito. García, L., Viada, C., Moreno-Opo, R., Carboneras, C., Alcalde, A., González, F. (2003). Impacto de la marea negra del Prestige sobre las aves marinas. SEO/BirdLife, Madrid, p.126. Genovart, M., Sanz-Aguilar, A., Fernández-Chacón, A., Igual, J.M., Pradel, R., Forero, M.G., Oro, D. (2013). Contrasting effects of climatic variability on the demography of a trans-equatorial migratory seabird. Journal of Animal Ecology, 82: 121-130. Glue, D.E. (1977). Feeding ecology of the Short-eared Owl in Britain and Ireland. Bird Study, 24: 70-78. Gobierno de Cantabria (2008). Seguimiento de la población del paíño europeo Hydrobates pelagicus en Cantabria. Informe inédito de Aves Cantábricas SL para la Consejería de Desarrollo Rural, Ganadería, Pesca y Biodiversidad. Gobierno de Cantabria (2017). Seguimiento de la población de paíño europeo Hydrobates pelagicus en Cantabria. Asistencia Técnica de Aves Cantábricas SL a la Dirección General del Medio natural de la Consejería de Medio Rural, Pesca y Alimentación del Gobierno de Cantabria. Guerra, C., García, D., ALcover, J.A. (2014). Unusual foraging patterns of the barn owl, Tyto alba (Strigiformes: Tytonidae), on small islets from the Pityusic archipelago (Western Mediterranean Sea). Folia Zoologica, 63: 180-187. Guirao, Á. (1859). Catálogo metódico de las aves observadas en una gran parte de la provincia de Murcia. Memorias de la Real Academia de Ciencias de Madrid. 3ª serie: 2: 540. Hemery, G., Delbee, E., Terrasse, J.F. (1986). Regulation of a storm-petrel Hydrobates pelagicus population by intermittent breeding. Comptes Rendus de l’Academie des Sciences Serie Iii-Sciences de la Vie-Life Sciences, 303: 353-356. Hernández, N., Oro, D., Sanz-Aguilar, A. (2017). Environmental conditions, age, and senescence differentially influence survival and reproduction in the Storm Petrel. Journal of Ornithology, 158: 113-123. Jenssen, B.M. (1994). Effects of oil pollution, chemically treated oil, and cleaning on thermal balance of birds. Environmental Pollution, 86: 207-215. Jentsch, A., Kreyling, J., Beierkuhnlein, C. (2007). A new generation of climate-change experiments: events, not trends. Frontiers in Ecology and the Environment, 5: 365-374. Keogan, K., Daunt, F., Wanless, S., Phillips, R.A., Walling, C.A., Agnew, P., Ainley, D.G., Anker-Nilssen, T., Ballard, G., Barrett ,R.T., Barton, K.J., Bech, C., Becker, P., Berglund, P-A ., Birkhead T., Bollache, L., Bond, A., Bouwhuis, S., Bradley, R., Burr, Z .,Camphuysen, K., Catry, P., Chiaradia, A., Christensen-Dalsgaard, S., Cuthbert, R .,Dehnhard, N., Descamps, S., Diamond, T., Divoky, G., Drummond, H., Dugger, KM., Dunn, MJ .,Emmerson, L., Erikstad, KE., Fort, J., Fraser, W., Gaston, A., Genovart, M., Gilg, O., González-Solís, J., Gremillet, D., Hansen, J., Hanssen, S. A., Harris, M., Hedd, A., Hinke, J., Igual, J. M., Jahncke, J ., Jones, I., Kappes, P.J., Lang, J., Langset, M., Lescroël, A., Lorentsen, S.H., Lyver, P.O’B., Mallory, M., Moe, B., Montevecchi, W.A., Monticelli, D., Mostello, C., Newell, M., Nicholson, L ., Nisbet, I., Olsson, O., Oro, D., Pattison, V., Poisbleau, M., Pyk, T., Quintana, F., Ramos, J., Ramos, R., Reiertsen, TK., Rodríguez, C., Ryan, P., Sanz-Aguilar, A., Schmidt, N.M., Shannon, P., Sittler, B., Southwell, C., Surman, C., Svagelj, W.S., Trivelpiece, W., Warzybok, P., Watanuki, Y., Weimerskirch, H., Wilson, P. R., Wood, A. G., Phillimore. A. B., Lewis. S. (2018) Global phenological insensitivity to shifting ocean temperatures among seabirds. Nature Climate Change, 8:313-318. Knutson, T.R., McBride, J.L., Chan, J., Emanuel, K., Holland, G., Landsea, C., Held, I., Kossin, J.P., Srivastava, A.K., Sugi, M. (2010). Tropical cyclones and climate change. Nature, Geoscience 3: 157. Libois, E., Gimenez, O., Oro, D., Mínguez, E., Pradel, R., Sanz-Aguilar, A. (2012). Nest boxes: A successful management tool for the conservation of an endangered seabird. Biological Conservation, 155: 39-43. Lorenzo, J.A., Barone, R. (2007). Paíño europeo, Hydrobates pelagicus. En: Atlas de las aves nidificantes en el archipiélago canario (1997-2003). Lorenzo, J.A. (Ed.). Madrid, Dirección General de la conservación de la Naturaleza-Sociedad Española de Ornitología. LoValvo, F., Massa, B. (2000). Some aspects of the population structure of storm petrels Hydrobates pelagicus breeding on a Mediterranean island. Ringing & Migration, 20: 125-128. Madeiros, J., Carlile, N., Priddel, D. (2012). Breeding biology and population increase of the Endangered Bermuda Petrel Pterodroma cahow. Bird Conservation International, 22:35-45. Martin, J., Thibault, J., Bretagnolle, V. (2000). Black rats, island characteristics, and colonial nesting birds in the Mediterranean: consequences of an ancient introduction. Conservation Biology, 14:1452-1466. Martínez-Abraín, A., Oro, D., Berenguer, R., Ferrís, V., Velasco, R. (2005). Long-term changes of species richness in a breeding bird community of a small Mediterranean archipelago. Animal Biodiversity and Conservation, 28: 131-136. Matovic, N., Cadiou, B., Oro, D., Sanz-Aguilar, A. (2017). Disentangling the effects of predation and oceanographic fluctuations in the mortality of two allopatric seabird populations. Population Ecology, 59: 225-238. Mauck, R.A., Dearborn, D.C., Huntington, C.E. (2018). Annual global mean temperature explains reproductive success in a marine vertebrate from 1955 to 2010. Global Change Biology, 24: 1599-1613. Merino, S., Mínguez, E., Belliure, B. (1999). Ectoparasite effects on nestling European storm-petrels. Waterbirds, 22: 297-301. Mínguez, E. (1994). Censo, cronología de puesta y éxito reproductor del paíño común (Hydrobates pelagicus) en la Isla de Benidorm (Alicante E de España). Ardeola 41 :3-11. Mínguez, E. (2004) Paíño Europeo, Hydrobates pelagicus. En: Madroño A, González C, Atienza JC (eds). Libro Rojo de las Aves de España. Dirección General para la Biodiversidad-SEO/BirdLife, Madrid, pp.55–57. Mínguez, E., Vigil, A. (1995). Approche de la distribution du Pétrel Tempête, Hydrobates pelagicus, reproducteur dans la région cantabrique. Alauda, 63: 299-305. Mínguez, E., Oro, D., de Juana, E., Martínez-Abraín, A. (2003). Mediterranean seabird conservation: what can we do? Scientia Marina, 67 (S2): 3-6. Mitchell, P.I., Newton, S.F. (2004) European storm-petrel Hydrobates pelagicus. En: Seabird populations of Britain and Ireland. T, AD Poyser, London, pp.81-100. Okill, J.D., Bolton, M. (2005). Ages of Storm Petrels Hydrobates pelagicus prospecting potential breeding colonies. Ringing & Migration, 22: 205-208. Oppel, S., Bolton, M., Carneiro, A.P.B., Dias, M.P., Green, J.A., Masello, J.F., Phillips, R.A., Owen, E., Quillfeldt, P., Beard, A., Bertrand, S., Blackburn, J., Boersma, P.D., Borges, A., Broderick, A.C., Catry, P., Cleasby,I., Clingham, E., Creuwels, J., Crofts, S., Cuthbert, R.J., Dallmeijer, H., Davies, D., Davies, R., Dilley, B.J., Dinis, H.A., Dossa, J., Dunn, M.J., Efe, M.A., Fayet, A.L., Figueiredo, L., Pereira Frederico, A., Gjerdrum, C., Godley, B.J., Granadeiro, J.P., Guilford, T., Hamer, K.C., Hazin, C.H., Hedd, A., Henry, L., Hernández-Montero, M., Hinke, J., Kokubun, N., Leat, E., McFarlane Tranquilla, L., Metzger, B., Militão, T., Montrond, G., Mullié, W., Padget, O., Pearmain, E.J., Pollet, I.L., Pütz, K., Quintana, F., Ratcliffe, N., Ronconi, R.A., Ryan, P., Saldanha, S., Shoji, A., Sim, J., Small, C., Soanes, L., Takahashi, A., Trathan, P., Trivelpiece, W., Veen, J., Wakefield, E., Weber, N., Weber, S., Zango, L., Daunt, F., Ito, M., Harris, M.P., Newell, M.A., Wanless, S., González-Solís, J., Croxall, J. (2018). Spatial scales of marine conservation management for breeding seabirds. Marine Policy, 98: 37-46. Oro, D. (2014). Seabirds and climate: knowledge, pitfalls, and opportunities. Frontiers in Ecology and Evolution, 2:79. Oro, D., De León, A., Mínguez, E., Furness, R.W. (2005). Estimating predation on breeding European storm-petrels (Hydrobates pelagicus) by yellow-legged gulls (Larus michahellis). Journal of Zoology 265: 421-429. Ramírez, F., Afán, I., Tavecchia, G., Catalán, I.A., Oro, D., Sanz-Aguilar, A. (2016). Oceanographic drivers and mistiming processes shape breeding success in a seabird. Proceedings of the Royal Society Series B, 283: 20152287 Ramos, J.A., Monteiro, L.R., Sola, E., Moniz, Z. (1997). Characteristics and competition for nest cavities in burrowing Procellariiformes. Condor, 99: 634-641. Ratcliffe, N., Vaughan, D., Whyte, C., Shepherd, M. (1998). Development of playback census methods for Storm Petrels Hydrobates pelagicus. Bird Study, 45: 302-312. Real, E., Tavecchia, G., Genovart, M., Sanz-Aguilar, A., Payo-Payo, A., Oro, D. (2018). Discard-ban policies can help improve our understanding of the ecological role of food availability to seabirds. Scientia Marina, 82S1: 115-120. Rodriguez, A., Rodríguez, B. (2009). Attraction of petrels to artificial lights in the Canary Islands: effects of the moon phase and age class. Ibis, 151: 299-310. Rodríguez, A., García, D., Rodríguez, B., Cardona, E., Parpal, L., Pons, P. (2015). Artificial lights and seabirds: is light pollution a threat for the threatened Balearic petrels? Journal of Ornithology, 156: 893-902. Rodríguez, A., Arcos, J.M., Bretagnolle, V., Dias, M.P., Holmes, N.D., Louzao, M., Provencher, J., Raine, A.F., Ramírez, F., Rodríguez, B., Ronconi, R.A., Taylor, R.S., Bonnaud, E., Borrelle, S.B., Cortés, V., Descamps, S., Friesen, V.L., Genovart, M., Hedd, A., Hodum, P., Humphries, G.R.W., Le Corre, M., Lebarbenchon, C., Martin, R., Melvin, E.F., Montevecchi, W.A., Pinet, P., Pollet, I.L., Ramos, R., Russell, J.C., Ryan, P.G., Sanz-Aguilar, A., Spatz, D.R., Travers, M., Votier, S.C., Wanless, R.M., Woehler, E., Chiaradia, A., (2019). Future Directions in Conservation Research on Petrels and Shearwaters. Frontiers in Marine Science 6: 94. Rossoll, D., Bermúdez, R., Hauss, H., Schulz, K.G., Riebesell, U., Sommer, U., Winder, M. (2012). Ocean acidification-induced food quality deterioration constrains trophic transfer. PLoS one, 7 (4): e34737. Sæther, B.-E., Bakke, Ø. (2000). Avian life history variation and contribution of demographic traits to the population growth rate. Ecology, 81: 642-653. Sallent, A., Murcia, J. L., Barberá, G. (2006). Association of seabirds with commercial fisheries at Murcia Region. Poster. XVIII Congreso Español y III Ibérico de Ornitología. 12 al 15 de octubre de 2006, Elche, Alicante. Sanz-Aguilar, A., Massa, B., Lo Valvo, F., Oro, D., Mínguez, E., Tavecchia, G. (2009a). Contrasting age-specific recruitment and survival at different spatial scales: a case study with the European storm petrel. Ecography, 32: 637-646. Sanz-Aguilar, A., Martínez-Abraín, A., Tavecchia, G., Mínguez, E., Oro, D. (2009b). Evidence-based culling of a facultative predator: efficacy and efficiency components. Biological Conservation, 142: 424-431. Sanz-Aguilar, A., Payo-Payo, A., Igual, J.M., Rotger, A., Negre, N., Picorelli, V., Viñas, M., Martínez, O., Cardona, E., Luna, R. (2018b). Estudi de la influència de les paparres (Ornithodoros maritimus) sobre els paràmetres demogràfics dels fumarells (Hydrobates pelagicus) a la colònia de s’Espartar. Informe d’activitats i resultats de la campanya. Govern Balear. Informe inédito. Sanz-Aguilar, A., Rotger, A., Igual, J.M., Payo-Payo, A., Miranda, M.A., Viñas, M., Cardona, E., Martínez, O., Picorelli, V. (2018c). Efecte de les paparres (Ornithodoros maritimus) sobre els fumarells (Hydrobates pelagicus) a la colònia de s’Espartar. En: VII Jornades de Medi Ambient de les Illes Balears. Ponències i Resums (ISBN 978-84-09-06632-2). Societat d’Història Natural de les Balears. Palma de Mallorca. Pp : 450-453. Scott, D. (1970) The breeding biology of the Storm Petrel Hydrobates pelagicus.Tesis doctoral. Universidad de Oxford, UK. Soldatini, C., Albores-Barajas, Y.V., Massa, B., Gimenez, O. (2014). Climate driven life histories: the case of the Mediterranean storm petrel. PloS one, 9: e94526. Soldatini, C., Albores-Barajas, Y.V., Tagliavia, M., Massa, B., Fusani, L., Canoine, V. (2015). Effects of human disturbance on cave-nesting seabirds: the case of the storm petrel. Conservation Physiology, 3(1): cov041. Soldatini, C., Albores-Barajas, Y.V., Massa, B., Gimenez, O. (2016). Forecasting ocean warming impacts on seabird demography: a case study on the European storm petrel. Marine Ecology Progress Series, 552: 255-269. Swan, G.J.F., Redpath, S.M., Bearhop, S., McDonald, R.A. (2017). Ecology of problem individuals and the efficacy of selective wildlife management. Trends in Ecology and Evolution, 32: 518-530. Tenan S, Pradel R, Tavecchia G, Igual JM, Sanz-Aguilar A, Genovart M, Oro D. (2014). Hierarchical modelling of population growth rate from individual capture-recapture data. Methods in Ecology and Evolution, 5: 606-614. The internet IBC Bird Collection (2018) https://www.hbw.com/ibc/video/short-eared-owl-asio-flammeus/genovesa-island-bird-plucking-and-feeding-storm-petrel. Thompson, P.M., Ollason, J.C. (2001). Lagged effects of ocean climate change on fulmar population dynamics. Nature, 413: 417. Trivelpiece, W.Z., Butler, R.G., Miller, D.S., Peakall, D.B. (1984). Reduced survival of chicks of oil-dosed adult Leach’s storm-petrels. Condor, 86: 81-82. Valeiras, J. (2003). Attendance of scavenging seabirds at trawler discards off Galicia, Spain. Scientia Marina, 67 (S2):77-82. Velando, A., Munilla, I. (2008). Plan de Conservación del Cormorán moñudo en el Parque Nacional de las Islas Atlánticas. Universidade de Vigo-OA Parques Nacionales. Ministerio de Medio Ambiente. Viada, C. (2006). Libro Rojo de los Vertebrados de las Baleares. Conselleria de Medi Ambient, Govern de les Illes Balears. https://www.caib.es/sacmicrofront/archivopub.do?ctrl=MCRST272ZI81777&id=81777 Votier, S.C., Bearhop, S., Ratcliffe, N., Phillips, R.A., Furness, R.W. (2004a). Predation by great skuas at a large Shetland seabird colony. Journal of Applied Ecology, 41:1117-1128. Votier, S. C., Furness, R. W., Bearhop, S., Crane, J. E., Caldow, R. W. G., Catry, P., Ensor, K., Hamer, K. C., Hudson, A. V., Kalmbach, E., Klomp, N. I., Pfeiffer, S., Phillips, R. A., Prieto, I. and Thompson, D. R. (2004b). Changes in fisheries discard rates and seabird communities. Nature 427:727-730. Warham, J. (1990). The petrels: their ecology and breeding systems. Academic Press. London, UK. Watson, H., Bolton, M., Monaghan, P. (2014). Out of sight but not out of harm’s way: human disturbance reduces reproductive success of a cavity-nesting seabird. Biological Conservation, 174:127-133. Zabala, J., Zuberogoitia, I., Martínez-Climent, J.A., Etxezarreta, J. (2011a). Do long lived seabirds reduce the negative effects of acute pollution on adult survival by skipping breeding? A study with European storm petrels (Hydrobates pelagicus) during the “Prestige” oil-spill. Marine Pollution Bulletin, 62 : 109-115. Zabala, J., Zuberogoitia, I., Martínez-Climent, J.A. (2011b). Storm petrel’s breeding skipping in response to oil-spill pollution: A valid methodological approach by Zabala et al. (2001). Marine Pollution Bulletin, 62: 2578-2579. Zuberogoitia, I., Torres, J. (1998). Aves acuáticas de Bizkaia.Temas Vizcaínos, BBK. Bilbao. Zuberogoitia, I., Ruiz Moneo, F., Torres, J. (2002). El Halcón Peregrino. Servicio Publicaciones de la Diputación Foral de Bizkaia. Zuberogoitia, I., Martínez, J.E., González-Oreja, J.A., Calvo, J.F., Zabala, J. (2013). The relationship between brood size and prey selection in a Peregrine Falcon population located in a strategic region on the Western European Flyway. Journal of Ornithology, 154: 73-82. Zuberogoitia, I., Zabala, J., Etxezarreta, J., Crespo, A., Burgos, G., Arizaga, J. (2016). Assessing the impact of extreme adverse weather on the biological traits of a European storm petrel colony. Population Ecology, 58: 303-313. ydelis, R., Small, C., French, G. (2013). The incidental catch of seabirds in gillnet fisheries: A global review. Biological Conservation, 162: 76-88.
Ana Sanz-Aguilar, Iñigo Zuberogoitia, Ángel Sallent, Fecha de publicación: 4-06-2019 Sanz-Aguilar, A., Zuberogoitia, I., Sallent, Á., Picorelli, V., Navedo, J.G., Garaita, R. (2019). Paíño europeo – Hydrobates pelagicus. En: Enciclopedia Virtual de los Vertebrados Españoles. López, P., Martín, J., González-Solís, J. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
|
||||||||||||
|
|
|||||||||||||
|
|
|||||||||||||