|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Para más información sobre cada apartado hacer click en:
|
Key words: Spur-thighed tortoise, reproduction, demography.
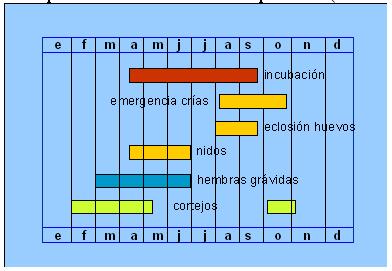
Biología de la reproducciónCiclo anual El periodo de reproducción de las tortugas se ha descrito con detalle para la población de Doñana (Andreu y Villamor, 1986; Andreu, 1987; Díaz-Paniagua et al., 1996; Andreu et al., 2000). Los primeros cortejos se observan en otoño, normalmente en el mes de octubre, aunque en algunos años de otoños muy secos, el periodo de actividad otoñal es muy reducido o casi nulo. El principal período de actividad sexual se inicia a finales de invierno, manteniéndose durante casi toda la primavera desde febrero hasta mayo. Se vuelven a observar cortejos tras la estivación, en los primeros días de temperaturas suaves (Andreu et al., 2000). A partir de marzo se puede apreciar, a través de radiografías, que las hembras ya están desarrollando sus primeros huevos (Díaz-Paniagua et al., 1996). Realizan las puestas más tempranas a principios de abril y las últimas se producen a finales de Junio (Díaz-Paniagua et al., 1996) o incluso, ocasionalmente, a principios de Julio (datos inéditos). La incubación de los huevos continúa durante el verano, naciendo las primeras crías en el mes de Agosto y las que proceden de las últimas puestas durante el mes de septiembre (Díaz-Paniagua et al., 1997).
Figura 1. Calendario reproductivo de Testudo graeca en el área de Doñana (según datos de Díaz-Paniagua et al., 1996, 1997 y 2006).
Comportamiento sexualLos machos de tortuga mora realizan una intensa búsqueda de hembras al principio de la actividad posthibernal. En la mayoría de los casos, el macho, tras aproximarse a la hembra, inicia el cortejo con un intenso golpeteo al caparazón de ésta. Para ello, lanza bruscamente la parte anterior de su caparazón repetidamente contra el de la hembra. Puede dirigir los golpes tanto a la parte posterior como a la anterior o lateral de la hembra. Si ella permanece inmóvil, después de los primeros golpes, la rodea activamente e inicia de nuevo el golpeteo en la parte opuesta. Esta fase puede alargarse durante una hora o más, dependiendo de la respuesta de la hembra, aunque en ocasiones es muy corta o incluso no se realiza. Normalmente, los golpes del macho obligan a la hembra a desplazarse y comienza a caminar, produciéndose entonces una persecución, en la que el macho anda detrás, muy próximo a ella y efectuando frecuentes golpes contra la parte posterior de su caparazón. Cuando la hembra se para, el macho comienza nerviosamente a rodearla, golpeándola lateral o frontalmente, y a veces mordisqueando sus patas delanteras, el borde del caparazón o la cabeza. Posteriormente, se sitúa diligentemente en la parte posterior y comienza a trepar con sus patas anteriores sobre el caparazón de la hembra, hasta situarse en posición casi vertical, perpendicular a ella, introduciendo entonces su cola bajo la de la hembra, efectuando a continuación la cópula (Andreu et al., 2000, y datos no publicados). Los machos pueden montar a las hembras también durante la persecución, cuando acelerando su paso comienzan a trepar sobre el caparazón de la hembra mientras ella sigue andando. Son frecuentes los casos de monta en el que los machos no consiguen mantener su posición sobre la hembra y acaban quedándose detrás, inmóviles o continuando la persecución. Con frecuencia hemos observado que las hembras efectúan comportamientos de rechazo del macho, girándose bruscamente mientras que los machos están montándolas, lo que ocasiona la caída de éstos, que a veces quedan boca arriba. Los machos suelen insistir tras estos intentos, continuando con sus cortejos.También es frecuente observar que las hembras, al sentirse golpeadas, se quedan inmóviles, con el peto apoyado completamente contra el suelo, lo que parece indicar un rechazo al macho. A ello los machos suelen responder con la insistencia de golpeteos y, los de gran tamaño, incluso llegan a forzar la elevación de la parte posterior de la hembra, tras trepar a su caparazón y levantarlas al introducir por debajo su cola (Datos propios).
Figura 2. Tortugas durante la cópula. © A. C. Andreu.
Estrategias reproductivas: Múltiple paternidad y almacenamiento de esperma En las tortugas, los machos sólo suelen tener contacto con las hembras durante los momentos del cortejo y de la cópula. Cuando ésto se termina o interrumpe, la pareja se separa, continuando normalmente el macho con la búsqueda de otras hembras. Hemos observado frecuentemente que las hembras copulan con distintos machos dentro del mismo periodo anual. En un estudio en el que se ha analizado el genotipo de las crías de 15 puestas obtenidas de 8 hembras de tortugas, se observó que en un 20% de las puestas se produjo múltiple paternidad, pues se genotiparon en dos puestas crías de dos padres diferentes (Roques et al., 2004). En general, la tasa de multiple paternidad en esta especie es baja, como también ocurre en otras especies de quelonios, aunque en el caso de Testudo graeca, el bajo número de huevos de cada puesta disminuye la probabilidad de que exista mayor número de padres por puesta. Asimismo, en la pequeña muestra de puestas analizadas, se encontró una amplia variación en cuanto a la paternidad de las puestas (Roques et al., 2004): a) el mismo padre en puestas sucesivas de una misma hembra; b) distinto y único padre en cada una de las dos puestas de una misma hembra; c) Algunas crías de la segunda puesta poseía el mismo padre que las de la puesta anterior y además había otras crías con un padre diferente (múltiple paternidad en una de las puestas); d) puestas con dos padres (múltiple paternidad) que coinciden en las dos puestas sucesivas. En este estudio nos habíamos propuesto liberar a las hembras inmediatamente después de que realizaran su primera puesta, para que pudieran tener acceso a cópulas que pudieran fertilizar su segunda puesta. Sin embargo, sólo en dos hembras se pudo cumplir esta metodología, mientras que en cuatro detectamos el nido entre 7 y 10 días después de la fecha de puesta (por lo que consideramos que, en el momento de la liberación, los huevos podían estar ya fecundados e iniciada la formación de la cáscara), y en un caso no conseguimos detectar el primer nido, por lo que no pudimos liberar a la hembra hasta que no realizó su segunda puesta, encontrándose entonces sus dos nidos. Todas las hembras liberadas tardíamente mostraron la misma paternidad en sus dos puestas (de un solo padre: estrategias a; y de dos padres: estrategia d) lo que sugiere el uso de esperma almacenado para la segunda puesta. Otro caso evidente de almacenamiento de esperma es el de la hembra no liberada entre puestas, que sin tener acceso a otros machos, mostró un padre diferente para la segunda puesta. Por el contrario, en las hembras liberadas durante el periodo de posible fertilización, sí se observó que la segunda puesta tenía distinta paternidad a la primera (estrategia b), aunque una de ellas tuvo también crías del primer padre, por lo que como consecuencia del almacenamiento de esperma del primer padre tuvo múltiple paternidad (estrategia c). El almacenamiento de esperma parece ser una estrategia frecuente en Testudo graeca, que favorece la existencia de múltiple paternidad, pero sobre todo facilita la fertilización de sus huevos aunque sea escasa la disponibilidad de machos. Con esta estrategia, las tortugas pueden fertilizar sus primeros huevos antes de que se produzcan las primeras cópulas primaverales, lo que puede contribuir a incrementar el número de puestas que cada hembra puede desarrollar en su periodo de actividad primaveral (Roques et al., 2004).
Tabla 1. Paternidad de las crías obtenidas de 15 puestas de 8 hembras de tortuga mora de Doñana (Roques et al., 2004). Se identifican 12 padres diferentes y se señalan los casos en que existe múltiple o única paternidad por puesta. Las cuatro estrategias de paternidad se explican en el texto. La columna sobre liberación de la hembra se refiere a la probabilidad de que su segunda puesta pueda o no haber sido fecundada por otro macho en el intervalo entre puestas: una hembra se mantiene en cautividad entre puestas sucesivas, cuatro se liberan en periodo en que no pueden ser fecundadas, dos se liberan inmediatamente tras la primera puesta.
Frecuencia de hembras reproductoras La mayoría (un 95,2%) de las hembras de Testudo graeca se reproducen en Doñana todos los años, a partir de su madurez. El mínimo porcentaje sin reproducción se atribuye al posible descenso de la actividad reproductora en hembras muy viejas (mayores de 30 años) (Díaz-Paniagua et al., 1996).
Tabla 2. Características de la reproducción de la tortuga mora en Doñana (Díaz-Paniagua et al., 1996).
Número de puestas anuales y número de huevos por puesta El número de huevos de cada puesta de las tortugas de Doñana se ha descrito, entre 1 y 7 huevos, con un promedio de 3,5 huevos (Díaz-Paniagua et al., 1996; con posterioridad a este trabajo en el mismo área hemos detectado una puesta de 8 huevos). El tamaño de la puesta se relaciona con la edad y con el tamaño de la hembra (Díaz-Paniagua et al., 2001; aunque en Díaz-Paniagua et al., 1996, no se observaba relación con el tamaño de la hembra, el mayor número de datos incluidos en el segundo trabajo mostró una significación en esta relación). En Doñana, las tortugas realizan entre una y cuatro puestas al año, aunque la mayoría de ellas realiza dos (media= 2,47 puestas/año). Entre sucesivas puestas, suelen transcurrir un número medio de 24,5 días (variación: 21-29 días). Las hembras que realizan mayor número de puestas tienen consecuentemente mayor periodo de ovoposición (tiempo comprendido entre la realización del primer y último nido), lo que se relaciona con el tamaño de las hembras, siendo las hembras mayores (aunque no las de mayor edad) las más tempranas en realizar sus nidos. Puesto que el número de puestas posibles está limitado por el periodo de actividad de las tortugas, en la población de Doñana se considera que el máximo periodo sería de unos 80 días (tiempo transcurrido entre la más temprana y la más tardía de las puestas detectadas), en el que podrían incluirse un total de cinco puestas (Díaz-Paniagua et al., 1996). Sin embargo, puesto que no suelen alcanzar este máximo número, se considera que la estrategia reproductiva de la tortuga mora refleja una inversión en reproducción moderada, lo que a largo plazo favorece una vida reproductiva más larga, como se sugiere también para otros quelonios (Congdon y Tinkle, 1982; Wilbur y Morin, 1988).
Figura 3. Cría de tortuga en el momento de la eclosión de un huevo incubado en laboratorio.© C. Díaz-Paniagua.
Características de los huevos La tortuga mora desarrolla huevos semiesféricos, con cáscara dura y de color blanco. Sus diámetros medios son, en promedio, 33,9 x 28 mm, y su peso medio es de 14,4 g. La anchura y el peso de los huevos esta relacionado con el tamaño de la hembra, mientras que no lo está la longitud de los huevos. El peso de un huevo constituye aproximadamente el 1,44% del peso de la hembra y no varía en relación al tamaño de la puesta. Cada puesta constituye, en promedio, un 4,93% del peso de la hembra, tendiendo las hembras de mayor tamaño a desarrollar mayor número de huevos en lugar de huevos de mayor peso (Díaz-Paniagua et al., 1996).
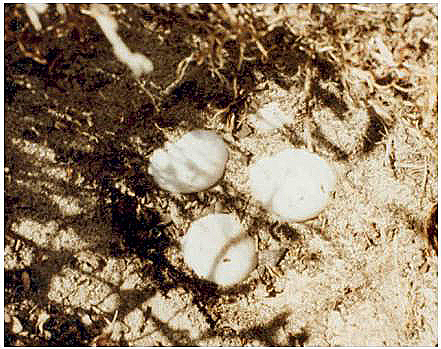
Figura 4. Huevos de tortuga en el interior de un nido abierto. © C. Keller.
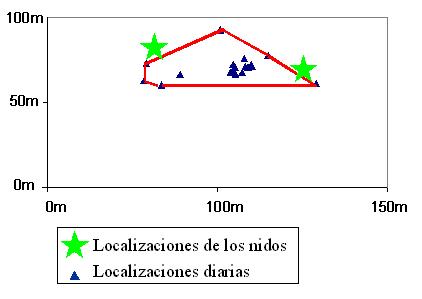
Comportamiento de puesta y características de los nidos Pocos días antes de efectuar la puesta, se observa en las hembras de tortuga mora de Doñana una mayor movilidad de lo habitual, recorriendo al día distancias de hasta unos 300 m, lo que tiene como resultado una mayor dispersión de sus diferentes nidadas. Posteriormente, vuelven a desplazarse hasta su área habitual de movimientos (Figura 3) (Díaz-Paniagua et al., 1996). Las hembras realizan la puesta durante el día, tanto por la mañana como por la tarde, excavando con las patas traseras un agujero de aproximadamente 121x 109mm de anchura y con una profundidad media de 82mm. La distancia entre la superficie y los huevos más próximos varía entre 0 y 7,4 cm. Los nidos suelen estar situados junto a la base de algún arbusto (Halimium halimifolium o Stauracanthus genistoides en el área de Doñana) (Díaz-Paniagua et al., 1996). Los nidos que describen López-Jurado et al. (1979) en el sureste ibérico se localizaban también al abrigo de alguna planta, y orientados hacia el este, lo que estos autores consideran que favorece la termorregulación de los huevos en el interior del nido. En una ocasión en que se observó a una hembra depositando los huevos se apreció que en cada uno tardaba unos 12 minutos, invirtiendo unos 5 minutos en ajustar la posición del huevo en el interior del nido. Una vez completada la puesta, la hembra empleaba unos 30 min en tapar el nido, cubriéndolo cuidadosamente con arena, hojas y pequeñas ramillas, quedando completamente camuflado (Díaz-Paniagua et al., 1996).
Figura 5. Área de campeo habitual de una hembra de tortuga, en la que se aprecia la localización de sus dos nidos de un mismo año.
Incubación y emergencia de las crías En un primer estudio en el que se realizó el seguimiento de 44 nidos depositados por las hembras de Doñana entre 1990 y 1994, se estimó un periodo variable entre 82 y 140 días desde la fecha de la puesta hasta la emergencia de las crías, detectándose que existía un periodo posterior a la eclosión en que las crías permanecían enterradas en el interior del nido, durante el que suelen absorber la masa de vitelo externa con la que algunos individuos eclosionan. Este periodo de retraso de la emergencia promediaba 9,13 días (s.d.= 6,06; rango: 1-23 días), variando incluso entre huevos de un mismo nido. Excluyendo el periodo de retraso de la emergencia, el periodo de incubación de los huevos promedió 94,9 días (Díaz-Paniagua et al., 1997).
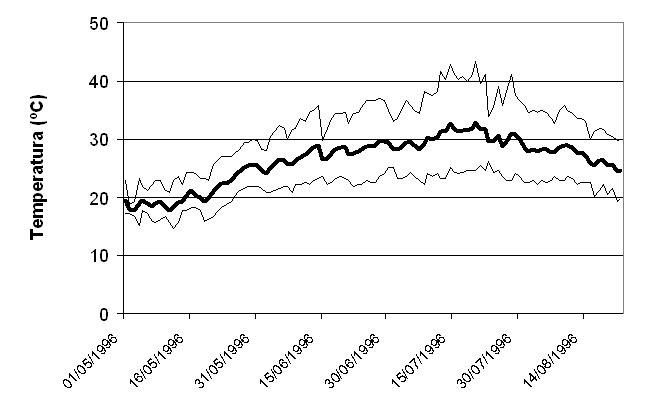
Figura 6. Temperatura media, máxima y mínima diaria registrada en el interior de un nido de tortuga mora en Doñana. Fecha de puesta: 30 de abril. Fecha de emergencia de la primera cría: 22 de agosto.
Un estudio posterior incluye el seguimiento de nidos entre 1996 y 2000, registrándose además la variación de la temperatura a lo largo de la incubación. En este estudio se analizan las diferencias entre la incubación de los nidos en función de su fecha de puesta, incluyéndose nidos de abril, mayo y junio. El periodo de incubación variaba entre 67 y 129 días en Doñana, siendo de menor duración para los de huevos depositados en las puestas más tardías y de notable mayor duración en los depositados al principio de la primavera puesto que existe una relación significativa entre la duración del periodo de incubación y la temperatura de los nidos (Díaz-Paniagua et al., 2006). La temperatura media de incubación de los huevos de T. graeca es de 27,9ºC ± 1.6 (23,5-30,5), teniendo mayor variación en los nidos de puesta temprana, que tienen que experimentar un periodo inicial de temperaturas más frías que los nidos depositados con posterioridad. Por el contrario, todos los nidos soportan temperaturas altas durante el mes de Julio. Existe una amplia oscilación diaria de la temperatura de incubación (promedio = 13,4ºC), alcanzándose temperaturas de hasta 49,8ºC en un nido en el que no llegaron a eclosionar los huevos, mientras que en nidos con éxito de eclosión se alcanzaron temperaturas máximas de hasta 47,4ºC. La temperatura de incubación nunca descendió por debajo de 10ºC (Díaz-Paniagua et al., 2006). Determinación de sexo La diferenciación sexual se produce en Testudo graeca, como en muchos reptiles, durante el desarrollo embrionario, estando determinada por la temperatura de incubación. En esta especie no se han descrito cromosomas sexuales. La incubación de los huevos a una temperatura constante entre 26,5+ 0,5ºC y 29+0,5ºC produce aproximadamente un 100% de crías que desarrollan el fenotipo de los machos. La incubación a 31+0,5ºC, produce, por el contrario el desarrollo de gónadas femeninas. La temperatura intermedia, entre 30 y 31ºC, da lugar a un 50% de machos y hembras (Pieau, 1975).
Estructura y dinámica de poblaciones Edad y tamaño de madurez sexual La edad de madurez se ha estimado, en la población de tortugas de Doñana, a partir del conteo de anillos de crecimiento, observados en las placas del caparazón. La tasa de crecimiento anual de las tortugas decrece considerablemente tras la madurez sexual, lo que se refleja en menor anchura en los anillos en los años sucesivos a la primera reproducción. La edad de madurez se estimó igual al número de anillos de crecimiento de gran anchura, siempre que se apreciara que posteriormente existían anillos de menor anchura. Sobre un total de 47 hembras reproductoras, se estimó la edad media de madurez alrededor de los 8,5 años (sd=1,4; rango 6-14 (tabla 3) (Díaz-Paniagua et al., 2001; 2002). La hembra reproductora de menor tamaño medía 141,4 mm y se le estimaron 9 años, sólo el 15% de las hembras reproductoras tenía un tamaño inferior a 150 mm (Díaz-Paniagua et al., 2001; 2002). En los machos, considerando individuos observados en cortejo, se estimó una edad media de madurez sexual de 6,9 años (sd= 1,0, rango:5-9, n=30). El 96% de 107 machos observados en cortejo tenían una longitud de espaldar superior a 115 mm (Díaz-Paniagua et al., 2001; 2002). Se estimó que aproximadamente el 5% de las hembras maduraban a los 6 años, un 5% a los 7 años, alrededor de un 30% a los 8 años, el 30% a los 9 años, alrededor de un 10% a los 10 años y solo un mínimo porcentaje parecía madurar con mayor edad (Díaz-Paniagua et al., 2001). En Marruecos, Slimani et al. (2002) estiman la edad de madurez en las hembras entre 9 y 11 años, y en los machos, entre 7 y 8 años.
Tabla 3. Edad de madurez y tamaño medio (mínimo-máximo) de los machos y hembras sobre los que se ha realizado esta estima, en las tortugas de Doñana, según datos de Díaz-Paniagua et al. (2001).
Razón de sexos En la población de tortugas de Doñana, la razón de sexos, estimada a partir del número de individuos observados vivos en el campo, muestra una distribución sesgada a favor de los machos: nº machos / nº hembras = 1,66. Sin embargo, en esta estima se considera una gran influencia de la mayor probabilidad de detección de los machos en época de celo, cuando muestran mucha mayor movilidad que las hembras. Teniendo en cuenta el número de individuos encontrados muertos a lo largo de un periodo de cinco años, se estimó una razón de sexos de 1:1 que, al no estar sesgada por la actividad, nos merece mayor confianza que la estimada a partir de individuos vivos (Díaz-Paniagua et al., 2002).
Figura 7. Detalle de una escama ventral en la que se pueden contar los anillos de crecimiento. © C. Díaz-Paniagua.
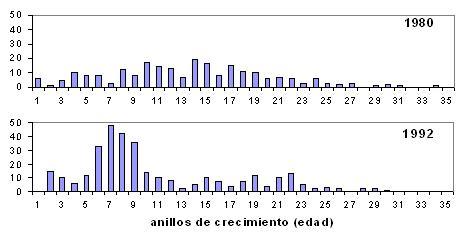
Estructura de edades y longevidad La estima de la edad a partir de los anillos de crecimiento que se pueden observar sobre las escamas del caparazón de las tortugas, resulta de gran fiabilidad (Castanet y Cheylan, 1979; Díaz-Paniagua et al., 2001). En Doñana, desde los años 70, se han realizado intensos periodos de censos de tortugas, con lo que se ha podido estimar la estructura de edades en un amplio intervalo de años (Braza et al., 1981; Andreu, 1987; Díaz-Paniagua et al., 2001, 2002). En general, la estructura de edades de las tortugas de Doñana, corresponde a una distribución en la que la frecuencia de individuos de corta edad son escasas, observándose sobre todo tortugas de 5 a 21 años, siendo raras las de mayor edad. La ausencia de individuos de las fases juveniles, podría deberse a la mayor dificultad de detección de estos individuos. Sin embargo, se ha observado que existe además, habitualmente, una escasa incorporación anual de crías a la población, que contribuye notablemente a la escasez de individuos juveniles en las estructuras de edades (Andreu et al., 2000; Díaz-Paniagua et al., 2001). A partir de las estructuras de edades estimadas en periodos de tiempo distanciados, se ha podido analizar en Doñana la variabilidad de las tendencias poblacionales en cada uno de ellos. En 1980, la estructura de edades presentaba una aportación mínima de individuos juveniles, mientras que en la estructura de edades estimada para el año 1992, se observaba mayor número de individuos de clases juveniles, sugiriendo la existencia de periodos favorables en los que se había producido una mayor incorporación de jóvenes a la población que se veía así reforzada.
Figura 8. Distribución del número de tortugas censadas entre 1980-1985 y 1992 y 1994, clasificadas según la edad que se les estimaba mediante el conteo de sus anillos de crecimiento. Díaz-Paniagua et al., (2001)
En esta población, la mayor edad estimada, sobre un total de 434 individuos vivos, fue de 25 años en las hembras y de 29 en machos (Andreu et al., 2000). La estima de la edad sobre caparazones de individuos muertos encontrados en el campo resulta más precisa, detectándose la mayor longevidad en un macho de 43 años y en una hembra de 42 años (Andreu et al., 2000). Hay que tener en cuenta que el conteo de anillos es una estima bastante fiable de la edad en individuos menores de 10 años, pero a partir de las edades de escaso crecimiento anual, existe un amplio error en la estima (entre dos y tres años, Díaz-Paniagua et al., 2001). En Marruecos, Bailey and Highfield (1996), describen una población del valle del Souss, en la que predominan individuos entre 11 y 25 años, llegando a estimar edades hasta de 40 años. Por el contrario, en la zona de los Jbilet centrales, las mayores edades estimadas por Slimani et al., (2002) corresponden a hembras de 19 años y machos de 15, sobre un total de 141 individuos. Tasa de eclosión La tasa de eclosión estimada en nidos controlados en el campo, en Doñana, entre los años 1990 y 1994, fue del 80% (Díaz-Paniagua et al., 1997), mientras que en estudios posteriores realizados en condiciones de semicautividad (al aire libre, en un área vallada situada en el hábitat natural de las tortugas), entre 1996 y 2000, se estimó una tasa de eclosión media del 61%, con variaciones entre los distintos años entre 44,4% y 81,3%, que no eran estadísticamente significativas (Díaz-Paniagua et al., 2006). Estos datos, no incluyen mortalidad de huevos por depredación, sino solo por infertilidad, fallos en el desarrollo, condiciones de incubación o rotura de huevos. En general, se aprecia una relación significativa de la tasa de eclosión con las temperaturas máximas alcanzadas en los nidos, encontrándose mayor mortalidad de huevos en nidos que alcanzan temperaturas muy altas o que experimentan periodos prolongados con temperaturas superiores a 35 ó 40ºC (Díaz-Paniagua et al., 2006). Tasas de supervivencia Como en la mayoría de las especies, existen notables diferencias entre las tasas de supervivencia de las primeras clases de edad (juveniles) y las de los adultos. En los quelonios, estas diferencias están todavía más marcadas, pues precisamente estas especies se suelen caracterizar por las elevadas tasas de supervivencia de los adultos, que son capaces de mantener la estabilidad de las poblaciones a pesar de que las tasas de los juveniles sean enormemente bajas (Wilbur y Morin, 1988). Crías: En la población de tortugas de Doñana se ha estimado la tasa de supervivencia de las crías desde la eclosión hasta la primavera siguiente en un 39%. Estacionalmente se apreciaron diferencias, siendo la tasa mayor en invierno (93%) cuando los individuos se encuentran menos activos o incluso enterrados. Por el contrario, la mayor mortalidad se produce en primavera, cuando las crías alcanzan mayor actividad, y por tanto están más expuestas a agentes potenciales de mortalidad. Asimismo, existe un pico de mortalidad importante, en el primer mes tras la eclosión de las crías que parece estar influenciado por problemas en el desarrollo de los embriones (Keller et al., 1998). Juveniles: La tasa de supervivencia general para juveniles, estimada entre las clases de edad desde el nacimiento hasta los 6 años (incluidos) parece ser muy variable en Doñana, donde al calcularla sobre la estructura de edades de 1980 alcanzó un valor de 1,3%, mientras que 12 años más tarde, en 1992, se apreció una tasa de supervivencia de juveniles siete veces mayor, del 9,7% (Díaz-Paniagua et al., 2001). En el área de Murcia, se estima una tasa de supervivencia anual de juveniles del 45,7% (Ballestar et al., 2004). A partir de esta tasa anual se puede calcular la del periodo 0-6 años, para compararla con la de Doñana, que resulta ser del 0,91%, un valor que revela asimismo una baja supervivencia de juveniles, característica de los quelonios y también de esta especie. Adultos: A partir de las mismas estructuras de edades, se calcularon en Doñana las tasas de supervivencia de los adultos, que se mantiene uniforme a lo largo de las distintas clases de edades anuales. En ambos períodos las tasas de supervivencia de los adultos son muy elevadas (Tabla 4). También en el área de Murcia, los adultos se caracterizan por sus elevadas tasas de supervivencia (Tabla 4).
Tabla 4. Tasas de supervivencia (en %) de las tortugas de Doñana (Díaz-Paniagua et al., 2001) y del sureste ibérico (Ballestar et al., 2004). En las de Doñana, se han estimado a partir de las estructuras de edades de 1980 y de 1992, presentándose el valor de los escenarios medios y, entre paréntesis, los obtenidos para escenarios pésimo y óptimo (para mayor detalle consultar Díaz-Paniagua et al., 2001). Para los juveniles se ha calculado la supervivencia desde la clase 0 hasta 6 años. Para los adultos, se presenta la supervivencia anual.
Tablas de vida y parámetros demográficos Las tortugas moras, como la mayoría de los quelonios, se caracterizan por su relativamente tardía edad de madurez sexual, una gran longevidad de los individuos y una alta supervivencia en la clase adulta, mientras que la inversión que realizan en la reproducción es moderada e incluso muy reducida en algunos años. Con estas características, la estabilidad de las poblaciones suele depender fundamentalmente del mantenimiento de las altas tasas de supervivencia de los adultos, aunque en determinadas especies y poblaciones, las tasas de supervivencia juveniles también pueden resultar de importancia. Los parámetros demográficos que estiman las tendencias de crecimiento poblacional se han calculado para distintos períodos de tiempo en la población de Doñana a partir de tablas de vida verticales (Tabla 5). Para ello se utilizaron las estructuras de edades obtenidas en los años 1980 y 1992 que ofrecían tendencias poblacionales claramente distintas. Para cada uno de estos años, se estimaron las tasas reproductivas netas, el tiempo generacional, la tasa instantánea de crecimiento y la tasa de crecimiento estable. Esta última nos ayuda a interpretar fácilmente las tendencias de la población, considerándose que valores superiores a 1 indican una población creciente, mientras que valores inferiores son propios de poblaciones con tendencias regresivas. Las estimas obtenidas en el primer periodo de Doñana, reflejaban una población envejecida, con claras tendencias regresivas, con un declive aproximado del 2%, aunque una situación óptima, con máximos de fecundidad y supervivencia mostraban la posibilidad de tendencias positivas. Paradójicamente, los parámetros registrados en 1992 revelan una situación contraria: con un crecimiento poblacional positivo, incluso ante las peores situaciones. El restablecimiento de la población se refleja en la estructura de edades, que muestra un pico importante en las clases de edades juveniles, que debiera corresponder a una mayor incorporación de crías a la población en determinados años favorables, en que las tortugas pudieran obtener sus máximos éxitos de eclosión, alta fecundidad y alta supervivencia de juveniles. Los resultados de este estudio sugieren que la población de tortugas de Doñana, en la que se pueden observar años de escasa incorporación de crías y alta mortalidad juvenil, se mantiene estable gracias a la alta supervivencia de los adultos, mientras que un notable incremento ocasional en la incorporación de crías, en esporádicos años favorables para ello, tiene además un importante papel regulador en su dinámica y estabilidad (Díaz-Paniagua et al., 2001).
Tabla 5. Parámetros demográficos estimados para las tortugas de Doñana a partir de la estructura de edades obtenida en 1980 y 1992. Se representan tres escenarios para cada periodo: medio, pésimo (con fecundidad y supervivencia mínima), óptimo (con valores máximos de fecundidad y supervivencia).
Referencias Andreu A. C. 1987. Ecología y dinámica poblacional de la tortuga mora, Testudo graeca, en Doñana. Tesis Doctoral. Univ. Sevilla. Andreu, A.C., Villamor, M. C. (1986). Reproduction of Testudo graeca graeca in Doñana, SW Spain . Pp.589-592. En: Rocek, Z. (Ed.) Studies in herpetology. Charles University, Prague. Andreu, A.C., Díaz-Paniagua, C., Keller, C. (2000). La tortuga mora en Doñana. Asociacion Herpetologica Española, Barcelona. Monografías de Herpetología, vol. 5. Bailey, J. R., Highfield, A. C. (1996). Observations on Ecological changes threatening a population of Testudo graeca graeca in the Souss Valley, Southern Morrocco. Chelonian Conservation, 2: 36-42. Ballestar, R., Anadón, JD, Giménez, A., López, G., Pérez, I. (2004). Variaciones locales en parçametros poblacionales de tortuga mora (Testudo graeca graeca) en el sureste ibérico. VIII Congreso Luso-Español de Herpetología, Málaga: Libro de resúmenes: 64. Braza , F. Delibes, M., Castroviejo, J. (1981). Estudio biométrico y biológico de la tortuga mora (Testudo graeca) en la Reserva Biológica de Doñana, Huelva. Doñana, Acta Vertebrata, 8: 15-41. Castanet, J., Cheylan, M. (1979). Les marques de croissance des os et des écailles comme indicateur de l'àge chez Testudo hermanni et T. graeca. Canadian Journal of Zoology, 57:1649-1665. Congdon, J.D., Tinkle, D. W. (1982). Reproductive energetics of the painted turtle (Chrysemys picta). Herpetologica, 38: 228-237. Díaz-Paniagua, C., Andreu, A. C., Keller, C. (2006). Effects of temperature on hatching success in field incubating nests of spur-thighed tortoises, Testudo graeca. Herpetological Journal, 16 (3): 249-257. Díaz-Paniagua, C., Keller, C., Andreu, A.C. (2001). Long-term demographic fluctuations of the spur-thighed tortoise, Testudo graeca, in SW Spain. Ecography, 24: 707-721. Díaz-Paniagua, C., Keller, C., Andreu, A.C. (2002). Life history and demography of Testudo greca in Southwestern Spain. Chelonii, 3. : 214-222. Díaz-Paniagua, C., Keller, C., Andreu, A. C. (1996).Clutch frequency, egg and clutch characteristics, and nesting activity of spur-thighed tortoises, Testudo graeca, in southwestern Spain. Canadian Journal of Zoology, 74: 560-564. Díaz-Paniagua, C., Keller, C., Andreu, A. C. (1997). Hatching success, delay of emergence and hatching biometry of Testudo graeca in southwestern Spain. Journal of Zoology, London, 243: 543-553. Keller, C., Díaz-Paniagua, C., Andreu, A.C. (1998).Survival rates and causes of mortality causes of Testudo graeca hatchlings in southwestern Spain. Journal of Herpetology, 32: 238-243 . López-Jurado, L.F.; Talavera Torralba, P.A., Ibáñez González, J.M., Mac Ivor, J. A., García Alcázar, A. (1979). Las tortugas terrestres Testudo graeca y Testudo hermanni en España. Naturalia Hispánica n. 17, ICONA, Madrid. Pieau, C. (1975). Temperature and sex differentiation in embryos of two chelonians, Emys orbicularis L. and Testudo graeca L. Pp: 333-339, En: Reinboth, R. (Ed) Intersexuality in the animal kingdom. Berlin: Springer-Verlag. Roques, S., Diaz-Paniagua, C., Andreu, A.C (2004). Microsatellite markers reveal multiple paternity and sperm storage in the Mediterranean spur-thighed tortoise, Testudo graeca. Canadian Journal Zoology, 82: 153-159. Slimani, T., El Mouden, H., Ben Kaddour, K. (2002). Structure et dynamique de population de Testudo graeca graeca L. 1758 dans les Jbilets Centrales, Maroc. Chelonii, 3: 200-207. Wilbur, H.M., Morin, P.J. (1988). Life history evolution in turtles. Pp: 387-439. En: Gans, C. and Huey ,R.B. (Eds.), Biology of the Reptilia. Vol. 16. Alan Liss Inc., New York.
Carmen Díaz-Paniagua y Ana C. Andreu Fecha de publicación: 29-07-2005 Díaz-Paniagua, C., Andreu, A. C. (2015). Tortuga mora – Testudo graeca. En: Enciclopedia Virtual de los Vertebrados Españoles. Salvador, A., Marco, A. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||