|
|
|
|
|
|
Para más información sobre cada apartado hacer click en:
|
Key words: allis shad, habitat, population size, status, threats, conservation, abundance.
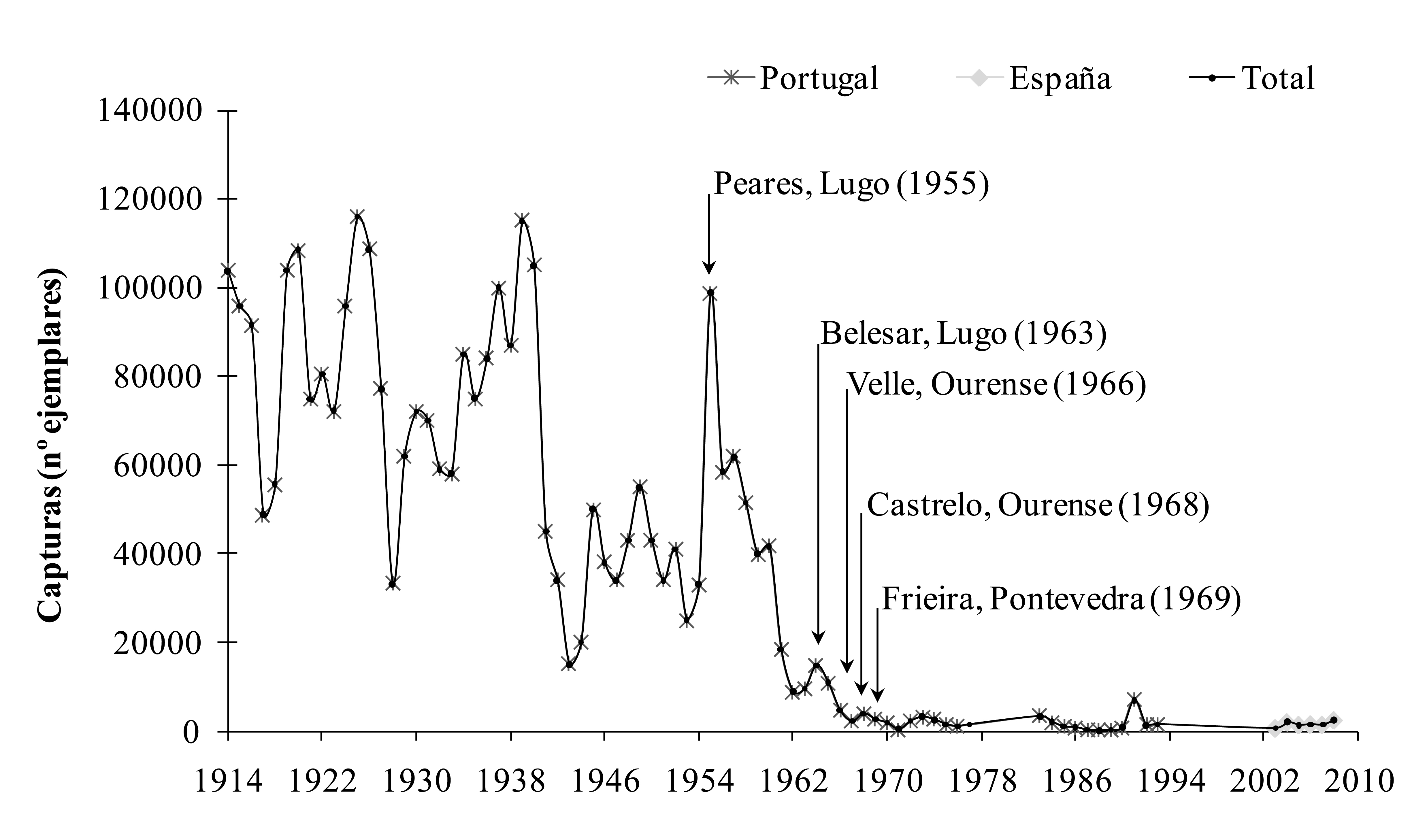
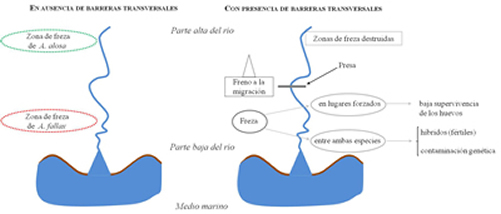
HábitatEn la Península Ibérica no hay datos sobre el hábitat de la fase larvaria. De manera general, se conoce que las larvas se desarrollan en las inmediaciones de las zonas de incubación (medio fluvial), entre los intersticios del substrato (Cassou-Leins et al., 2000). No obstante, estudios experimentales parecen indicar que las larvas de hasta tres semanas podrían exhibir un comportamiento pelágico, próximo a la superficie, para posteriormente ir hacia el fondo, fenómeno que iría acompañado de cambios morfológicos (Véron et al., 2003). En el sistema Gironde-Garone-Dordogne (Francia) se observó que, pasados unos días, las larvas migran, realizando movimientos de tipo transversal desde las zonas inmediatas a los frezaderos hacia las orillas. En un segundo momento, ya como alevines realizan un movimiento longitudinal río abajo, que completarán ya transformados como juveniles, hacia las zonas estuáricas (Cassou-Leins et al., 2000). Una vez finalizada la metamorfosis, los juveniles llegan al estuario, dónde existen diferencias, a escala poblacional y a escala individual, en cuanto a la estrategia de ocupación del hábitat. Así, en el río Miño se observó que si bien hay zonas donde existe una presencia continuada de juveniles durante cinco meses (entre septiembre y diciembre), a nivel individual los juveniles pueden exhibir diferentes comportamientos migratorios complejos, que incluyen múltiples movimientos entre la desembocadura y los distintos compartimentos estuáricos (Mota, 2014). Las zonas de permanencia de la población de juveniles se sitúan en un tramo medio del estuario (Mota y Antunes, 2012; Mota, 2014; Mota et al., 2015). Esas zonas se caracterizan por presentar pozos de elevada profundidad (7-8 m), con fondo de sedimento fino y baja velocidad de corriente (0.3 m/s) en comparación con la velocidad imperante en el canal principal, que alcanza 0.85 m/s (Mota y Antunes, 2012). No hay datos disponibles en la Península Ibérica sobre el hábitat ocupado por los juveniles al final de su primer año de vida ni en la fase subadulta. En la parte oriental (costas francesas) del Golfo de Vizcaya, los individuos subadultos (entre edad 1+ y 2+) pueden realizar idas y venidas entre el medio marino y el medio estuárico (Taverny, 1991). A partir de esa fase los subadultos parecen mostrar una capacidad de distribución espacial muy larga, tanto a nivel latitudinal como longitudinal (Taverny y Elie, 2001a; Nachón et al., 2019). Una vez en el mar, se desconoce prácticamente el hábitat ocupado por las poblaciones de A. alosa. En la plataforma continental de Galicia, el grueso de los registros de A. alosa se concentran en la zona sur de la costa gallega, probablemente debido a la proximidad del río Miño, dónde existe una población estable (Nachón et al., 2016). No obstante, las poblaciones podrían ocupar zonas más amplias de las costas gallega y portuguesa (Bao et al., 2015a, b), siguiendo las zonas de afloramiento que presentan elevada productividad primaria. Después de la fase de alimentación y cuándo alcanzan la madurez sexual, los individuos vuelven a los ríos, generalmente al mismo en el que nacieron, para reproducirse en las zonas medias y altas, si bien en la mayoría de ríos de la Península Ibérica, las poblaciones de A. alosa ya no tienen acceso a esas zonas, debido a la presencia de una gran variedad de obstáculos, y se ven obligadas a reproducirse en el tramo disponible (Assis, 1990; Costa et al., 2001; Martin et al., 2015; Stratoudakis et al., 2016). En la actualidad las poblaciones que presentan un hábitat disponible más amplio son las de los ríos Miño y Mondego, el primero por presentar la primera presa relativamente lejos de la desembocadura (a unos 80 km) y el segundo porque se han llevado a cabo mejoras de conectividad, ampliando el hábitat disponible más allá de los 35 km desde la desembocadura, por la construcción de una escala en la primera presa (Mota y Antunes, 2011, 2012; Stratoudakis et al., 2016). Las poblaciones lacustres desarrollan todo su ciclo de vida en agua dulce, utilizando generalmente los embalses como zonas de crecimiento y las partes aguas arriba del embalse (probablemente en las zonas de freza originales) como zonas de reproducción (Eiras, 1983; Collares-Pereira et al., 1999; Pérez-Bote et al., 2005), si bien se pueden encontrar excepciones en las que parece que la reproducción podría tener incluso lugar en los propios embalses, cómo en el caso de la población del embalse de Castelo de Bode en el río Zêzere, afluente del río Tajo (Eiras, 1983). Tamaño de poblaciónExisten más poblaciones y estas son más abundantes en la vertiente atlántica que en la cantábrica, mientras que en el Mediterráneo las poblaciones se consideran extinguidas. Se desconoce el estado de las poblaciones existentes a lo largo de la vertiente cantábrica. No hay datos del río Asón y en el río Bidasoa se ha constatado un aumento del número de ejemplares que remontan el río en las últimas décadas (Leunda et al., 2012). La mayor parte de la información relativa al estado y tamaño de las poblaciones de A. alosa de la vertiente atlántica procede de las pesquerías comerciales, debido al gran interés económico que genera esta especie (Baglinière et al., 2003). En Portugal es una especie muy apreciada y con un gran valor económico (Pereira et al. 2013). En el río Miño las capturas por pesca profesional se mantienen en torno a unos miles de ejemplares (Stratoudakis et al., 2016). La población de A. alosa del Duero se considera extinguida (Costa et al., 2001). Datos recientes en el río Mondego indican capturas de 3.053 y 6.637 individuos en los años 2013 y 2014 respectivamente (Cardoso et al., 2015). Además, en torno a unos 2.000 ejemplares de alosas (sin hacer referencia a la especie) fueron registrados durante el año 2014 en un paso de peces aguas arriba de la zona de pesquería comercial (Stratoudakis et al., 2016). Apenas se tienen datos sobre el estado de la población del Tajo y en todo caso se desconoce el tamaño de la población (Costa et al., 2001; Almeida et al., 2018). En el Mediterráneo la población del río Ebro se considera extinguida (Baglinière, 2000). Respecto a las poblaciones lacustres, si bien se realizaron varios estudios sobre su biología y ecología, éstos no estaban encaminados a la estimación del tamaño poblacional (Eiras, 1981a, 1983; Collares-Pereira et al., 1999; Correia et al., 2001). Actualmente se desconoce por completo el número de individuos que las integran. Así pues, se desconoce la abundancia real de todas y cada una de las poblaciones, por lo que se antoja imposible realizar una comparación objetiva de los tamaños poblacionales en la Península Ibérica. Por tanto, es más que patente que se hacen necesarios estudios a largo plazo en cada una de las poblaciones para poder realizar evaluaciones adecuadas del tamaño poblacional de A. alosa. Estatus de conservaciónCategoría global IUCN (2008): Catalogada como Preocupación Menor LC por Freyhof y Kottelat (2008) según las categorías vigentes (versión 3.1, IUCN, 2001). Esta designación contrasta enormemente con el declive de las poblaciones documentado por Baglinière y Elie (2000), Baglinière et al. (2003) y Aprahamian et al. (2015) entre otros. En Europa, A. alosa había sido considerada En Peligro E por Lelek (1980) en el libro “Les poissons d´eau douce menacés en Europe”, siguiendo las categorías de la Unión Internacional para la Conservación de la Naturaleza (UICN) de 1974. Parece por tanto más adecuada la opinión de Lelek (1980) de considerar En peligro E las poblaciones de A. alosa. Con respecto al ámbito legal, A. alosa está citada en el Apéndice III del Convenio de Berna (82/72/CEE, DOCE, 1982), sobre “Conservación de la Vida Salvaje y de los Hábitats Naturales de Europa”, por el cual se encuentran entre las especies de fauna protegida y cuya explotación deberá ser regulada de tal forma que las poblaciones queden fuera de peligro y en los anexos B-II (especies de interés general cuya conservación requiere la designación de áreas especiales para la conservación) y B-V (especies de interés general cuya presencia en la naturaleza debe estar sujeta a medidas de gestión) de la Directiva de Hábitats sobre la Conservación de los Hábitats Naturales y de la Fauna y Flora Silvestres de la Comunidad Europea (92/43/CEE, DOCE, 1992). Categoría España IUCN (2001): Catalogada como Vulnerable V 2cd según el libro “Atlas y Libro Rojo de los Peces Continentales de España” (Doadrio, 2001), conforme a las categorías de IUCN del año 1994, pero no figura en el Catálogo Nacional de Especies Amenazadas (Real Decreto 139/2011; BOE, 2011). Alosa alosa está declarada “Especie de Pesca” en el anexo I del RD 1095/89 (BOE, 1989) por el que se declaran las especies objeto de pesca y caza. En la legislación autonómica A. alosa está catalogada como “Rara” en el “Catálogo Vasco de Especies Amenazadas de Fauna y Flora Silvestre y Marina, Decreto 167/1996 a 9 de julio” (BOPV, 1996). En Galicia A. alosa está catalogada como “Vulnerable (V)” en el Decreto 88/2007 (DOG, 2007) y propuesta como “En peligro (E)” en el libro “A natureza ameazada” (Viéitez y Rey, 2004) del Consello Cultura Galega. En Portugal está catalogada como una especie “En Perigo (E)” en el “Livro Vermelho dos Vertebrados de Portugal”, estimándose que la reducción de la población de individuos maduros alcanzó el 50 % en los últimos 10-15 años (Rogado et al., 2006). Está además declarada especie de pesca por la Lei nº 2097 do 6 de Junho de 1959 (Diário do Governo, 1959), reglamentada por el Decreto nº 44623 y por el Decreto-Lei nº 278/87 (Diário do Governo, 1962). No obstante, la información sobre el estado de conservación de A. alosa en la Península Ibérica es muy escasa y deficiente. Sería recomendable por tanto el desarrollo de estudios poblacionales y seguimientos cronológicos que informen sobre el estado de las poblaciones y su evolución. Factores de amenazaDesde comienzos del siglo XIX y hasta la actualidad, el impacto de las actividades humanas (construcción de presas, reducción del caudal de los ríos, contaminación generalizada de las aguas, sobreexplotación pesquera, extracción de sedimentos de los cauces, etc.) alcanzó un peso importante en la drástica restricción del área de distribución de las alosas de atlántico-este y del mediterráneo occidental (Taverny, et al., 2000b; Baglinière et al., 2003). Alosa alosa ha sufrido un mayor declive de sus poblaciones que A. fallaxdebido a su menor plasticidad ecológica y a que utiliza las partes más altas de los ríos (Baglinière, 2000), puesto que el impacto de las presas y obstáculos es tanto más pronunciado cuanto mayor es el grado de anadromía de la especie (Taverny et al., 2000b). El impacto de las presas se traduce fundamentalmente en trabas a la libre circulación cuando no están equipadas con escalas o pasos eficientes para peces (Larinier et al., 2000; Taverny et al., 2000b; Baglinière et al., 2003). Así, se restringe el hábitat disponible y se impide que los individuos alcancen las zonas de reproducción naturales. La construcción de sucesivas presas en el canal principal condujo a la extinción de la población del río Duero (Alexandrino, 1996a) y a la significativa reducción de la abundancia de las poblaciones de otras poblaciones portuguesas, como las del río Mondego o Tajo (Costa et al., 2001). El río Miño es un ejemplo perfectamente ilustrativo del efecto negativo de las de presas sucesivas en un mismo cauce. La construcción de cinco grandes presas en el canal principal del río Miño provocó un descenso considerable del número de reproductores; los negativos efectos de la construcción de cada presa se hacían notar poco tiempo después en las estadísticas de las capturas anuales (Figura 1). La presencia de obstáculos infranqueables, no equipados con pasos para peces en buen funcionamiento, obliga a los adultos a reproducirse aguas abajo de dichos obstáculos (Taverny et al., 2000b). Esta situación tiene dos consecuencias (Figura 2): por un lado, la supervivencia de los huevos se reduce considerablemente y por otro lado se produce un solapamiento obligado de las zonas de freza de A. alosa y A. fallax, en el caso de aquellas poblaciones que se encuentren en simpatría, del que resulta la producción de híbridos (Alexandrino, 1996a; Alexandrino et al., 2006). La hibridación ha sido observada en varias poblaciones de la Península Ibérica, la mayor parte de ellas en ríos portugueses como el Limia o el Mondego (Alexandrino, 1996a; Alexandrino et al., 2006), aunque también se ha descubierto recientemente la presencia de híbridos en el tramo internacional del río Miño (Mota, 2014; Mota et al., 2015; Nachón et al., 2016). En el río Ulla se identificó un individuo como potencialmente híbrido, sin embargo, la ausencia de una población de A. alosa en esta cuenca y la proximidad del río Miño dónde ambas especies habitan en simpatría y existen híbridos, hacen pensar que la procedencia más probable de ese individuo sea del río Miño (Nachón et al., 2016).
Figura 1. Evolución de las capturas de sábalo en el río Miño entre 1914 y 2008. Fuente de los datos de capturas de sábalo: datos oficiales de la Comandancia Naval del Miño y la Capitanía do Porto de Caminha. Fuente de la construcción de las presas: Alexandrino (1996a), en Nachón (2017).
Figura 2. Esquema sintético del efecto de las barreras sobre las poblaciones de alosas. Tomado y modificado de Sabatié y Baglinière (2008), en Nachón (2017).
A pesar de que la construcción de presas se muestra como el principal factor de la disminución de las poblaciones de alosas, existen otros aspectos que actúan sinérgicamente, siendo la sobrepesca uno de ellos. A lo largo del tiempo, la ausencia de una adecuación entre las condiciones de explotación (esfuerzo pesquero) y el nivel de abundancia de las poblaciones, no hizo más que reforzar el descenso de ciertas poblaciones (Taverny et al., 2000b). El caso de la población de A. alosa del río Miño es de nuevo un claro ejemplo del efecto que provocó la falta de adecuación pesquera a la realidad biológica de la población, que vio mermada progresivamente su área de distribución a causa de la construcción de grandes presas (Figura 1). Otro fenómeno que ejerció y sigue ejerciendo un gran impacto sobre las poblaciones de alosas es su captura de manera accesoria en pesquerías de especies comercialmente importantes. En el Noroeste de la Península Ibérica se ha registrado la captura accesoria de alrededor de 10 500 kg en la costa atlántica de Galicia desde 1997 hasta 2013 (Nachón et al., 2016). En el río Miño Antunes y Weber (1996) observaron la captura accesoria de numerosos juveniles de Alosa spp. en la “tela”, una red destinada a la pesca de la angula. Por otro lado, aunque se desconoce la magnitud del fenómeno, existe pesca furtiva en la desembocadura y estuarios de los principales ríos portugueses (Stratoudakis et al., 2016). En las últimas décadas el calentamiento global se cierne como una nueva amenaza sobre las especies migradoras; sus efectos, actuando de manera sinérgica con los descritos en los epígrafes precedentes son, en la actualidad, desconocidos. Se espera que, a mediados de este siglo, el cambio climático eleve el rango de distribución de muchas especies hacia los polos, dando lugar a numerosas extinciones locales en las zonas más meridionales (Lasalle et al., 2008b, 2009). De hecho, las predicciones para A. alosa en la Península Ibérica no son nada halagüeñas, dado que se prevé que todas las poblaciones, excepto la del Tajo, se extingan a finales del siglo XXI (Lasalle et al., 2008b). En cambio las poblaciones se expandirán hacia el norte en Escocia e Islandia. De manera general se pueden citar, por el nivel de impacto que provocan, otros dos factores de amenaza complementarios: la extracción de sedimentos y dragados, y la contaminación del agua, tanto de los estuarios como en los ríos. En el río Miño se ha constatado, en los últimos años, un aumento progresivo de la barra de arena presente en la desembocadura (Cobo et al., 2010), lo cual pudiera estar afectando a la migración de la población de A. alosa que penetra en él. La contaminación del agua también puede crear una barrera al movimiento que modifica las agrupaciones de reproductores (Maitland y Hatton-Ellis, 2003). Medidas de conservación (Cobo et al. 2012)
ReferenciasAlexandrino, P. (1996a). Estudo de populações de sável (Alosa alosa L.) e savelha (Alosa fallax Lacépède). Análise da diferenciação interespecífica, subestructuração e hibridaçao. Tese de Doutoramento, Universidade de Porto, Porto, Portugal. Alexandrino, P., Faria, R., Linhares, D., Castro, F., Le Corre, M., Sabatié, R., Baglinière, J. L., Weiss, S. (2006). Interspecific differentiation and intraspecific substructure in two closely related clupeids with extensive hybridization, Alosa alosa and Alosa fallax. Journal of Fish Biology, 69 (sb): 242-259. Almeida, P. R., Quintella, B. R., Mateus, C. S., Alexandre, C. M., Pedro, S. (2018). Diadromous fish in Portugal: status, threats and management guidelines. Pp. 189-213. En: Bebianno, M. J. Guerreiro, J., Carvalho, T., Gameiro, M. I. (Coords.). Desenvolvimento sustentável do oceano: uma utopia útil / Sustainable development of the ocean: a necessity. Universidade do Algarve Editora. Campus de Gambelas, Faro. Antunes, C., Weber, M. (1996). The glass eel fishery and the by-catch in the rio Minho after one decade (1981-1982 and 1911-1992). Archiwum Rybactwa Polskiego, 4: 131-139. Aprahamian M., Alexandrino P., Antunes C., Cobo F., King J., Lambert P., Martin J., Mota M., Nachón D. J., Silva S. (2015). Shads State of the Art. Pp. 46-105. En: Almeida, P. R., Rochard, E. (Coords.). ICES Report of the Workshop on Lampreys and Shads (WKLS). International Council for the Exploration of the Sea (ICES), Denmark. Assis, C. A. (1990). Threats to the survival of anadromous fishes in the River Tagus, Portugal. Journal of Fish Biology, 37: 225-226. Baglinière, J. L. (2000). Le genre Alosa sp. Pp. 3-30. En: Baglinière, J. L., Elie, P. (Coords.). Les aloses (Alosa alosa et Alosa fallax spp.). Écobiologie et variabilité des populations. CEMAGREF-INRA Editions, París. Baglinière, J. L., Elie, P. (2000). Les aloses (Alosa alosa et Alosa fallax spp.). Écobiologie et variabilité des populations. CEMAGREF-INRA Editions, París. Baglinière, J. L., Sabatié, M. R., Rochard, E., Alexandrino, P., Aprahamian, M. W. (2003). The allis shad Alosa alosa: biology, ecology, range, and status of populations. American Fisheries Society Symposium, 35: 85-102. Bao, M., Mota, M., Nachón, D. J., Antunes, C., Cobo, F., Garci, M. E., Pierce, G. J., Pascual, S. (2015a). Anisakis infection in allis shad, Alosa alosa (Linnaeus, 1758), and twaite shad, Alosa fallax (Lacépède, 1803), from Western Iberian Peninsula Rivers: zoonotic and ecological implications. Parasitology Research, 114 (6): 2143-2154. Bao, M., Roura, A., Mota, M., Nachón, D. J., Antunes, C., Cobo, F., MacKenzie, K., Pascual, S. (2015b). Macroparasites of allis shad (Alosa alosa) and twaite shad (Alosa fallax) of the Western Iberian Peninsula Rivers: ecological, phylogenetic and zoonotic insights.Parasitology Research, 114 (10): 3721-3739. BOE (1989). REAL DECRETO 1095/1989, de 8 de septiembre, por el que se declaran las especies objeto de caza y pesca y se establecen normas para su protección. Ministerio de Agricultura, Pesca y Alimentación, Boletín Oficial del Estado, 218: 28819-28821. BOE (2011). REAL DECRETO 139/2011, de 4 de febrero, para el desarrollo del Listado de Especies Silvestres en Régimen de Protección Especial y del Catálogo Español de Especies Amenazadas. Ministerio de Medio Ambiente, y Medio Rural y Marino, Boletín Oficial del Estado, 46: 20912-20951. BOPV (1996). Decreto 167/1996, de 9 de julio, por el que se regula el Catálogo Vasco de Especies Amenzadas de la Fauna y Flora, Silvestre y Marina. Departamento de Industria, Agricultura y Pesca. Boletín Oficial del País Vasco, 140: 11613-11619. Cardoso, G. R., Quintella, B. R., Mateus, C. S., Alexandre, C. M., Belo, A. F., Pereira, E. D., Telhado, A., Quadrado, F., Almeida, P. R. (2015). Monitoring anadromous fish populations in a context of habitat fragmentation and commercial exploitation. Conference Abstract: XV European Congress of Ichthyology. Front. Mar. Sci. doi: 10.3389/conf.FMARS.2015.03.00242. Cassou-leins, J. J., Cassou-Leins, F., Boisneau, P., Baglinière, J. L. (2000). La reproduction. Pp. 73-92. En: Baglinière, J. L., Elie, P. (Coords.). Les aloses (Alosa alosa et Alosa fallax spp.). Écobiologie et variabilité des populations. CEMAGREF-INRA Editions, París. Cobo, F., Sánchez, J., Vieira-Lanero, R., Servia, M. J., Barca, S., Couto, M. T., Rivas, S., Nachón, D. J., Silva, S., Morquecho, C., Gómez, P., Lago, L. (2010). Conservación da poboación de sábalo no río Miño. Bloque III. Parte III. Servizo para o inventario do hábitat fluvial, os hábitats de interese comunitario, a análise dos peixes migratorios e a ordenación do seu aproveitamento no Baixo Miño. Cobo, F., Sánchez, J., Vieira-Lanero, R., Servia, M. J., Silva, S., Nachón, D., Barca, S., Gómez, P., Morquecho, C., Lago, L., Couto, M. T., Rivas, S., Cobo, M. C. (Eds.) (2012). Documento Marco de Gestión y Conservación de las Especies de Peces Migradores del Espacio SUDOE. Ríos de Galicia. Fundación Centro de Estudos Eurorrexionais Galicia-Norte de Portugal, Santiago de Compostela. Collares-Pereira, M. J., Cowx, I. G., Luís, T., Pedrosa, N., Santos-Reis, M. (1999). Observations on the ecology of a landlocked population of allis shad in Aguieira reservoir, Portugal. Journal of Fish Biology, 55 (3): 658-664. Correia, M. J., Costa, J. L., Teixeira, C., Almeida, P. R., Domingos, I., Costa, M. J. (2001). Feeding habits and condition of two landlocked populations of allis shad (Alosa alosa) in Portugal. Bulletin Francais de la Pêche et de la Pisciculture, 362-363: 823-835. Costa, M. J., Almeida, P. R., Domingos, I. M., Costa, J. L., Correia, M. J., Chaves, M. L., Teixeira, C. M. (2001). Present status of the main shads´populations in Portugal. Bulletin Francais de la Pêche et de la Pisciculture, 362/363: 1109-1116. Diário do Governo (1959). Lei nº 2097, de 6 de Junho de 159. Promulga as Bases do Fomento Piscícola nas águas interiores do País. Presidencia da República, Assembleia Nacional, Lisboa, Diário do Governo, 159: 659-662. Diário do Governo (1962). Decreto n.º 44623-Aprova o Regulamento da Lei n.º 2097, de 6 de junho de 1959, que promulga as Bases do Fomento Piscícola nas águas interiores do País. Ministério da Economia, Secretaria de Estado da Agricultura, Direcçaão-Geral dos Serviços Florestais e Aquícolas, Lisboa, Diário do Governo, 233: 1336-1346. Doadrio, I. (Ed.) (2001). Atlas y libro rojo de los peces continentales de España. Dirección General de Conservación de la Naturaleza, Museo Nacional de Ciencias Naturales, Madrid. DOCE (1982). Decisión 82/72/CEE del Consejo, de 3 de diciembre de 1981, referente a la celebración del Convenio relativo a la conservación de la vida silvestre y del medio natural de Europa (Convenio de Berna). Diario Oficial de las Comunidades Europeas, L38: 25. DOCE (1992). Directiva 92/43/CEE del Consejo, de 21 de mayo de 1992, relativa a la conservación de los hábitats naturales y de la fauna y flora silvestres. Diario Oficial de las Comunidades Europeas, 7-50. DOG (2007). Decreto 88/2007 do 19 de abril, polo que se regula o Catálogo galego de especies ameazadas. Xunta de Galicia, Consellería de Medio Ambiente e Desenvolvemento Sostible, Santiago de Compostela. Diario Oficial de Galicia, 89: 7409-7423. Eiras, J. C. (1981a). Contribuição para o conhecimento da biologia de Alosa alosa L. Estudo de algumas modificaçoes somáticas, fisiológicas e bioquimicas durante a migraçao anádroma no Rio Douro. Tese de doutoramento, Universidade de Porto, Porto, Portugal. Eiras, J. P. (1983). Some aspects of the biology of the landlocked population of anadromous shad Alosa alosa L. Publicações do Instituto de Zoologia « Dr. Augusto Nobre », 180: 1-16. Freyhof, J., Kottelat, M. (2008). Alosa alosa. The IUCN Red List of Threatened Species 2008: e.T903A13091343. Larinier, M., Travade, F., Dartiguelongue, J. (2000). La conception des dispositifs de franchisement. Pp. 249-259. En: Baglinière, J. L., Elie, P. (Coords.). Les aloses (Alosa alosa et Alosa fallax spp.). Écobiologie et variabilité des populations. CEMAGREF-INRA Editions, París. Lassalle, G., Béguer, M., Beaulaton, L., Rochard, E. (2008b). Diadromous fish conservation plans need to consider global warming issues: an approach using biogeographical models. Biological Conservation, 141 (4): 1105-1118. Lassalle, G., Béguer, M., Beaulaton, L., Rochard, E. (2009). Learning from the past to predict the future: responses of European diadromous fish to climate change. American Fisheries Society Symposium,69: 175-193. Lelek, A. (Ed.) (1980). Les poissons d´eau douce menacés en Europe. Collection sauvegarde de la nature. nº 18. Conseil de l´Europe, Strasbourg. Leunda P.M., Elso J., Álvarez J. (2012): Seguimiento de la población reproductora del Sábalo (Alosa alosa) en el río Bidasoa. Informe técnico elaborado por Gestión Ambiental de Navarra, S.A. para el Gobierno de Navarra, proyecto SUDOE Territorios Fluviales Europeos. Maitland, P. S., Hatton-Ellis, T. W. (Eds.) (2003). Ecology of the Allis and Twaite Shad. Conserving Natura 2000 rivers Ecology Series. No. 3. English Nature, Peterborough. Martin, J., Rougemont, Q., Drouineau, H., Launey, S., Jatteau, P., Bareille, G., Berail, S., Pécheyran, C., Feunteun, E., Roques, S. Clavé, D. Nachón, D. J., Antunes, C., Mota, M., Réveillac, E., Daverat, F. (2015). Dispersal capacities of anadromous Allis shad population inferred from a coupled genetic and otolith approach. Canadian Journal of Fisheries and Aquatic Sciences, 72 (7): 991-1003. Mota, M. (2014). Biology and Ecology of the Allis shad, Alosa alosa (Linnaeus, 1758), in the Minho River. Tese de Doutoramento. Instituto de Ciências Biomédicas Abel Salazar da Universidade de Porto, Porto, Portugal. Mota, M., Antunes, C. (2011). First report on the status of Allis shad (Alosa alosa) in the Minho River (Northwestern Iberian Peninsula). Journal of Applied Ichthyology, 27: 56-59. Mota, M., Antunes, C. (2012). A preliminary characterization of the habitat use and feeding of Allis shad (Alosa alosa) juveniles in the Minho River tidal freshwater wetlands. Limnetica, 31 (1): 165-172. Mota, M., Bio, A., Bao, M., Pascual, S., Rochard, E., Antunes, C. (2015). New insights into biology and ecology of the Minho River Allis shad (Alosa alosa L.): contribution to the conservation of one of the last European shad populations. Reviews in Fish Biology and Fisheries, 25 (2): 395-412. Nachón, D. J. (2017). Dinámica poblacional y microquímica de los otolitos de las poblaciones de saboga, Alosa fallax (Lacépède, 1803), de los ríos Ulla y Miño. Tese doutoral, Universidade de Santiago de Compostela, Santiago de Compostela, España. Nachón, D. J., Bareille, G., Drouineau, H., Tabouret, H., Taverny, C., Boisneau, C., Berail, S., Pécheyran, C., Claverie, F., Daverat, F. (2019). 80’s population-specific compositions of two related anadromous shad species during the oceanic phase determined by microchemistry of archived otoliths. Canadian Journal of Fisheries and Aquatic Sciences, https://doi.org/10.1139/cjfas-2018-0444. Nachón, D. J., Mota, M., Antunes, C., Servia, M. J., Cobo, F. (2016). Marine and continental distribution and dynamic of the early spawning migration of twaite shad (Alosa fallax (Lacépède, 1803)) and allis shad (Alosa alosa (Linnaeus, 1758)) in the north-west of the Iberian Peninsula. Marine and Freshwater Research, 67 (8): 1229-1240. Pereira, T. G., Batista, I., Bandarra, N. M., Ferreira, J., Fradinho, N., Afonso, F. (2013). Chemical composition and nutritional value of raw and fried allis shad (Alosa alosa). International Journal of Food Science + Technology, 48 (6): 1303-1308. Pérez-Bote, J. L., Roso, R., Romero, A. J., Perianes, M., López, M. T. (2005). Situación y factores de amenaza sobre las poblaciones de peces migradores en la cuenca extremeña del Guadiana. I El Sábalo Alosa alosa (Linnaeus, 1758). Pp: 189-198. En: López-Caballero, J. M. (Coord.). Conservación de la Naturaleza en Extremadura. Comunicaciones en Jornadas y Congresos 2002-2004. Consejería de Agricultura y Medio Ambiente - Junta de Extremadura, Mérida. Rogado, L., Alexandrino, P., Almeida, P. R., Alves, J., Bochechas, J., Cortes, R., Domingos, I., Filipe, F., Madeira, J., Magalhães, F. (2006). Alosa alosa Sável. Pp. 69-70. En: Cabral, M. J., Almeida, J., Almeida, P. R., Dellingter, T., Ferrand de Almeida, N., Oliveira, M. E., Palmeirim, J. M., Queiroz, A. I., Rogado, L., Santos-Reis, M. (Coords.). Livro vermelho dos vertebrados de Portugal. Instituto da Conservação da Natureza/Assírio & Alvim, Lisboa. Sabatié, R., Baglinière, J. L. (2008). Les aloses de France et d´ailleurs…Alose feinte (Alosa fallax Lac.) et grande alose (Alosa alosa L.): Biologie, Ecologie. Reencontres 2008-Poissons migrateurs en Loire. Communication orale. LOGRAMI, Orléans. Stratoudakis, Y., Mateus, C. S., Quintella, B. R., Antunes, C., Almeida, P. R. (2016). Exploited anadromous fish in Portugal: Suggested direction for conservation and management. Marine Policy, 73: 92-99. Taverny, C. (1991). Contribution à la connaisance de la dynamique des populations d´aloses (Alosa alosa L. et Alosa fallax Lacépède), dans le système fluvio-estuarien de la Gironde: pêche, biologie et écologie. Étude particulière de la dévalaison et de l´impact des activités humaines. Thèse de Doctorat, Université de Bordeaux 1, Bordeaux, France. Taverny, C., Belaud, A., Elie, P., Sabatié, M. R. (2000b). Influence des activités humaines. Pp. 227-248. En: Baglinière, J. L., Elie, P. (Coords.). Les aloses (Alosa alosa et Alosa fallax spp.). Écobiologie et variabilité des populations. CEMAGREF-INRA Editions, París. Taverny, C., Elie, P. (2001a). Répartition spatio-temporelle de la grande alose Alosa alosa (Linné, 1766) et de l´alose feinte Alosa fallax (Lacépède, 1803) dans le Golfe de Gascogne. Bulletin Français de la Pêche et de la Pisciculture, 362/363: 803-821. Véron, V., Jatteau, P., Bardonnet, A. (2003). First Results on the Behaviour of Young Stages of Allis shad Alosa alosa. American Fisheries Society Symposium, 35: 241-251. Viéitez, E., Rey, J. M. (Eds.) (2004). A natureza ameazada. Consello da Cultura Galega, Santiago de Compostela.
David J. Nachón1, Rufino Vieira1 y Fernando Cobo1,2 2 Departamento de Zooloxía, Xenética e Antropoloxía Física, Facultade de Bioloxía, Universidade de Santiago de Compostela. Campus Vida s/n, Fecha de publicación: 2-10-2019 Nachón, D. J., Vieira, R., Cobo, F. (2019). Sábalo – Alosa alosa. En: Enciclopedia Virtual de los Vertebrados Españoles. López, P., Martín, J., Cobo, F. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/.
|
|
|
|
|
|
|