|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Para más información sobre cada apartado hacer click en:
|
Key words: Southwestern Water Vole, description, size, variation.
Origen La diferenciación entre A. sapidus y A. terrestris habría tenido lugar en el periodo glacial Mindel, hace unos 252.000 años (Centeno-Cuadros et al., 2009b)1.
Diagnosis La rata de agua se diferencia de las formas ibéricas de rata topera (Arvicola terrestris) por su aspecto más robusto y sus mayores dimensiones corporales y craneales. La longitud de la cola supera siempre la mitad de la longitud cabeza-cuerpo. Se distingue también de los ejemplares ibéricos de A. terrestris por poseer el cráneo relativamente más alargado y porque los nasales son, en su tercio anterior, casi igual de anchos que la región rostral en el punto de contacto con los arcos cigomáticos (Figura 1). Los incisivos superiores son ortodontos (Figura 2), el bucle anterior del M1 está ligeramente aplanado en su parte anterior y forma un ángulo agudo en la parte lingual (Figura 3). La apófisis angular está marcadamente separada del proceso articular de la mandíbula. En los adultos, el cociente de diferenciación del grosor de la capa de esmalte (Q = grosor en el borde posterior / grosor en el borde anterior x 100) en el M3 es inferior a 100 en A. sapidus y superior a ese valor en las poblaciones ibéricas de A. terrestris; en el M1 se registra la relación inversa (Röttger, 1987; véase también Ventura y López-Fuster, 1989). El báculo es robusto, de base muy ancha y presenta un tridente distal totalmente cartilaginoso con una papila central muy corta (Didier, 1943; Heim de Balsac y Guislain, 1955; según descripciones efectuadas en ejemplares franceses).
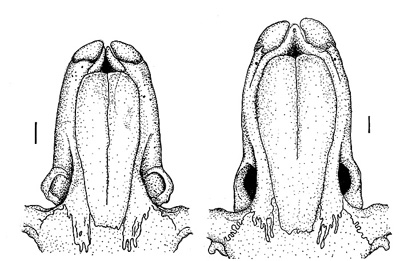
Figura 1. En A. sapidus (derecha), los nasales son, en su tercio anterior, casi igual de anchos que la región rostral en el punto de contacto con los arcos cigomáticos, mientras que en A. terrestris (izquierda) son relativamente más estrechos. Las líneas a cada lado representan 1 mm. A. sapidus, MNCN 4384 (Rascafría, Madrid); A. terrestris, MNCN 6259 (Fuente De, Cantabria). (C) A. Salvador.
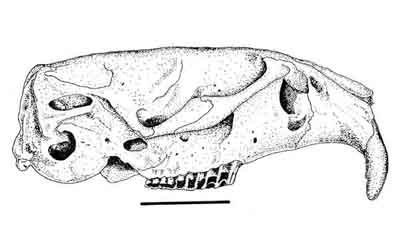
Figura 2. Aspecto lateral del cráneo de A. sapidus, mostrando los incisivos superiores ortodontos. La línea representa 1 cm. MNCN 4384 (Rascafría, Madrid). (C) A. Salvador.
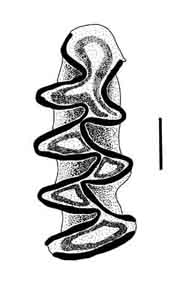
Figura 3. Esquema del M1 derecho de A. sapidus, mostrando que el bucle anterior está ligeramente aplanado en su parte anterior y forma un ángulo agudo en la parte lingual. La línea representa 1 mm. MNCN 4384 (Rascafría, Madrid). (C) A. Salvador.
Descripción La rata de agua es el arvicolino ibérico de mayor tamaño (longitud cabeza-cuerpo: 170-233 mm; longitud de la cola: 97-147 mm; longitud del pie posterior: 31-39 mm; longitud de la oreja: 10-22,5 mm; peso corporal: 140-327 g; véase Tabla 1; para más información véase Miller, 1912; Niethammer, 1964; Vericad, 1970; Gosálbez, 1976; Reichstein, 1982; Zabala, 1983; Ventura, 1988; Garde y Escala, 1996c). La longitud de la cola equivale aproximadamente a dos tercios de la longitud cabeza-cuerpo y los pies presentan cinco tubérculos plantares. A ambos flancos del cuerpo, machos y hembras muestran, en la región lumbar, un par de glándulas odoríferas de forma ovalada cuyo tejido secretor alcanza su mayor desarrollo durante el periodo de reproducción. Las hembras presentan dos mamas pectorales y cuatro inguinales.
Tabla 1. Medidas corporales de ejemplares adultos de Arvicola sapidus. CC: longitud cabeza-cuerpo. C: Longitud de la cola. P: Longitud del pié posterior. O: Longitud de la oreja.
El pelaje es denso, cubre parcialmente las orejas y es muy corto y escaso en los pies y la cola. En los adultos de la subespecie nominal (véase "Variación geográfica"), la coloración dorsal varía desde el pardo amarillento hasta el pardo oscuro mezclado abundamente con negro. Los flancos son más claros y en ellos predominan tonos ocres. El vientre es gris ceniza con tonalidades amarillentas de intensidad variable. La garganta y la parte más anterior del pecho son algo más claras debido a la mayor abundancia de pelos blanquecinos. La cola es bicolor, parda oscura por encima y más clara por debajo. Los pies son de color gris sucio. Globalmente, el pelaje de los ejemplares de la subespecie tenebricus (véase "Variación geográfica") es más oscuro. Román y Laffitte (2002) mencionan dos ejemplares con anomalías pigmentarias. En uno de ellos, procedente de Monachil (Granada), se registró una coloración más oscura de lo habitual debido a un exceso de pigmentación en el extremo distal de los pelos. Por el contrario, en el otro individuo, capturado en el Parque Natural de Doñana, se apreció una falta de pigmentación en esa zona de los pelos en la práctica totalidad del cuerpo. El cráneo de los adultos es robusto, anguloso y muy plano dorsalmente (longitud condilobasal: 37-44,4 mm; para más información sobre la variabilidad craneométrica véase Miller, 1912; Niethammer, 1964; Vericad, 1970; Gosálbez, 1976; Reichstein, 1982; Zabala, 1983; Ventura, 1988; Garde y Escala, 1997). En los márgenes de la región interorbitaria se distinguen un par de relieves longitudinales que tienden a converger con la edad y a dar lugar, generalmente en los individuos de mayor edad, a una cresta sagital de desarrollo moderado en la mitad posterior del frontal. La apófisis articular de la mandíbula es relativamente plana en su cara externa y esta bien separada de la apófisis angular. Fórmula dentaria: 1.0.0.3/1.0.0.3 = 16. Los incisivos superiores son ortodontos y los molares hipsodontos y sin raíces. Entre los individuos adultos, los valores del coeficiente Q (véase Diagnosis) correspondientes al M3 y al M1 de A. sapidus son semejantes a los observados en algunas poblaciones semiacuáticas de A. terrestris y a la especie fósil A. cantiana (Röttger, 1987). Se carece de datos sobre el crecimiento de la especie en cautividad y no se dispone de un procedimiento para determinar la edad absoluta de los animales capturados directamente en la naturaleza. No obstante, Garde et al. (1993) establecen seis clases de edad relativa a partir de las características de los pelajes y las mudas, morfología del cráneo y el estado sexual. A partir de la relación detectada entre el peso del cristalino y la edad relativa, Garde y Escala (1995b) sugieren que la vida media de A. sapidus varía entre los 12 y los 18 meses. No existe dimorfismo sexual a nivel de las medidas somáticas y craneales, aunque en estado adulto los machos presentan dimensiones medias ligeramente superiores a las de las hembras (Saint Girons, 1973; Ventura, 1988; Garde y Escala, 1996c; Garde y Escala, 1997). Por lo que respecta al esqueleto postcraneal, si bien los huesos largos y la escápula son biométricamente semejantes en ambos sexos (Ventura, 1988; Ventura, 1990a; Garde, 1992), algunos parámetros del coxal muestran claras diferencias intersexuales. Estas divergencias se van acentuando progresivamente con la edad de modo que las hembras multíparas presentan un pubis más largo y estrecho, un foramen obturador más largo, un isquion más corto y una anchura isquiopubiana menor que los machos adultos (Ventura, 1988; Ventura y Gosálbez, 1986; Garde, 1992). El coxal de ambos sexos puede distinguirse biométricamente mediante la siguiente función discriminante (Ventura et al., 1994): d = 3,7621 x APB - 0,2779 x LPB - 1,4696; machos: d > -0,0214; hembras: d < -0.0214. Cariotipo: 2N = 40 (Matthey, 1955; 1956; Díaz de la Guardia y Pretel, 1978; 1979; Burgos et al., 1988). Díaz de la Guardia y Pretel (1978) establecen, a partir del análisis de 19 ejemplares ibéricos, cinco grupos de autosomas según su morfología y tamaño: cinco pares metacéntricos largos, dos pares metacéntricos cortos, cuatro pares submetacéntricos largos, dos pares subtelocéntricos y seis pares acrocéntricos; cromosomas sexuales, X submetacéntrico, Y acrocéntrico. Estos mismos autores describen una fisión céntrica en un individuo del sureste ibérico con un número anormal de cromosomas (2N = 41). Estudios sobre los pelajes y las mudas en A. sapidus (Ventura y Gosálbez, 1990a; Garde y Escala, 1999a) han revelado que el primer pelaje (juvenil) es menos denso, más corto y notablemente más oscuro que los posteriores. La primera muda (juvenil) es regular y de tipo sublateral y da lugar al segundo pelaje (subadulto). Éste es algo más denso que el primero y perdura durante poco tiempo. La segunda muda (subadulto) es de tipo sublateral aunque discurre de forma más irregular que el cambio de pelaje juvenil. A partir de la segunda muda el animal adquiere el pelaje de adulto, ligeramente más claro y largo que el segundo. A partir de este momento se registran mudas estacionales, generalmente de tipo irregular, que se desarrollan principalmente durante el otoño y la primavera. El cambio de pelaje primaveral es más irregular, tanto en su topografía como en su duración, que la muda de otoño. El inicio y desarrollo de las mudas de adulto en las hembras se ven modificados por los procesos de reproducción. Asimismo, la irregularidad de las mudas de adulto se acentúa progresivamente con la edad.
Variación geográfica Miller (1908) atribuyó el nombre de A. sapidus a las ratas de agua de la Península Ibérica y Francia y reservó la denominación de A. amphibius para las poblaciones semiacuáticas del género Arvicola extendidas por Gran Bretaña. Tras ser incluida posteriormente por algunos autores como subespecie de A. terrestris (A. t. amphibius, Rode y Didier, 1946; A. t. sapidus, Ellerman y Morrison-Scott, 1951), la forma sapidus pasó a ser aceptada como especie plena después del trabajo de Heim de Balsac y Guislain (1955), basado en observaciones sobre la morfología del báculo y en consideraciones eco y etológicas, y sobre todo a partir de los resultados cariológicos obtenidos por Matthey (1955). Estudios bioquímicos y genéticos posteriores han confirmado plenamente este estatus taxonómico (Graf y Scholl, 1975; Díaz de la Guardia y Pretel, 1978, 1979; Graf, 1982; Burgos et al., 1988). A partir exclusivamente a la coloración del pelaje, Miller (1908) estableció dos subespecies: A. s. sapidus (Terra typica: Santo Domingo de Silos, Burgos, España) y A. s. tenebricus (Terra typica: alrededores de Biarritz, Basses-Pyrénées, Francia). Según dicho autor, esta última muestra una coloración más oscura que la subespecie nominal siendo destacable la mayor profusión de pelos negros que salpican los flancos y la cara. Atendiendo a las asignaciones subespecíficas que aparecen en la bibliografía (Miller, 1912; Heim de Balsac y Guislain, 1955; Niethammer, 1964; Saint Girons, 1973; Gosálbez, 1976; Madureira y Ramalhinho, 1981; Zabala, 1983; Castién, 1984; Ventura, 1988; Garde, 1992), la presencia de tenebricus queda circunscrita al sudoeste y oeste de Francia, Macizo Central francés, Pirineos, Cordillera Cantábrica, algunos enclaves del cuadrante noroccidental de la Península Ibérica y ciertos puntos del centro y sur de Portugal. En un marco estríctamente ibérico, esta subespecie ha sido citada en La Coruña, Zamora, Salamanca, Álava, Guipúzcoa, Santander y en Leiria y Faro, en Portugal. Por su parte, sapidus ocupa el resto del área de distribución de la especie. Castién (1984) indica que, en el País Vasco, la divisoria de aguas podría constituir el límite de separación entre ambas subespecies. La validez de esta concepción taxonómica infraespecífica ha sido cuestionada por diversos autores (Niethammer, 1964; Gosálbez, 1976; Garde, 1992) debido a la relación que parece existir entre el clima y la coloración del pelaje. La gran uniformidad craneométrica que presenta la especie está en concordancia con estas observaciones (Miller, 1912; Garde, 1992). Un estudio de ADN mitocondrial en el que se analizaron muestras de 130 localidades de toda su área de distribución ha mostrado la existencia de 7 linajes. El linaje A es el más frecuente y más distribuido en la Península Ibérica y Francia y está rodeado por 6 linajes de distribución geográfica más restringida y que se solapan parcialmente. La distribución geográfica de los linajes sugiere que su estructura genética ha sido moldeada por su aislamiento durante el Pleistoceno en refugios dentro del refugio Ibérico pero la divergencia filogeográfica habría sido amortiguada por el contacto entre poblaciones durante los periodos interglaciales. Los resultados de esta trabajo no apoyan la existencia de subespecies (Centeno-Cuadros et al., 2009a)1. Las ratas de agua de Doñana son entre un 10 y un 25% más pequeñas que las de Navarra y el Delta del Ebro y el tamaño relativo de la cola resultó significativamente menor en las ratas de agua de Doñana que en las de el Delta del Ebro o de Castellón (Román, 2007b)2.
Referencias Burgos, M., Jiménez, R., Díaz de la Guardia, R. (1988). Comparative study of G- and C-banded chromosomes of five species of Microtidae: a chromosomal evolution analysis. Genome, 30: 540-546. Castién, E. (1984). Contribución al estudio de la ecología y distribución de los micromamíferos de Alava, Guipúzcoa, Navarra y Vizcaya. Tesis de Licenciatura. Universidad de Santiago de Compostela. 140 pp. Centeno-Cuadros, A., Delibes, M., Godoy, J. A. (2009a). Phylogeography of southern water vole (Arvicola sapidus): evidence for refugia within the Iberian glacial refugium? Molecular Ecology, 18 (17): 3652-3667. Centeno-Cuadros, A., Delibes, M., Godoy, J. A. (2009b). Dating the divergence between Southern and European water voles using molecular coalescent-based methods. Journal of Zoology, 279 (4): 404-409. Díaz de la Guardia, R., Pretel, A. (1978). Karyotype and centric dissociation in water vole, Arvicola sapidus spp. sapidus Miller 1908 (Rodentia, Muridae). Experientia, 34: 706-708. Díaz de la Guardia, R., Pretel, A. (1979). Comparative study of the karyotypes of two species of water vole: Arvicola sapidus and Arvicola terrestris (Rodentia, Microtinae). Caryologia, 32: 183-189. Didier, R. (1943). L'os pénien des campagnols de France du genre Arvicola. Mammalia, 7: 74-79. Ellerman, J. R., Morrison-Scott, T. C. S. (1951). Checklist of Palaearctic and Indian Mammals, 1758 to 1946. British Museum (Natural History). London. 810 pp. Garde, J. M. (1992). Biología de la rata de agua Arvicola sapidus Miller, 1908 (Rodentia, Arvicolidae) en el sur de Navarra (España). Tesis Doctoral. Universidad de Navarra. 496 pp. Garde, J. M., Escala, M. C. (1995b). Peso de los cristalinos y aproximación a la edad en Arvicola sapidus Miller, 1908 (Rodentia, Arvicolidae). Munibe (Ciencias Naturales-Natur Zientziak), 47: 129-135. Garde, J. M., Escala, M. C. (1996c). Morphometric characteristics and relative growth of the water vole, Arvicola sapidus (Rodentia, Arvicolidae). Folia Zoologica, 45: 227-236. Garde, J. M., Escala, M. C. (1997). Cranial biometrics of the water vole, Arvicola sapidus (Rodentia, Arvicolidae). Folia Zoologica, 46: 201-216. Garde, J. M., Escala, M. C. (1999a). Coats and moults of the water vole Arvicola sapidus Miller, 1908 (Rodentia, Arvicolinae) in southern Navarra (Spain). Zeitschrift fur Säugetierkunde, 64: 332-343. Garde, J. M., Escala, M. C., Ventura, J. (1993). Determinación de la edad relativa en la rata de agua meridional, Arvicola sapidus Miller, 1908 (Rodentia, Arvicolidae). Doñana, Acta Vertebrata, 20: 266-276. Gosálbez, J. (1976). Contribución al conocimiento de los roedores del nordeste de la Península Ibérica y su interés biológico. Tesis Doctoral. Universidad de Barcelona. 442 pp. Graf, J. D. (1982). Génétique, biochimique, zoogéographie et taxonomie des Arvicolidae (Mammalia, Rodentia). Revue suisse de Zoologie, 89: 749-787. Graf, J. D., Scholl, A. (1975). Variations enzymatiques et relations phylétiques entre neuf espèces de Microtinae (Mammalia, Rodentia). Revue suisse de Zoologie, 82: 681-687. Heim de Balsac, H., Guislain, R. (1955). Evolution et spéciation des Campagnols du genre Arvicola en territoire Français. Mammalia, 19: 367-390. Madureira, M. L., Ramalhinho, M. G. (1981). Notas sobre a distribuçao, diagnose e ecologia dos Insectivora e Rodentia portugueses. Arquivos do Museu Bocage (Série A), 1: 165-263. Matthey, R. (1955). Nouveaux documents sur les chromosomes des Muridae. Problèmes de cytologie comparée et de taxonomie chez les Microtinae. Revue suisse de Zoologie, 62: 163-206. Matthey, R. (1956). Nouveaux apports à la cytologie comparée des rongeurs. 7. Arvicola amphibius amphibius L. Chromosoma, 7: 670-692. Miller, G. S. (1908). Eighteen new European Voles. Annals and Magazine of Natural History, 1: 100-107. Miller, G. S. (1912). Catalogue of the Mammals of Western Europe. British Museum (Natural History) London. 1019 pp. Niethammer, J. (1964). Ein Beitrag zur Kenntnis der Kleinsäuger Nordspaniens. Zeitschrift für Säugetierkunde, 29: 193-220. Reichstein, H. (1982). Arvicola sapidus Miller, 1908 - Sudwesteuropäische Schermaus. Pp. 211-216. En: Niethammer, J., Krapp, F. (Eds.). Handbuch der Säugetiere Europas. Band 2/1. Nagetiere 2 (Cricetidae, Arvicolidae, Zapodidae, Spalacidae, Hystricidae, Capromyidae). Akademische Verlagsgesellschaft, Wiesbaden. Rode, P., Didier, R. (1946). Les mammifères de France. Boubée. Paris: 218 pp. Román, J. (2007b). Historia natural de la rata de agua (Arvicola sapidus) en Doñana. Tesis doctoral. Universidad Autónoma de Madrid. Román, J., Laffitte, R. (2002). Anomalías pigmentarias en la rata de agua (Arvicola sapidus sapidus Miller, 1908). Galemys, 14: 39-41. Röttger, U. (1987). Schmelzbandbreiten an Molaren von Schermäusen (Arvicola Lacepede, 1799). Bonner zoologische Beiträge, 38: 95-105. Saint Girons, M. C. (1973). Les mammifères de France et du Benelux (faune marine exceptée). Doin. Paris. 481 pp. Ventura, J. (1988). Contribución al conocimiento del género Arvicola Lacépède, 1799, en el nordeste de la Península Ibérica. Tesis Doctoral. Universidad de Barcelona. 590 pp. Ventura, J. (1990a). Datos biométricos sobre los huesos largos y la escápula de Arvicola sapidus Miller, 1908 (Rodentia, Arvicolidae). Boletín de la Real Sociedad Española de Historia Natural (Sección Biológica), 86: 55-64. Ventura, J., Garde, J. M., Escala, M. C. (1994). A method for sexual determination from the innominate bone of the southwestern water vole, Arvicola sapidus (Rodentia, Arvicolidae). Folia Zoologica, 43: 225-229. Ventura, J., Gosálbez, J. (1986). Características morfológicas y criterios de discriminación sexual del coxal de Arvicola sapidus (Rodentia, Arvicolidae). Publicaciones del Departamento de Zoología, Barcelona, 12: 117-128. Ventura, J., Gosálbez, J. (1990a). Características de los pelajes y las mudas en Arvicola sapidus (Rodentia, Arvicolidae). Doñana, Acta Vertebrata, 17: 3-15. Ventura, J., López-Fuster, M. J. (1989). Variación del índice de Heinrich durante el desarrollo ontogenético postnidal de Arvicola terrestris (Rodentia, Arvicolidae) del nordeste ibérico. Actas de la IX Bienal de la Real Sociedad Española de Historia Natural, Sevilla: 259-268. Vericad, J. R. (1970). Estudio faunístico y biológico de los mamíferos montaraces del Pirineo. Publicaciones del Centro Pirenaico de Biología Experimental, vol. 4. Jaca. 260 pp. Zabala, J. (1983). Primera cita de Arvicola sapidus (Miller, 1909, Mammalia, Rodentia) para la provincia de Guipúzcoa. Munibe, 35: 109-114.
Jacint Ventura Queija Fecha de publicación: 14-10-2004 Otras contribuciones: 1. Alfredo Salvador. 28-02-2012; 2. Alfredo Salvador. 10-02-2017 Ventura, J. (2017). Rata de agua - Arvicola sapidus. En: Enciclopedia Virtual de los Vertebrados Españoles. Salvador, A., Barja, I. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||