|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Para más información sobre cada apartado hacer click en:
|
Key words: Scopoli's Shearwater, description, size, variation, moult.
Origen y evolución La diferenciación entre C. diomedea y C. borealis habría ocurrido en alopatría por contracción de su área durante el Pleistoceno. La pardela de Cabo Verde (Calonectris edwardsii) está relacionada con C. diomedea, a partir de la cual se habría diferenciado (Gómez-Díaz et al., 2006)1. Se ha detectado flujo reciente de genes entre C. borealis y C. diomedea, alrededor del 3% de C. diomedea a C. borealis y del 10% de C. borealis a C. diomedea (Genovart et al., 2013)1.
Identificación C. borealis es en promedio un 46% mayor en masa corporal que C. diomedea (Thibault et al., 1997) y su pico es más robusto. El cuello muestra menos contraste con la cabeza y el dorso en borealis, dando la sensación de ser más estrecho que en diomedea. El plumaje de C. borealis se muestra en general más oscuro y contrastado, en particular las partes inferiores, donde el reborde oscuro de las alas se adentra más hacia el interior y define un margen mucho más resaltado que en C. diomedea. El área blanca de la zona inferior de las alas se restringe en C. borealis a las plumas cobertoras, dando una forma redondeada a dicho área, mientras que en C. diomedea existe una marcada cuña blanca en el interior de las primarias, que se proyecta más allá de las cobertoras. En C. diomedea, la zona proximal de las primarias más externas es casi blanca, lo que crea un efecto de panel blanco angulado, no sólo formado por la cobertoras, como en C. borealis, sino también por las primarias (Cramp y Simmons, 1977; Gutiérrez, 1998). El reclamo de pareja consta de dos sílabas en C. diomedea mientras que es trisilábico en C. borealis (Bretagnolle y Lequette, 1990).
Descripción La pardela cenicienta mediterránea es un ave marina típica, con alas largas y delgadas adaptadas para aprovechar al máximo los frecuentes vientos que soplan sobre la superficie marina (González-Solís et al., 2009). Su estrategia de vuelo se basa en largas secuencias de planeo combinadas con secuencias de vuelo activo batiendo las alas, en las que el consumo energético aumenta notablemente. Siempre a escasa altura sobre el agua, este patrón de vuelo varía en función de la velocidad del viento. De esta forma, con el aumento de la velocidad del viento disminuye la frecuencia y duración de los intervalos en que baten las alas y aumenta la distancia a la superficie (Rosén y Hedenström, 2001). Cuando están posadas sobre el mar y sin viento, requieren de una corta carrera para poder despegar. La especie posee una envergadura media de 121,7 ± 3'23 cm, n= 127 y una masa corporal media de 646'7 ± 87'10 g, n= 199; datos propios). La morfología de esta ave marina es robusta, con cabeza redondeada, alas largas y cola corta. De coloración apagada, presenta colores pardo grisáceos en las zonas superiores, que llegan hasta la zona inferior del pico, mientras que por debajo son de color blanco prácticamente en su totalidad, salvo el borde externo de las alas, que es oscuro. Las plumas supracobertoras caudales están manchadas de blanco, formando muchas veces una estrecha banda que separa la cola del obispillo. El pico, fuerte y largo, es amarillento con el extremo negruzco, y presenta unas narinas muy patentes. Las patas son de tonos rosados. Ristow y Witte (2004) reportan dos casos de albinismo parcial en plumas de cola y alas, tanto en jóvenes como en adultos, en la isla de Creta.
Biometría En la Tabla 1 se presentan datos biométricos de varias poblaciones reproductoras de pardela cenicienta. Ver datos adicionales sobre biometría de poblaciones de Menorca en Triay y Capo (1996) y de Columbretes en Sánchez y Castilla (1996).
Tabla 1. Medidas (en mm) de diversas poblaciones de pardela cenicienta. Se indica la colonia de cría, el número de individuos medidos (machos: hembras) y los valores promedio ± desviación estándar. Según Gómez-Díaz y González-Solís (2007).
Tabla 1. Continuación. Medidas (en mm) de diversas poblaciones de pardela cenicienta. Se indica la colonia de cría, el número de individuos medidos (machos: hembras) y los valores promedio ± desviación estándar. Según Gómez-Díaz y González-Solís (2007).
Dimorfismo sexual Los machos son algo mayores que las hembras (Tabla 1) (Wink y Ristow, 19791; Gómez-Díaz y González-Solís, 2007). La anchura y longitud de la cabeza y del pico son los caracteres que mejor discriminan ambos sexos, con mayores valores en los machos (Wink y Ristow, 19791; Lo Valvo, 2001).
Variación geográfica Las poblaciones de C. diomedea tienen una escasa estructura genética (Genovart et al., 2013)1. Se ha descrito un ligero aumento en el tamaño corporal según un eje este-oeste, desde Creta a Chafarinas (Lapichino et al., 1983; Gómez-Díaz et al., 2006), aunque las poblaciones de Córcega y Cerdeña se salen de este patrón, siendo más pequeñas que las otras poblaciones del Mediterráneo occidental (Massa y Lo Valvo, 1986).
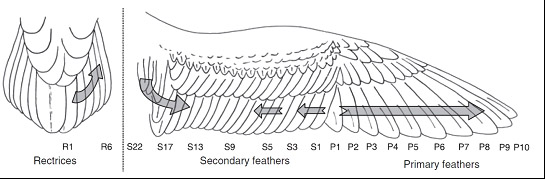
Muda Los adultos reproductores realizan una muda anual completa que se solapa considerablemente con el período reproductor. En las fases previas a la puesta y en los primeros momentos de la incubación la renovación de plumas es mínima. El ciclo se inicia a mitad del período de incubación, con el reemplazo de las plumas corporales del pecho, progresando hacia abajo y lateralmente hacia el vientre y los flancos. En la zona dorsal del cuerpo la muda parece seguir el mismo patrón. En cuanto a las plumas de vuelo, su muda abarca unos 200 días, entre finales de agosto y marzo, comenzando a mitad del proceso de cría del pollo. La renovación de las primarias es simple y descendiente, desde la pluma más interna (P1) a la más externa (P10). Las secundarias muestran un patrón algo más complejo, con tres puntos de inicio no sincronizados: el foco inicial ocurre en las plumas terciarias (en torno a la S22), el segundo aproximadamente en la quinta secundaria (S5), y el tercero en la secundaria más externa (S1) (ver Fig. 1).
Figura 1. Esquema del proceso de muda en C. diomedea. Según Ramos et al. (2009).
La muda de las rectrices es simple, comenzando en el centro de la cola y avanzando hacia las externas; tiene lugar en su mayor parte en las zonas de invernada, ya que en marzo-mayo el proceso está avanzado pero no terminado, es entonces aparentemente suspendido hasta agosto, cuando se reactiva para concluir, en la mayoría de las aves, antes de septiembre (Ramos et al., 2008, 2009).
Referencias Bretagnolle, V., Lequette, B. (1990). Structural variation in the call of the Cory´s shearwater (Calonectris diomedea, Aves, Procellariidae). Ethology, 85: 313-323. Cramp, S., Simmons, K. E. L. (Eds.) (1977). The birds of the West Paleartic. Oxford University Press, London. Genovart, M., Thibault, J. C., Igual, J. M., Bauza-Ribot, M. M., Rabouam, C., Bretagnolle, V. (2013). Population Structure and Dispersal Patterns within and between Atlantic and Mediterranean Populations of a Large-Range Pelagic Seabird. Plos One, 8 (8): e70711. Gómez-Díaz, E., González-Solís, J. (2007). Geographic assignment of seabirds to breeding origin: combining morphology, genetics, and biogeochemical analyses. Ecological Applications, 17: 1484-1498. Gómez-Díaz, E., González-Solís, J., Peinado, M. A. (2009). Population structure in a highly pelagic seabird, the Cory's shearwater Calonectris diomedea: an examination of genetics, morphology and ecology. Marine Ecology Progress Series, 382: 197-209. Gómez-Díaz, E., González-Solís, J., Peinado, M. A., Page, R. D. M. (2006). Phylogeography of Calonectris shearwaters using molecular and morphometric data. Molecular Phylogenetics and Evolution, 41: 322-332. González-Solís, J., Felicisimo, A., Fox, J. W., Afanasyev, V., Kolbeinsson, Y., Muñoz, J. (2009). Influence of sea surface winds on shearwater migration detours. Marine Ecology Progress Series, 391: 221-230. Gutiérrez, R. (1998). Flight identification of Cory's and Scopoli's shearwater. Dutch Birding, 20: 216-225. Lapichino, C., Lo Valvo, F., Massa, B. (1983). Biometria della Berta maggiore (Calonectris diomedea) dell'Isola di Linosa (Pelagie). Rivista Italiana di Ornitologia, 53: 145-152. Lo Valvo, M. (2001). Sexing adult Cory's shearwater by discriminant analysis of body measurements on Linosa Island (Sicilian channel), Italy. Waterbirds, 24: 169-174. Massa, B., Lo Valvo, M. (1986). Biometrical and biological considerations on the Cory`s shearwater Calonectris diomedea. NATO ASI Series G, 12: 293-313. Navarro, J., Forero, M. G., Igual, J. M., González-Solís, J., Bécares, J., Hobson, K. A. (2009a) Foraging segregation between two closely related shearwaters breeding in sympatry. Biology Letters, 5: 545-548. Ramos, R., González-Solís, J., Ruiz, X. (2009). Linking isotopic and migratory patterns in a pelagic seabird. Oecologia, 160: 97-105. Ramos, R., Militão, T., González-Solís, J., Ruiz, X. (2008). Moulting strategies of a long-distance migratory seabird: the Mediterranean Cory's Shearwater. Ibis, 151: 151-159. Ristow, D., Witte, L. (2004). Partial albinistic cases in adult and juvenile Cory's shearwater Calonectris diomedea. Avocetta, 28: 31-32. Rosén, M., Hedenström, A. (2001). Testing predictions from flight mechanical theory: a case study of Cory's shearwater and Audouin's gull. Acta ethologica, 3: 135-140. Sánchez, A., Castilla A. M. (1996). Dimensiones corporales de la pardela cenicienta mediterranea (Calonectris diomedea diomedea) en la colonia de las islas Columbretes (Mediterráneo occidental). Bolleti de la Societat d'Historia Natural de les Balears, 39: 111-116. Thibault, J. C., Bretagnolle, V., Rabouam, C. (1997). Calonectris diomedea Cory's shearwater. BWP Update, 1: 75-98. Triay R., Capo J. (1996). Biometria del virot Calonectris diomedea a l'illa de Menorca (illes Balears - Mediterrani occidental). Butlleti del Grup Catala d'Anellament, 13: 9-14. Wink, M., Ristow, D. (1979). Zur Biometrie des Sexualdimorphismus beim Gelbschnabelsturmtaucher (Calonectris diomedea). Vogelwarte, 30 (2): 135-138.
José Manuel de los Reyes González y Jacob González-Solís Bou Fecha de publicación: 20-02-2012 Otras contribuciones: 1. Alfredo Salvador. 25-11-2016 Reyes-González, J. M., González-Solís, J. (2016). Pardela cenicienta mediterránea - Calonectris diomedea. En: Enciclopedia Virtual de los Vertebrados Españoles. Salvador, A., Morales, M. B. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||