|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Para más información sobre cada apartado hacer click en:
|
Key words: Basbastelle, description, size, variation, ultrasound.
Sistemática En 1759 Luis Jean Marie Daubenton presentó su Mémoire sur les chauves-souris en la Academia Real de Ciencias de París. Por primera vez un naturalista distinguía algo más que el murciélago grande y el murciélago pequeño. Describe siete especies a las que busca nombre junto con Georges Louis Leclercq, conde de Bouffon: Barbastelle. En 1774 el alemán Johann Christian Daniel von Schreber redacta la introducción de Die Säugethiere in Abbildungen nach der Natur mit Beschreibungen, [Los mamíferos en ilustraciones de la naturaleza con descripciones]. Basándose en la descripción de Daubenton, incluye la especie colocándola en el género Vespertilio como V. barbastellus. Tupinier (2001) considera que Schreber seguramente no hubiera tenido entre sus manos un ejemplar alemán, y que la descripción es una compilación de los trabajos anteriores. Sea como fuere, como Daubenton y Buffon no adoptaron el sistema de nomenclatura de Linné, fue el nombre de Schreber el que ha permanecido unido a Barbastella barbastellus. En 1836 fue incluido en el género Barbastellus, y el primer uso de su combinación de nombre actual de B. barbastellus fue en 1897 por Gerrit Smith Miller (Rydell y Bogdanowicz,1997). El nombre barbastellus es derivado del italiano “barbastello”, que es como se llaman los murciélagos (genéricamente) en el noreste de Italia (Ferrara y Bolonia) (Danilo Russo, com. pers). A su vez se originó del latín “vespertilio” (Lina, 2016) y Barbastella podría provenir del latín “barba” (barba) y “stella” (estrella) (Rydell y Bogdanowicz,1997) debido a su pelo de tonalidades plateadas. El género Barbastella (Vespertilionidae, Chiroptera) comprende actualmente seis especies (Nowak y Walker, 1999; Simmons, 2005, Simmons y Cirranello 2022): B. barbastellus (Schreber, 1774), B. leucomelas (Cretzschmar, 1826), B. darjelingensis (Hodgson in Horsfield 1855), B. caspica Satunin, 1908, B. beijingensis Zhang, Han, Jones, Lin, Zhang, Zhu, Huang y Zhang, 2007, y B. pacifica Kruskop, Kawai y Tiunov, 2019. Hoy en día, solo se reconocen dos subespecies de B. barbastellus: la subespecie nominal B. b. barbastellus y la subespecie endémica de Canarias que fue confirmada molecularmente como B. b. guanchae (Trujillo et al., 2002; Juste et al., 2003). Barbastella barbastellus, además de “murciélago de bosque”, también es vulgarmente denominado “barbastela” tanto en España como en Portugal.
Descripción B. barbastellus es un murciélago de tamaño medio. La cabeza es ancha y aplanada, con hocico chato y con las narinas abiertas para arriba. Tiene una boca muy pequeña, con dientes poco robustos y ojos pequeños. Las orejas son grandes de forma trapezoidal y unidas en su base y en la mayoría de los individuos presentan un pequeño lóbulo en el centro del margen exterior de cada oreja (Figura 1). El trago es largo (más de mitad da la longitud de la oreja), de forma triangular, se estrecha abruptamente a partir de la mitad de su altura y termina en punta redondeada (Figura 1). Las partes sin pelos son de color negro o pardo-negruzco. El pelaje es largo y sedoso, de color pardo-negruzco a negro, con la zona ventral más clara. En algunos individuos, especialmente en los más viejos, las puntas de los pelos pueden ser blanquecinos, dando una apariencia de plateado. Ha sido observado un ejemplar leucístico en Polonia (Cichocki et al., 2017).
Figura 1. Murciélago de bosque (Barbastella barbastellus) (Gállego y López, 1991).
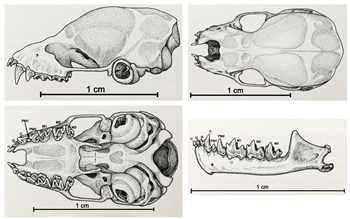
Dotación cromosómica: 2n= 32 (Volleth,1985). El cráneo del murciélago de bosque tiene un perfil ligeramente cóncavo en particular en la parte delantera y tiene una longitud de 12,8-15,0 mm de largo (Figura 2 A) (Palmeirim, 1985). El margen nasal es profundo y su borde posterior se encuentra a igual distancia de los incisivos que de la constricción interorbitaria (Figura 2 B) (Paz y Benzal, 1990; Jenerich et al., 2012). La serie dental superior mide entre 4-5 mm (Figura 2 C) y la inferior mide 5-5,5 mm (Figura 2 D). La fórmula dentaria es 2.1.2.3/3.1.2.3, totalizando 34 dientes (Figura C y D) (Palmeirim, 1985). El primer incisivo superior es bilobulado y mayor que el segundo que es unicúspide (Figura 2 A y C) (Jenerich et al., 2012). Los incisivos inferiores son trilobulados y algo imbricados. El primer molar superior es muy pequeño y oculto en la parte interna por el canino y el segundo premolar (Figura 2 C) (Jenerich et al., 2012). Los caninos superiores tienen dos surcos, uno del lado labial y otro del lado lingual, dando una forma piramidal a los caninos superiores (Figura 2 C) (Vale-Gonçalves et al., 2015).
Figura 2. Vista lateral del cráneo (A); vista superior del cráneo (B); vista inferior del cráneo y mandíbula superior (C) y vista lateral de la mandíbula inferior (D) de B. barbastellus (Adaptado de: Jenerich et al., 2012). Cráneos de Alemania).
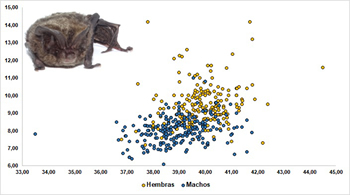
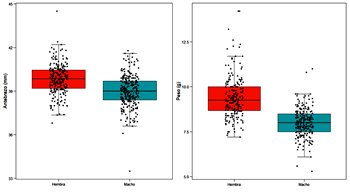
Tamaño El murciélago de bosque es un murciélago de tamaño medio. Sus alas son anchas y relativamente largas (aspect ratio: 6.0; carga alar: 9.1, Norberg y Rayner, 1987), la cola es larga (casi tan grande como su cuerpo) y está totalmente incluida en su uropatagio. Las hembras son ligeramente mayores que los machos (Ancillotto et al., 2015) y los datos de la Península Ibérica (Tabla 1) lo confirman (Figura 3), la longitud del antebrazo es significativamente mayor en las hembras que en los machos (t=9,10; df=504,20; p<0,001) así como el peso (t=14,55; df=357,21; p<0,001). Los antebrazos de los machos adultos (n=269) capturados en la Península Ibérica miden en media 38,99 mm (33,50-41,79 mm; SD=1,08) y en las hembras (n=239) 39,84 (36.80-44,50 mm; SD=1,02) (Figura 4). En cuanto a la masa corporal, los machos (n=223) pesan de media 8,01 g (5,3-11,0 g; SD=0,78) y las hembras (n=207) 9,41 g (7,2-14,2 g; SD=1,16) (Figura 5). Los datos biométricos discriminados por Región/Comunidad están reflejados en la Tabla 1.
Figura 3. Relación de la longitud del antebrazo (mm) y peso (g) de machos y hembras de B. barbastellus de la Península Ibérica (191 ♂♂; 172 ♀♀).
Figura 4 (izquierda). Longitud antebrazo (mm) de machos y hembras de B. barbastellus de la Península Ibérica (n=250). Figura 5 (derecha). Masa corporal (g) de machos y hembras de B. barbastellus de la Península Ibérica (n=222).
Tabla 1. Medidas biométricas (media ± SD) y su rango para B. barbastellus en diferentes regiones de la Península Ibérica.
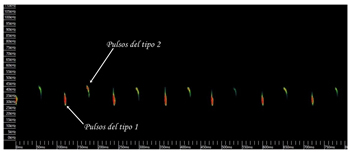
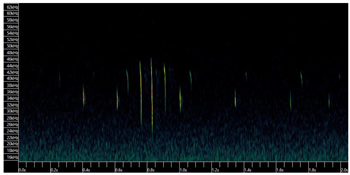
Ultrasonidos El comportamiento de ecolocación del murciélago de bosque es único dentro de los vespertiliónidos europeos, ya que es capaz de emitir dos tipos de señales de ecolocación (Ahlén, 1981; Ahlén, 1990; Rydell y Bogdanowicz, 1997; Sierro y Arlettaz,1997; Vaughan et al., 1997; Parsons y Jones, 2000; Barataud,2001): las señales designadas como tipo 1 (emitidas por la boca) y las señales de tipo 2 (emitidas por las narinas) (Denzinger et al., 2001). Las señales del tipo 1 son más cortas y varían entre 36-28 kHz; las señales del tipo 2 son más largas y varían entre 45-32 kHz (Seibert et al, 2015) (Figura 6). Esto hace que el murciélago de bosque sea uno de los murciélagos paleárticos más especializados (Sierro y Arlettaz, 1997) a la hora de cazar pequeñas polillas timpanadas (Goerlitz et al., 2010).
Figura 6. Espectrograma de los pulsos de ecolocación de Barbastella barbastellus. Pulso del tipo 1, emitidas por la boca y pulsos del tipo 2, emitidas por las narinas. (Paulo Barros, obs. pers. Julio de 2019, norte de Portugal).
Aunque los dos tipos de señales de ecolocación del murciélago de bosque sean aproximadamente de la misma intensidad, están separadas aproximadamente 70º en dirección: las señales del tipo 1, emitidas por la boca, están orientadas hacia el plano inferior de la línea de vuelo y sirven principalmente para la navegación; las del tipo 2, emitidas por las narinas, están orientadas hacia el plano superior y sirven principalmente para detectar y localizar presas (Seibert et al., 2015). Los pulsos del murciélago de bosque son 10-100 veces más débiles que otras especies de murciélagos cazadores aéreos, por lo que es designada como una especie "susurrante" (Goerlitz et al., 2010; Russo et al., 2020). Esta capacidad de emitir dos tipos de pulsos, y con una intensidad más baja que otros murciélagos (Holderied y Helversen, 2003; Surlykke y Kalko, 2008) está descrita como una adaptación evolutiva para cazar eficazmente polillas timpanadas ya que muchas de estas polillas son capaces de detectar la aproximación de los murciélagos y poner en marcha estrategias de evitación (Rydell et al., 1996; Miller y Surlykke, 2001; Waters, 2003). En comparación con otros murciélagos cuyas llamadas tienen una intensidad mayor, el murciélago de bosque tiene la ventaja de acercarse a las polillas sin ser detectado, auqnue esto resulta en una menor distancia de detección (Goerlitz et al., 2010; Seibert et al., 2915). Como la gran mayoría de los murciélagos, los pulsos de alimentación ("feeding buzzes") de B. barbastellus están constituidos por una fase de búsqueda o aproximación seguida de dos fases, designadas de Fase I y Fase II (Ratcliffe et al., 2010), que en la fase terminal puede contener hasta 100-200 pulsos/s (Siemers y Schnitzler, 2000; Ghose y Moss, 2003; Holdereid et al., 2005). Los pulsos emitidos durante los "feeding buzzes" de los murciélagos de bosque tienen una duración (D) de 1,0-1,6 ms y un intervalo interpulsos (IPI) de 4,4-11,3 ms (Russo et al., 2015). Esta especie produce llamadas sociales normalmente en vuelo lejos dl refugio. Las llamadas del tipo D, relacionadas con la época de celo de los machos y defensa del territorio (Pfalzer y Kusch, 2003), son normalmente emitidas en agosto y septiembre (Barataud, 1996; Altringham y Fenton, 2003) durante la época de swarming (Brarros y Braz, 2013). Estos pulsos están descritos como de doble componente con frecuencia máxima (Fmax) alrededor de 30kHz. Este tipo de sociales (tipo D) son relativamente similares a los sociales de doble componente de Pipistrellus kuhlii. Las sociales de tipo C, relacionadas con la interacción entre madre y crías (Pfalzer y Kusch, 2003) tienden a ser de frecuencia modulada (FM) o de frecuencia modulada casi constante (FM-QCF), con una frecuencia inicial en torno de 45kHz y bajando hasta los 20kHz (Figura 7).
Figura 7. Espectrograma de los pulsos de sociales de tipo C de Barbastella barbastellus (Paulo Barros, obs. pers. Junio de 2020, norte de Portugal). Actualmente, solo se reconocen dos subespecies de B. barbastellus: la subespecie nominal B. b. barbastellus y la subespecie B. b. guanche, que es endémica de Canarias (Trujillo et al., 2003; Juste et al., 2003). Los análisis moleculares (Juste et al., 2003), han confirmado la validez de esta consideración taxonómica, ya que la población canaria muestra una distancia genética (a partir del citocromo b) de alrededor 4% respecto a las poblaciones norteafricanas y europeas. El origen exacto de esta subespecie (B. b. guanche) está por esclarecer, ya que es diferente del linaje encontrado en Marruecos y Europa (Juste et al., 2003). La subespecie B. b. guanche se diferencia del B. b. barbastellus por la coloración dorsal y ventral. En los ejemplares de B. b. barbastellus, el dorso tiene un aspecto escarchado, ya que los pelos de esta zona tienen el extremo distal más pálido. En cuanto a la zona ventral, la coloración de B. b. barbastellus es más variable, con pelos con el extremo distal blanquecino distribuidos más o menos irregularmente, pero nunca restringidos sólo a los bordes de las membranas alares y uropatagio (Trujillo et al., 2002). El nombre de esta subespecie (guanche) hace alusión al municipio de La Guancha, en el norte de la isla de Tenerife, donde fue colectado el holotipo (Trujillo et al., 2002).
Referencias Ahlén, I. (1981). Identification of Scandinavian bats by their sounds. Department of Wildlife Ecology, SLU Report 6:1–56. Ahlén, I. (1990). Identification of bats in flight. Swedish Society for Conservation of Nature, Stockholm, 50 pp. Alcalde, J. T. (1995). Distribución y Fenología de los Quirópteros de Navarra. Universidad de Navarra, Pamplona. Altringham, J. D., Fenton, M B. (2003) Sensory ecology and communication in the Chiroptera. Pp. 90-127. En: Kunz, T. H., Fenton, M. B. (Eds.). Bat ecology. The University of Chicago Press, Chicago. Ancillotto, L, Cistrone L, Mosconi, F, Jones, G, Boitani, L., Russo, D. (2015). The importance of non-forest landscapes for the conservation of forest bats: lessons from barbastelles (Barbastella barbastellus). Biodivers Conserv., 24(1):171-185. Barataud, M. (1996). The inaudible world y The World of Bats: acoustic identification of French Bats. 2 CDs + booklet 47p. Sittelle publisher, Mens, France. Barataud, M. (2001). Adaptation du sonar de la barbastelle Barbastella barbastellus à la capture depapillons tympanés: un cas de mimétisme acoustique trompeur? Le Vespère, 2:95-105. Barros, P., Braz, L. (2013). Barbastella barbastellus (Schreber, 1774) en minas del Norte de Portugal: ¿un caso de “swarming”? Barbastella, 6 (1):13-22. Cichocki, J., Lesiński, G., Piksa, K., Ważna, A., Warchałowski, M., Bator, A., Gottfried, I., Gottfried, T., Gubała, W., Jaros, R., Kowalski, M., Płoskoń, L., Postawa, T., Stopczyński, M., Szkudlarek, R. (2017). Aberrant colouration in bats from Poland. North West. Journal of Zoology, 13 (2): 303-310. Denzinger, A., Siemers, B. M., Schaub, A., Schnitzler, H. U. (2001). Echolocation by the barbastelle bat, Barbastella barbastellus. J. Comp. Physiol. A, 187:521-528. Gállego L., López, S. (1991) Vertebrados Ibéricos, 7 Mamíferos Quiropteros. Editorial Bilbilis, Imprenta Nueva Balear. 80 pp. Garrido García, J. A., Nogueras Montiel, J. (2002). Nueva cita para Barbastella barbastellus (Schreber, 1774) (Chirooptera, Vespertilionidae) en el Sureste Ibérico. Zoologica Baetica, 13-14: 241-242. Ghose, K., Moss, C. F. (2003). The sonar beam pattern of a flying bat as it tracks tethered insects. J. Acoust. Soc. Am., 114: 1120-1131. Goerlitz, H. R., ter Hofstede, H. M., Zeale, M. R., Jones, G., Holderied, M. W. (2010). An aerial-hawking bat uses stealth echolocation to counter moth hearing. Curr. Biol., 20 (17): 1568-1572. Hermida, R., Seage, R. 2010. Inventario de especies y refugios de quirópteros en el Parque Natural Fragas do Eume (A Coruña). Asociación DROSERA para estudio e conservación do medio natural. Holdereid, M. W., Helverson, O. (2003). Echolocation range and wingbeat period match in aerial-hawkingbats. Proc. R. Soc. B, 270: 2293-2299. Holderied, M. W., Korine, C., Fenton, M. B., Parsons, S., Robson, S., Jones, G. (2005). Echolocation call intensity in the aerial hawking bat Eptesicus bottae (Vespertilionidae) studied using stereo videogrammetry. J. Exp. Biol., 208: 1321-1327. Jenerich, J., Löhr, P. W., Müller, F., Vierhaus, H. (2012). Fledermäuse: Bildbestimmungsschlüssel anhand von Schädelmerkmalen. Imhof Verlag. Beitrage zur Naturkunde in Osthessen, 48 (supplement 1): 1-102. Juste, J., Ibáñez, C., Trujillo, D., Muñoz, J., Ruedi, M. (2003). Phylogeography of Barbastelle bats (Barbastella barbastellus) in the western Mediterranean and the Canary Islands. Acta Chiropterologica, 5 (2): 165-175. Lina, P. H. C. (2016). Common Names of European Bats. EUROBATS Publication Series No. 7. UNEP / EUROBATS Secretariat, Bonn, Germany. 104 pp. Miller, L. A., Surlykke, A. (2001). How some insects detect and avoid being eaten by bats: Tactics and countertactics of prey and predator. Bioscience, 51: 570-581. Noblet, J. F. (1995). Els quiròpters del Parc Natural de S’Albufera de Mallorca. Monogr. Soc. Hist. Nat. Balears, 4: 169-173. Norberg, U. M., Rayner, J. M. (1987). Ecological morphology and flight in bats (Mammalia; Chiroptera): wing adaptations, flight performance, foraging strategy and echolocation. Philosophical Transactions of the Royal Society of London. B, Biological Sciences, 316(1179), 335-427. Nowak, R. M., Walker, E. P. (1999). Walker's Mammals of the World. Vol. 1. J H U Press. Palmeirim, J. M. (1985). Bats from Portugal: Zoogeography and systematics. Tese de Mestrado, University of Kansas. 53 pp. Parsons, S., Jones, G. (2000). Acoustic identification of twelve species of echolocating bat by discriminant function analysis and artificial neural network. J. Exp. Biol., 203: 2641-2656. Paz O de, Benzal, J. (1990). Clave para la identificación de los murciélagos de la Península Ibérica. Miscelánea Zoológica, 13: 153-176. Paz O. de, Pérez-Suárez, G., Lucas, J., Aranda, A. (2010). Fauna de quirópteros en la sierra de San Vicente, Toledo. Pp. 169-178. En: Actas II Congreso de Naturaleza de la provincia de Toledo. Pfalzer G., Kusch J. (2003). Structure and variability of bat social calls: implications for specificity and individual recognition. J. Zool. Lond. 261: 21–33. Ratcliffe, J. M., Fullard, J. H., Arthur, B. J., Hoy, R. R. (2010). Adaptive auditory risk assessment in the dogbane tiger moth when pursued by bats. Proc. R. Soc. B Biol. Sci., 278 (1704): 364-370. Russo, D., Di Febbraro, M., Cistrone, L., Jones, G., Smeraldo, S., Garonna, A. P., Bosso, L. (2015) Protecting one, protecting both? Scale-dependent ecological differences in two species using dead trees, the rosalia longicorn beetle and the barbastelle bat. J. Zool., 297 (3): 165-175. Russo, D., Salinas-Ramos, V. B., Ancillotto, L. (2020). Barbastelle Bat Barbastella barbastellus (Schreber, 1774). Pp. 1-21. En: Hackländer, K., Zachos, F. E. (Eds.). Handbook of the Mammals of Europe. Rydell, J., Bogdanowicz, W. (1997). Barbastella barbastellus. Mammalian Species, 557: 1-8. Rydell, J., Natuschke, G., Theiler, A., Zingg, P. E. (1996). Food habits of the barbastelle bat Barbastella barbastellus. Ecography, 19: 62-66. Seibert, A. M., Koblitz, J. C., Denzinge,r A., Schnitzler, H. U. (2015). Bidirectional Echolocation in the Bat Barbastella barbastellus: Different Signals of Low Source Level Are Emitted Upward through the Nose and Downward through the Mouth. PLoS ONE, 10 (9): e0135590. Siemers, B. M., Schnitzler, H. U. (2000). Natterer’s bat (Myotis nattereri Kuhl, 1818) hawks for prey close to vegetation using echolocation signals of very broad bandwidth. Behav. Ecol. Sociobiol., 47: 400-412. Sierro, A., Arlettaz, R (1997). Barbastelle bats (Barbastella spp.) specialize in the predation of moths: implications for foraging tactics and conservation. Acta Oecol., 18: 91-106. Simmons, N. B. (2005). Order Chiroptera. Pp. 312-529. En: D.E. Wilson, D. M. Reeder (Eds.)Mammal species of the World: a taxonomic and geographic reference, Third Edition, Volume 1. Johns Hopkins University Press. Simmons, N. B., Cirranello, A.L. (2022). Bat Species of the World: A taxonomic and geographic database. https://batnames.org/ Consultado el 21/03/2022. Surlykke, A., Kalko, E. K. V. (2008). Echolocating bats cry out loud to detect their prey. PLoS ONE, 3 (4): e2036. Trujillo, D., Ibáñez C., Juste, J. (2002). A new subspecies of Barbastella barbastellus (Mammalia: Chiroptera: Vespertilionidae) from the Canary Islands. Revue Suisse de Zool., 109 (3): 543-550. Tupinier, Y. (2001). Historique de la description des espèces européennes de chiroptères. Le Rhinolophe, 15: 1-140. Vale-Gonçalves H. M., Barros, P., Braz L., Cabral J. A. (2015). The contribution of the Barn Owl (Tyto alba) feeding ecology to confirm bat species occurrence in north Portugal. Barbastella, online version 8(1):5-11. Vaughan, N., Jones G., Harris, S. (1997). Identification of British bat species by multivariant analysis of echolocation call parameters. Bioacoustics, 7: 189-207. Volleth M. (1985). Chromosomal homologies of the genera Vespertilio, Plecotus and Barbastella (Chiroptera: Vespertilionidae). Genetica, 66 (3):231-236. Waters, D. A. (2003). Bats and moths: what is there left to learn? Physiol. Entomol., 28: 237-250.
Paulo Barros
Fecha de publicación: 8-05-2023
Barros, P. (2023). Murciélago de Bosque – Barbastella barbastellus. En: Enciclopedia Virtual de los Vertebrados Españoles. López, P., Martín, J., Quetglas, J. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||