|
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
Para más información sobre cada apartado hacer click en:
Descargar: Pdf
|
Key words: Pond Slider, reproduction, demography.
Biología de la reproducción Tamaño y edad de madurez sexual En España, la edad y tamaño de madurez sexual ha sido descrito para las hembras de Trachemys scripta elegans en lagunas de Huelva. La hembra de menor tamaño en la que se apreció su aparato reproductor desarrollado tenía 170,7 mm de longitud recta del caparazón (LRC), mientras que la menor hembra en la que se detectaron huevos tenía 184,9 mm de LRC. En esta zona, estimando la edad de las hembras reproductoras mediante esqueletocronología, se estimó que el 32% de las hembras de tres años, el 65% de las de 4 años, el 92% de las de 5 años y el 100% de las de mayor edad habían adquirido la madurez sexual (Pérez-Santigosa et al., 2008a). En el País Vasco, Patiño-Martínez y Marco (2005) encontraron indicios de reproducción en hembras superiores a 180 mm de LRC. Ciclo reproductor En un estudio de gónadas realizado en Huelva, el peso máximo de los ovarios se observó en el mes de abril, apreciándose desde este mes hasta julio la presencia de folículos de tamaño intermedio o grande y huevos en los ovarios. Se detectó un periodo de quiescencia, con menor tamaño y peso de los ovarios durante los meses de verano, en el que los ovarios sólo contenían folículos de tamaño pequeño. En noviembre, se observó de nuevo un incremento de peso de los ovarios, correspondiente a una fase de crecimiento de los folículos (Pérez-Santigosa et al., 2008a). Para individuos procedentes de cautividad o estanques, en Vizcaya, Patiño-Martínez y Marco (2005) encontraron hembras con huevos calcificados en junio y julio, los principales meses en que también encontraron óvulos en avanzado estado de desarrollo. En las lagunas de Huelva se han observado hembras construyendo nidos y poniendo huevos desde los primeros días de abril hasta finales de julio (Pérez-Santigosa et al., 2008a). En la Comunidad Valenciana, los nidos se han localizado desde la primera semana de mayo hasta agosto, observándose neonatos en el interior de los nidos en julio, agosto y septiembre (Bataller et al., 2008). En Cataluña, en semicautividad, manteniendo a los individuos en condiciones de climatología mediterránea, Martínez-Silvestre et al. (2001) describen el periodo de puesta entre mayo y agosto. Comportamiento sexual El comportamiento de los cortejos fue descrito por Cagle (1950) para T. s. troosti. Durante el cortejo, que ocurre en el agua, el macho se aproxima frontalmente a la hembra y, estirando sus patas delanteras con las palmas hacia afuera, comienza un movimiento vibratorio de sus alargadas uñas delanteras, tocando con ellas la cabeza de la hembra. Cuando la hembra está receptiva, nada lentamente permitiendo que el macho la alcance y que se coloque delante de ella para cortejarla moviendo sus uñas. Finalmente la hembra nada hacia el fondo y el macho la sigue hasta colocarse sobre ella y agarrarla por el caparazón con sus uñas. Entonces inclina su cabeza para tocar la de ella y dobla su cola hacia abajo para que las cloacas contacten y se produzca la cópula. Los machos melánicos suelen incluir mordiscos en los cortejos (Ernst y Lovich, 2009). En T. s. elegans, la cópula se produce tras el contacto entre las cloacas, para lo que el macho estira su cabeza y las patas delanteras y eleva la parte anterior formando un ángulo de 90 ºC con el caparazón de la hembra (Davis y Jackson, 1970). En España, se han observado comportamientos de territorialidad y cortejos en primavera y verano (Martínez-Silvestre et al., 1997). Almacenamiento de esperma Las hembras de Trachemys scripta tienen la capacidad de almacenar esperma (Gist y Congdon, 1998), lo que se ha constatado también en los estanques en los que se mantienen estas tortugas en Cataluña, donde Martínez-Silvestre et al. (1997) describen que las hembras continuaron criando un año después de haber sido aisladas de los machos. Número de puestas Teniendo en cuenta la presencia de grupos de folículos de distinto tamaño en las hembras de las lagunas de Huelva, se considera que la mayoría de ellas realizan tres puestas al año, aunque algunas pueden poner cuatro o incluso más puestas por año (Pérez-Santigosa et al., 2008a). Tamaño de puesta En las lagunas de Huelva, el tamaño medio de huevos por puesta es de 11,5+ 2,3 huevos, no apreciándose diferencias entre localidades, entre hembras o entre los distintos meses del periodo de puesta (Pérez-Santogosa et al., 2008a). El número máximo de huevos registrados en una misma puesta o nido fue de 18 (Pérez-Santigosa, 2007). En la Comunidad Valenciana, sobre un total de 938 nidos extraídos del campo, se estima una media de 9,5 huevos/nido (Bataller et al., 2010a). En Cataluña, en condiciones de semicautividad, Martínez- Silvestre et al.(1997) estiman una media de 6 huevos (3-10) por puesta, mientras que en el medio natural, De Roa y Roig (1997) localizaron un nido de 9 huevos, Capalleras y Carretero (2000) encontraron un nido con 8 huevos y Bertolero y Canicio (2000) encontraron a una hembra realizando una puesta de 18 huevos. En Mallorca, se ha descrito una puesta de 15 huevos (Mas y Perelló, 2001). Características de los huevos Los huevos tienen la cáscara blanda y permeable y son de color blanquecino. En las lagunas de Huelva, el peso de los huevos, tras la puesta, varió entre 6 y 14g, mientras que el diámetro mayor varió entre 28 y 39 mm y el menor entre 18 y 25 mm (Tabla 1) (Pérez-Santigosa et al., 2008a). Puesto que los huevos son de cáscara permeable, a lo largo de la incubación pueden incrementar de peso y tamaño. El tamaño de los huevos se ha descrito también para una puesta desenterrada al final del periodo de incubación (De Roa y Roig, 1997) y para huevos extraídos del oviducto en Vizcaya (Patiño-Martínez y Marco, 2005) (Tabla 1).
Tabla 1. Longitud y peso (media + desv. estándar) de huevos de T. s. elegans, procedentes de nidos realizados en El Portil (Huelva) (Datos de Pérez-Santigosa et al., 2008a), de huevos oviductales de hembras de Vizcaya (Patiño-Martínez y Marco, 2005) y de una puesta en Cataluña, en la que se midieron los huevos al final de la incubación (De Roa y Roig, 1997).
Comportamiento de puesta Las hembras de T. s. elegans excavan los nidos con sus patas traseras, humedeciendo previamente el terreno con líquido de su vejiga (Figura 1). Una vez depositados los huevos, vuelven a tapar el agujero con la tierra húmeda extraída, lo que contribuye a mantener la humedad del sustrato en el que se localizan los huevos. En la superficie, forman un tapón compacto y duro sobre el nido. En las lagunas de Huelva se observó que las hembras salían de las lagunas para realizar sus puestas durante el día. Las primeras puestas se observaron principalmente entre las 9:30 h y las 14: 30h, mientras que al final del periodo de puesta, y coincidiendo con los meses más cálidos, las hembras tendieron a hacer sus nidos en horas más tempranas (Pérez-Santigosa et al., 2008a).
Figura 1. Hembra realizando el nido. © N. Perez-Santigosa.
Características de los nidos En Huelva, los nidos tenían una profundidad de entre 12 y 13 cm, quedando el último huevo aproximadamente a unos 8 cm de distancia de la superficie del suelo (Pérez-Santigosa, 2007). Los nidos no se encontraron situados al azar, sino principalmente en zonas ampliamente soleadas, con substrato semiduro y a una distancia media de la laguna de 106 m (Pérez-Santigosa et al., 2008b). En lagunas rodeadas por zonas arenosas, como se observó en la Laguna de El Acebuche (Huelva), las hembras seleccionaron puntos con substrato más duro, como los caminos de grava, para hacer sus nidos. En la Comunidad Valenciana, los nidos tienen una profundidad entre 12 y 15 cm (Bataller et al., 2008). Fertilidad y tasas de eclosión Para huevos procedentes de las hembras de las lagunas de Huelva, se estimaron en laboratorio las tasas de eclosión y fertilidad, incubándose a 27,5 ºC y a tres potenciales hídricos (húmedo:-150kPa, intermedio: -550kPa y seco: -990 kPa). En general, el 79,5% de los huevos de cada puesta fueron fértiles, detectándose un 55% y un 33% de puestas en las que todos los huevos eran fértiles en las dos respectivas lagunas del estudio (Pérez-Santigosa et al., 2008a). La tasa de eclosión está significativamente afectada por las condiciones de humedad, siendo del 55% para los huevos incubados a menor humedad en laboratorio (Pérez-Santigosa et al., 2008b). En el campo, un 64% de 11 nidos controlados contenían huevos con desarrollo embrionario (Pérez-Santigosa et al., 2008b). En otras localidades de España también se ha detectado un mínimo porcentaje de infertilidad en las puestas. En Cataluña, de las puestas realizadas por hembras criadas en estanques en condiciones naturales, nació un promedio de 2 crías para puestas que se componían de un promedio de 6 huevos (Martínez-Silvestre et al., 1997). Se ha descrito también la presencia de algún huevo sin fecundar en puestas en el medio natural en Cataluña (De Roa y Roig, 1997; Capalleras y Carretero, 2000) Incubación y emergencia de las crías Los huevos necesitan mantener determinadas condiciones de humedad para completar el desarrollo de los embriones hasta la eclosión. En incubadoras a 27,5 ºC, el periodo de incubación varió entre 62 y 73 días, con pequeñas diferencias entre los distintos tratamientos de humedad del substrato (Pérez-Santigosa, 2007). Una vez eclosionados los huevos, las crías pueden mantenerse enterradas dentro del nido. En sus áreas originales se describe la emergencia de las crías cuando se producen las primeras lluvias (Tucker, 1997; 1999). En España, la capacidad de mantenerse enterradas tras la eclosión se describe en condiciones de laboratorio (Pérez-Santigosa, 2007). En Huelva, se ha descrito la presencia de neonatos en el campo tanto en septiembre como en primavera, pudiendo corresponder esta última fecha a crías que han pasado su primer invierno enterradas en el nido (Pérez-Santigosa, 2007). En Cataluña, se estima el periodo entre la puesta y la emergencia de las crías entre 91 y 103 días en condiciones naturales (Martínez-Silvestre et al., 1997).
Figura 2. Cría de Trachemys scripta elegans durante la eclosión. © N. Pérez-Santigosa.
Determinación de sexo En Trachemys scripta, la determinación del sexo está condicionada por la temperatura de incubación. Cuando el segundo tercio del desarrollo embrionario se produce a temperaturas elevadas, se desarrollan gónadas femeninas, mientras que a temperaturas más bajas se producen masculinas. La temperatura pivotal, a la que se desarrolla similar número de hembras que de machos se sitúa alrededor de los 29-29,5ºC) (Bull et al., 1982).
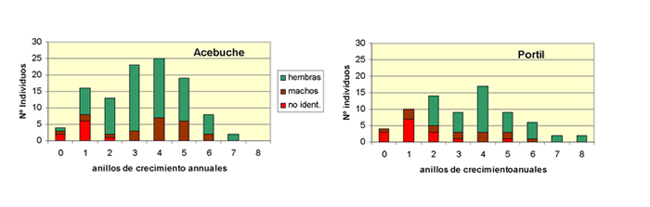
Demografía Estructura de edades Aunque en las poblaciones del área natural de esta especie los individuos pueden alcanzar una longevidad superior a 25 años (Gibbons, 1990b), la mayor longevidad observada en poblaciones establecidas en España, estaba aún condicionada por la fecha de introducción de la especie y de la liberación de individuos. En las poblaciones de las lagunas de Huelva, los individuos más longevos tenían 10 años en el año 2005, para los que se estimaba que habían nacido en 1994, y probablemente habían sido liberados en estas lagunas antes de 1998 (Pérez-Santigosa et al., 2006a).
Figura 3. Estructura de edades de los individuos de Trachemys scripta elegans extraídos hasta 2005 en las lagunas de Huelva, estimada según la edad que tendrían en el año 2003. Según Pérez-Santigosa et al. (2006 a).
La edad de estos individuos se estimó mediante esqueletocronología, contando el número de anillos de crecimiento en el fémur de los galápagos extraídos y sacrificados dentro de un programa de erradicación. Las estructuras de edades, calculadas para los individuos presentes en la población en el año 2003 (Figura 3) presentó mayor frecuencia de individuos de 3-5 años, correspondiendo a los nacidos entre 1997 y 1999, años en los que probablemente hubo un notable incremento del éxito reproductivo en condiciones naturales. Teniendo en cuenta que esta especie dejó de importarse a España en 1997, en la distribución de edades estimadas en estas lagunas en el año 2003 se consideró que todos los individuos menores de 4 (74%) ó 5 años (91% y 86% en cada una de las respectivas lagunas) habían nacido en el campo, a partir de hembras establecidas o nacidas en estos medios (Pérez-Santigosa et al., 2006a). Razón de sexos En las poblaciones establecidas de T. s. elegans en las lagunas de Huelva, en las que la mayoría de los individuos procedían de nacimientos en el medio natural, se observó similar proporción de ambos sexos en una de las lagunas, mientras que en la otra había mayor número de hembras (Pérez-Santigosa et al., 2006a). En Cataluña, las capturas de ejemplares del embalse del Foix (Barcelona), donde también se produce la reproducción de esta subespecie, revelaron una proporción de sexos aproximadamente equilibrada, en la que los machos constituyeron el 45,5 % y el 68% de los adultos capturados en 2009 y 2010 respectivamente. Para T. s. scripta, sin embargo, se observó mayor proporción de hembras (Martínez-Silvestre y Soler-Massana, 2011). En otras localidades, donde la mayoría de los individuos parecen provenir de cautividad, el número de hembras suele ser superior al de los machos. En el País Vasco, Patiño-Martínez y Marco (2005) encontraron una proporción de 9 hembras: 1 macho, y en el Parque de Salburúa (Vitoria) todos los galápagos extraídos fueron hembras (Buenetxea et al., 2008). En Navarra, las capturas de ejemplares descritas también ofrecen mayor proporción de hembras (Valdeón et al., 2010). Tasas de supervivencia y parámetros poblacionales Sólo en las poblaciones establecidas en las lagunas de Huelva se han calculado tasas de supervivencia de esta especie en España. Mientras que para los juveniles las tasas de supervivencia en un escenario medio se estimaron en el 3% y 5% en cada una de las lagunas estudiadas, en las hembras, la supervivencia media estimada fue del 69,8 y 54,8% respectivamente. En estos datos hay que tener en cuenta que se calculaban para una población joven, en la que los individuos más longevos tenían sólo 10 años (Díaz-Paniagua et al., 2006). A partir de estas tasas de supervivencia y sus variaciones máxima y mínimas, se calculó para estas poblaciones un tiempo medio de generación de aproximadamente 5 años, estimándose un rápido crecimiento de las poblaciones en un escenario óptimo en el que las hembras alcanzaran su fecundidad máxima, mientras que en un escenario medio, con valores medios de supervivencia y fecundidad, el crecimiento de la población se mantendría estable (Díaz-Paniagua et al., 2006). En las dos lagunas de Huelva, el estudio demográfico de las poblaciones reproductoras sugería que su origen se debió a la liberación de un pequeño número de individuos entre 1996 y 1997. Según Díaz-Paniagua et al. (2005) y Pérez-Santigosa (2007), unos 10-15 individuos iniciales pudieron dar lugar en un periodo de 10 años a una población de aproximadamente 250-300 individuos en la Laguna de El Acebuche en Doñana (Huelva), donde se observaron por primera vez los primeros adultos reproductores en 1998. En la Laguna de El Portil, más expuesta a repetidas y frecuentes liberaciones hasta el año 2003, se estableció una población en la que se estimaron más de 400 ejemplares en 2005, para la que su origen se sitúa entre 1994 y 1997. En años anteriores ya se observaban ejemplares que podrían tener edad reproductora en 1995, cuando se realizó la extracción de ejemplares al producirse la desecación de la laguna. Se considera que la población observada en 2005 podía proceder de un número indeterminado de adultos que escaparan a esta primera extracción y que recolonizaron la laguna posteriormente. Adicionalmente, la continuada liberación de ejemplares se considera que reforzó la población, observándose además en ella a individuos de T. s. scripta, aunque no su reproducción.
Referencias Bataller, J. V., Sancho, V., Gil, J. M., Lacomba, J. (2008). La Comunidad Valenciana lucha contra el galápago de Florida. Quercus, 274: 28-34. Bataller, J. V., Bartolomé, M. A., Cervera, F., Monsalve, M. A., Pradillo, A., Sarzo, B., Vilalta, M. (2010a). Erradicación de galápagos exóticos en humedales de la Comunidad Valenciana y su repercusión en las poblaciones de galápago europeo (Emys orbicularis). Pp. 113-114. En: XI Congreso Luso Español de Herpetología/XV Congreso Español de Herpetología, Sevilla. Bertolero, A., Canicio, A. (2000). Nueva cita de nidificación de Trachemys scripta elegans en Cataluña. Boletín de la Asociación Herpetológica Española, 11: 84. Buenetxea, X., Paz Leiza, L., Larrinaga, A. R. (2008). Caracterización de las poblaciones de galápagos autóctonos y control de las poblaciones de galápagos exóticos del parque de Salburua. Año 2008. Centro de Estudios Ambientales Vitoria-Gazteiz. http://www.vitoria-gasteiz.org/w24/es/html/14/148.shtml. Bull, J. J., Vogt, R. C., McCoy, C. J. (1982). Sex determining temperatures in turtles: A geographic comparison. Journal Experimental Zoology, 256:339–341. Cagle, F. R. (1950). The life history of the Slider Turtle, Pseudemys scripta troostii (Holbrook). Ecological Monographs, 20:31-54. Capalleras, X., Carretero, M. A. (2000). Evidencia de reproducción con éxito en libertad de Trachemys scripta en la Península Ibérica. Boletín Asociación Herpetológica Española, 11: 34-36. Davis, J. D., Jackson, C. G. Jr. (1970). Copulatory behavior in the red-eared turtle Pseudemys scripta elegans (Wied). Herpetologica, 26: 238-240. De Roa, E., Roig, J. M. (1997). Puesta en hábitat natural de la Tortuga de Florida (Trachemys scripta elegans) en España. Boletín de la Asociación Herpetológica Española, 9: 48-50. Díaz-Paniagua, C., Pérez-Santigosa, N., Hidalgo-Vila, J. (2006). Demografía de una población naturalizada de galápagos exóticos: Historia de la colonización de Trachemys scripta elegans en dos lagunas de la provincia de Huelva. Pp. 89. En: Libro de Resúmenes 2º Congreso Nacional sobre Especies Exóticas Invasoras, León. Díaz-Paniagua, C., Pérez-Santigosa, N., Hidalgo-Vila, J., Portheault, A. (2005). Bases científicas para la elaboración de un programa de erradicación de galápagos exóticos introducidos en el medio natural. Informe Técnico no Publicado. Convenio Consejería Medio Ambiente Junta de Andalucía- CSIC. Sevilla. Ernst, C. H., Lovich, J. E. (2009). Turtles of the United States and Canada (Second edition). Johns Hopkins University Press, Baltimore. Gibbons, J. W. (1990b). Recommendations for future research on freshwater turtles: What are the questions?. Pp: 311-317. En: Gibbons, J.W. (Ed.) Life history and ecology of the slider turtle. Smithsonian Inst. Press., Washington. Gist, D. H., Congdon, J. D. (1998). Oviductal sperm storage as a reproductive tactic of turtles. Journal of Experimental Zoology, 282: 526–534. Martínez-Silvestre, A., Soler, J., Solé, R., González, F. X., Sampere, X. (1997). Nota sobre la reproducción en condiciones naturales de la tortuga de Florida (Trachemys scripta elegans) en Masquefa (Cataluña, España). Boletín de la Asociación Herpetológica Española, 8: 40-42. Martínez-Silvestre, A., Soler-Massana, J. (2011). Extracció i control de tortugues exotiques invasores al panta de El Foix. 2010. Consorci del Parc del Foix. Diputación de Barcelona. Documento técnico no publicado. Martínez-Silvestre, A., Soler-Massana, J., Solé, R., Medina, D. (2001) Reproducción de quelonios alóctonos en Cataluña en condiciones naturales. Boletín de la Asociación Herpetológica Española, 12: 41-43. Mas, R., Perelló, B. (2001). Puesta de galápago de Florida en s’Albufera de Mallorca. Quercus, 187: 10. Patiño-Martínez, J., Marco, A. (2005). Potencial invasor de los galápagos exóticos en el País Vasco. Munibe, 56: 97-112. Pérez-Santigosa, N. (2007). Ecología del galápago exótico, Trachemys scripta elegans, en la península Ibérica. Efectos sobre las poblaciones de Mauremys leprosa y Emys orbicularis. Tesis Doctoral. Universidad de Sevilla. Pérez-Santigosa, N., Díaz-Paniagua, C., Hidalgo-Vila, J. (2008a). The reproductive ecology of exotic Trachemys scripta elegans in an invaded area of southern Spain. Aquatic Conservation: Marine and Freshwater Ecosystems, 18: 1302-1310. Pérez-Santigosa, N., Díaz-Paniagua, C. y Hidalgo-Vila, J. (2008b). Características de los nidos del galápago exótico Trachemys scripta elegans en el medio natural de Andalucía. Pp. 94. En: X Congreso Luso-Español/XIV Congreso Español de Herpetología. Coimbra, Portugal. Programme and Abstract book. Pérez-Santigosa, N., Díaz-Paniagua, C., Hidalgo-Vila, J., Marco, A., Andreu, A., Portheault, A. (2006a). Características de dos poblaciones reproductoras del Galápago de Florida, Trachemys scripta elegans, en el suroeste de España. Revista Española de Herpetología, 20: 5-16. Tucker, J. K. (1997). Natural history notes on nesting, nest, and hatchling emergence in the red-eared slider turtle, Trachemys scripta elegans, in west-central Illinois. Biological Notes, 140: 1-13. Tucker, J. K. (1999). Environmental correlates of hatchling emergence in the red-eared turtle, Trachemys scripta elegans, in Illinois. Chelonian Conservation and Biology, 3: 401-406. Valdeón, A., Crespo-Díaz, A., Egaña-Callejo, A., Gosá, A. (2010). Update of the pond slider (Trachemys scripta) (Schoepff, 1792) records in Navarre (Nothern Spain), and presentation of the Aranzadi turtle trap for its population control. Aquatic Invasions, 5: 297-302.
Albert Martínez-Silvestre1, Judit Hidalgo-Vila2, Natividad Pérez-Santigosa2, Carmen Díaz-Paniagua2 Fecha de publicación: 11-03-2011 Martínez-Silvestre, A., Hidalgo-Vila, J., Pérez-Santigosa, N., Díaz-Paniagua, C. (2015). Galápago de Florida – Trachemys scripta. En: Enciclopedia Virtual de los Vertebrados Españoles. Salvador, A., Marco, A. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/ |
|||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||