|
|
|
|
|
|
Para más información sobre cada apartado hacer click en:
|
Key words: Leatherback turtle, reproduction, demography. Biología de la reproducción La tortuga laúd no se suele reproducir durante dos años consecutivos y suele dejar 1, 2 o raramente 3 temporadas de reposo. En el Pacífico parece que las tortugas se reproducen con más baja frecuencia que en el Atlántico (Bailey et al., 2008) por una menor disponibilidad de alimento. Durante estos descansos reproductores pueden desplazarse a zonas distantes miles de kilómetros de su lugar de anidación. Sin embargo, para anidar retornan a su zona de nacimiento. No obstante, se considera que la fidelidad espacial para anidar no es tan grande como en otras tortugas marinas y pueden desplazarse hasta varios cientos de kilómetros entre nidos puestos incluso en la misma temporada. Es probable que los machos se apareen todos los años aunque apenas se dispone de información sobre este tema. La reproducción de la tortuga laúd es estacional y suele coincidir con la época húmeda y cálida de su lugar de anidación. En zonas tropicales americanas puede ser entre febrero y julio (Quiñones et al., 2007). En la costa atlántica africana (Gabón) la anidación ocurre entre noviembre y marzo (Witt et al., 2008). Los apareamientos parecen realizarse cerca de las zonas de anidación mostrando los machos cierto grado de fidelidad a sus zonas de apareamiento (James et al., 2005a). Antes de finalizar las anidaciones los machos iniciarían sus migraciones hacia latitudes más elevadas. Los machos intentan copular con las hembras poco antes y durante el principio de la estación de puesta (Rostal, 2015)2. El cortejo y las interacciones sexuales son poco conocidos pero mediante estudios de multipaternidad se sabe que hay casos frecuentes de poliandria y poliginia, así como hembras con nidos monoparentales (Crim et al., 2002). La repetición de padres en nidos sucesivos de la misma hembras apunta a la existencia de almacenamiento de esperma o menos probablemente de monogamia (Crim et al., 2002). La época de puesta suele durar unos 4 meses y durante este periodo cada hembra puede realizar entre 1 y 14 nidos (media= 9,5 nidos) cada 9-11 días (Chacón-Chaverri, 1999; Hilterman y Goverse, 2007; Rostal, 2015 2). La tortuga laud puede anidar hasta 14 veces en una estación reproductiva, poniendo un total de más de 700 huevos y un (Rostal, 2015) 2. El lugar seleccionado para anidar tiene una influencia decisiva en el éxito natural de eclosión y las hembras suelen anidar con menor frecuencia en las zonas intermareal y de vegetación, reduciendo riesgos de inundación, erosión, invasión por raíces, o depredación de los huevos (Chacón-Chaverri, 1999; Caut et al., 2006; Quiñones et al., 2007). La anidación es nocturna y se puede ver afectada por las mareas, la luna o la iluminación artificial de la playa (Fig. 1). Las hembras salen de forma aislada a la playa y ascienden lentamente seleccionando su lugar de puesta. Pueden realizar varios intentos de anidación antes de excavar el nido y también pueden retornar al agua sin anidar. La duración media de la puesta medida desde la emergencia del mar hasta la vuelta a éste varía entre 93 y 117,8 min (Patiño-Martínez et al., 20101; Eckert et al., 2015) 2. La profundidad total media del fondo del nido respecto a la superficie de la arena suele variar entre 60 y 80 cm, mientras que la parte superior del nido suele estar entre 40 y 60 cm de la superficie (Wallace et al., 2004).
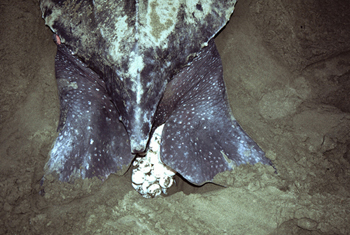
Figura 1. Tortuga laúd desovando en una playa de Colombia (C) L. Quiñones
El número de huevos de cada puesta tiene un valor medio entre 80 y 90 (Hilterman y Goverse, 2007). Las hembras más largas no parecen poner más huevos por nido (Reina et al., 2002; Hirth et al., 1993; Tucker y Frazer, 1991; Quiñones et al., 2007) aunque las hembras con mayor anchura sí podrían tener la capacidad de desarrollar más huevos por nido (Quiñones et al., 2007). Los huevos son esféricos, blancos, levemente cremosos y apergaminados, con poca elasticidad. Miden 49-55 mm de diámetro (Hirth y Ogren, 1987) y tienen un peso inicial de entre 72 y 100 g (Leslie et al., 1996; Reina et al., 2002) dimensiones que variarán levemente durante la incubación (Marco et al., 2006). Es una característica propia de esta especie la deposición de los llamados “falsos huevos” que en realidad son glóbulos de albúmina, sin yema ni embrión y cubiertos por cáscara (Bell et al., 2003; Wallace et al., 2006). El número y tamaño medios de los glóbulos de albúmina por nido es muy variable, representa de media un 12 % del peso de la nidada y parece estar negativamente correlacionado con el número de huevos (Quiñones et al., 2007). Su tamaño medio es muy variable entre nidos y suele fluctuar entre 29 y 37 mm (rango 1-47 mm) (Hirth y Ogren, 1987). Estos glóbulos son depositados en último lugar, quedando en la parte superior del nido y se les atribuyen funciones beneficiosas para el desarrollo embrionario (Caut et al., 2006) como la protección ante depredación, o reducir la penetración de arena entre los huevos que dificultaría procesos de intercambio de gases. Su desecación al final de la incubación podría contribuir a crear una cámara de aire con un volumen medio de 785 cm³ que facilitaría la complicada ascensión de los neonatos desde el fondo del nido hasta la superficie de la playa (Patiño-Martínez et al., 2004). Todavía no se ha demostrado la función de los falsos huevos (Rostal, 20152). La tasa de fertilización de los huevos suele ser superior al 90 % (Bell et al., 2003). No existe variación a lo largo de la temporada de desove ni en la cantidad y el tamaño de huevos y de glóbulos de albúmina (Rostal, 2015) 2, ni en el éxito de eclosión comparando entre nidos de distintas hembras o entre puestas de la misma hembra (Quiñones et al., 2007). La incubación dura en término medio unos 60 días a unos 29,5ºC, aunque puede oscilar entre 50 y 78 días en función, sobre todo, de la temperatura de incubación. Temperaturas más altas aceleran el desarrollo y si son durante el segundo tercio de la incubación producen más hembras mientras que ambientes más fríos retrasan el proceso y producen más machos. La temperatura pivotal que produce una razón de sexos equilibrada está estimada en 29,5 ºC (Mrosovsky, 1994; Binckley y Spotila, 20152). Por encima de 31 ºC o por debajo de 28 ºC se producirían individuos de un sólo sexo (Chan y Liew, 1995). Hay diferencia entre poblaciones tanto en la temperatura que produce una sex-ratio de 1:1 como en el rango de temperaturas que producen el cambio de que todas las crías sean machos a que sean hembras (Chevalier et al., 1999; Binckley y Spotila, 2015)2. El nivel del agua en las playas cambia por efecto de las mareas. Al descender el nivel del agua, entra aire a través de la arena ventilando los nidos, mejorando los efectos del metabolismo de la puesta en el nido (Sotherland et al., 2015)2. El éxito de nacimientos de la tortuga laúd es el más bajo de todas las tortugas marinas y es aproximadamente del 50%, aunque hay variación entre sitios de nidificación y también hay variación estacional e interanual dentro de sitios. El éxito de emergencia de los nidos varía entre 0,12 y 0,49% (Caut et al., 2006; Hilterman y Goverse, 2007; Santidrián Tomillo y Swiggs, 2015)2. El éxito de eclosión de los nidos pueden ser mucho menor cuando el impacto del expolio de nidos es elevado (Suganuma et al., 2005; Chacon-Chaverri y Eckert, 2007; Tomillo et al., 2008; Patino-Martínez et al., 2008). Los nidos naturales protegidos in situ suelen presentar porcentajes de eclosión mayores que los de los nidos translocados a viveros. A pesar de esto, la elevada mortalidad en nidos no protegidos y el alto coste de protegerlos en las playas naturales, recomienda la translocación de nidadas a corrales de protección (Quiñones et al., 2007). Los nacimientos son sincrónicos dentro de cada nido y la emergencia del nido (Figura 2), que suele ser masiva y nocturna, tarda 3,3 días de media. Al salir del nido permanecen quietos unos 20 min antes de moverse hacia el mar (Patiño-Martínez et al., 20101; Santidrián Tomillo y Swiggs, 2015)2.
Figura 2. Emergencia de recién nacidos de tortuga laúd (C) J. Patino
Los neonatos tienen una longitud media del espaldar de 60 mm, variando entre 50 y 70 mm y un peso medio de 44,6 gr, variando entre 35 y 50 g (Hirth y Ogren, 1987). El tamaño del huevo determina, en gran medida, la longitud y el peso de las crías, de forma que huevos más grandes producen crías más pesadas y más largas (Quiñones et al., 2007). Nidos alejados de la orilla o la presencia de basura, estructuras o iluminación artificial en la playa pueden alterar e impedir el acceso al agua y provocar la muerte de las tortuguitas (Patino-Martínez et al., 2009).
Estructura y dinámica de poblaciones El éxito de emergencia de crías es enormemente variable entre nidos, entre playas y estacionalmente, influyendo decisivamente factores como la depredación, la inundación, la erosión de la arena, la deshidratación excesiva del nido, la infección por microorganismos o la presencia de arcilla o raíces de plantas (Patino-Martínez et al., 2008). Se han detectado variaciones de <20 a >75 % de éxito de eclosión entre playas próximas en poblaciones del Caribe (Patino-Martínez et al., 2008). La mortalidad de huevos y de neonatos en los primeros momentos de vida libre suele ser muy elevada pudiendo superar el 90%.Hay variación estacional en la proporción de sexos de las crías. En los meses que hay mayores precipitaciones se producen más machos y en los meses más secos hay más hembras (LeBlanc y Wibbels, 2009; Binckley y Spotila, 2015) 2. Las hembras se reproducen cada 1-6 años (Eckert et al., 2015)2. Se ha sugerido que la edad de la madurez sexual podría variar entre 6 y 16 años, sin embargo estudios recientes indican que se alcanzaría con 24,5-29 años de edad y una longitud del caparazón de 145 cm (Avens y Snover, 2013)1. En las Islas Vírgenes se ha estimado una tasa anual de mortalidad de hembras adultas del 11 % (Dutton et al., 2005). Sobre la población anidante en el Caribe se ha estimado una mortalidad anual de hembras adultas del 22 % (Tomillo et al., 2007) y una mortalidad de juveniles que dobla la esperada en una población estable. Las altas tasas de mortalidad juvenil y adulta en algunas poblaciones podrían estar reduciendo significativamente la longevidad real de las tortugas y su productividad.
Referencias Avens, L., Snover, M. L. (2013). Age and Age stimation in Sea Turtles. Pp. 97-133. En: Wyneken, J., Lohmann, K. J., Musick, J. A. (Eds.). The Biology of Sea Turtles. Volume III. CRC Press, Boca Raton. Bailey, H., Shillinger, G., Palacios, D., Bograd, S., Spotila, J., Paladino, F., Block, B. (2008). Identifying and comparing phases of movement by leatherback turtles using state-space models. J. Exp. Mar. Biol. Ecol., 356: 128-135. Bell, B. A., Spotila, J. R., Paladino, F. V., Reina, R. D. (2003). Low reproductive success of leatherback turtles, Dermochelys coriacea, is due to high embryonic mortality. Biol. Conserv., 115, 131-138. Binckley, C. A., Spotila, J. R. (2015). Sex Determination and Hatchling Sex Ratios of the Leatherback Turtle. Pp. 84-93. En: Spotila, J. R., Santidrián Tomillo, P. (Eds.). The Leatherback Turtle. Biology and Conservation. Johns Hopkins University Press, Baltimore. 219 pp. Caut, S., Guirlet, E., Jouquet, P., Girondot, M. (2006). Influence of nest location and yolkless eggs on the hatching success of leatherback turtle clutches in French Guiana. Can. J. Zool., 84: 908-915. Crim, J. L., Spotila, L. D., Spotila, J. R., O'Connor, M., Reina, R., Williams, C. J., Paladino, F. V. (2002). The leatherback turtle, Dermochelys coriacea, exhibits both polyandry and polygyny. Mol. Ecol., 11: 2097-2106. Chacón-Chaverri, D. (1999). Dermochelys coriacea (Testudines: Dermochelyidae) nesting in playa Gandoca, Costa Rica (1990 through 1997). Rev. Biol. Trop., 47: 225-236. Chacón-Chaverri, D., Eckert, K. L. (2007). Leatherback sea turtle nesting at Gandoca Beach in Caribbean Costa Rica: Management recommendations from fifteen years of conservation. Chelon. Conserv. Biol., 6: 101-110. Chan, E. H., Liew, H. C. (1995). Incubation temperatures and sex-ratios in the Malaysian Leatherback Turtle Dermochelys coriacea. Biol. Conserv., 74: 169-174. Chevalier, J., Godfrey, M. H., Girondot, M. (1999). Significant difference of temperature-dependent sex determination between French Guiana (Atlantic) and Playa Grande (Costa-Rica, Pacific) leatherbacks (Dermochelys coriacea). Ann. Sci. Nat. Zool. Biol. Anim., 20: 147-152. Dutton, D. L., Dutton, P. H., Chaloupka, M., Boulon, R. H. (2005). Increase of a Caribbean leatherback turtle Dermochelys coriacea nesting population linked to long-term nest protection. Biol. Conserv., 126: 186-194. Eckert, K. L., Wallace, B. P., Spotila, J. R., Bell, B. A. (2015). Nesting Ecology and Reproductive Investment of the Leatherback Turtle. Pp. 63-73. En: Spotila, J. R., Santidrián Tomillo, P. (Eds.). The Leatherback Turtle. Biology and Conservation. Johns Hopkins University Press, Baltimore. 219 pp. Hilterman, M. L., Goverse, E. (2007). Nesting and nest success of the leatherback turtle (Dermochelys coriacea) in Suriname, 1999-2005. Chelon. Conserv. Biol., 6: 87-100. Hirth, H. F., Kasu, J., Mala, T. (1993). Observations on a Leatherback Turtle Dermochelys coriacea nesting population Near Piguwa, Papua New Guinea. Biol. Conserv., 65: 77-82. Hirth, H., Ogren, L. (1987). Some aspects of the ecology of the leatherback turtle Dermochelys coriacea at Laguna Jalova, Costa Rica. Pp. 1-13. U.S Department of commerce. National Oceanic and Atmospheric Administration NOAA. James, M. C., Eckert, S. A., Myers, R. A. (2005). Migratory and reproductive movements of male leatherback turtles (Dermochelys coriacea). Mar. Biol., 147: 845-853.Leblanc, A. M., Wibbels, T. (2009). Effect of daily water treatment on hatchling sex ratios in a turtle with temperature-dependent sex determination. J. Exp. Zool. A., 311: 68-72. Leslie, A. J., Penick, D. N., Spotila, J., Paladino, F. (1996). Leatherback turtle, Dermochelys coriacea, nesting and nest success at Tortuguero, Costa Rica, in 1990 - 1991. Chelon. Conserv. Biol., 2: 159-168. Marco, A., Patino-Martínez, J., Quiñones, L. (2006). Field and experimental evidence about the influence of substrate water content on hatching success of Leatherback Turtle eggs. Pp. 65 – 66. En: Frick, M., Panagoulou, A., Rees, A.F.; Williams, K. (Eds.). 26th Annual Symposium on Sea Turtle Biology and Conservation. International Sea Turtle Society, Island of Crete, Greece. Miller, J. D. (1997). Reproduction in sea turtles. Pp. 51-81. En: Lutz, P. L., Musick, J. A. (Eds.). The Biology of sea turtles. CRC Press Boca Raton, Florida. Mrosovsky, N. (1994). Sex ratios of sea turtles. J. Exp. Zool., 270: 16–27. Patino-Martínez, J., Marco, A., Quiñones, L., Godley, B. (2008). Globally significant nesting of the leatherback turtle (Dermochelys coriacea) on the Caribbean coast of Colombia and Panama. Biol. Conserv., 141: 1982-1988. Patino-Martínez J., Marco, A., Quiñones, L. (2009). The accumulation of driftwood on the beach disturbs leatherback nesting and newborn behaviour affecting reproductive success. En: Proceedings of the 29th Sea Turtle Symposium, International Sea Turtle Society. Brisbane, Australia, February 2009. Patiño-Martínez, J., Marco, A., Quiñones, L. (2010). Los huevos falsos (SAGs) facilitan el comportamiento social de emergencia del nido en la toruga laúd, Dermochelys coriacea (Testudines: Dermochelyidae). Revista de Biología Tropical, 58 (3): 943-954. Patino-Martínez, J., Quiñones, L., Marco, A. (2004). Emergencia del nido en Dermochelys coriacea: Un trabajo social entre hermanos. Pp. 60. En: Actas del X Congreso español y VII iberoamericano de Etología. Sociedad Española de Etología. Aguadulce (Almería). Quiñones, L., Patiño-Martínez, J., Marco, A. (2007). Factores que influyen en la puesta y el éxito de eclosión de la Tortuga Laúd, Dermochelys coriacea, en La Playona, Chocó, Colombia. Rev. Esp. Herpetol., 21: 5-17. Reina, R., Mayor, P. H., Spotila, J., Piedra, R., Paladino, F. V. (2002). Nesting ecology of the Leatherback Turtle, Dermochelys coriacea, at Parque Nacional Marino Las Baulas, Costa Rica: 1988-1989 to 1999-2000. Copeia, 2002: 653-664. Rostal, D. C. (2015). Reproductive Biology of the Leatherback Turtle. Pp. 51-62. En: Spotila, J. R., Santidrián Tomillo, P. (Eds.). The Leatherback Turtle. Biology and Conservation. Johns Hopkins University Press, Baltimore. 219 pp. Santidrián Tomillo, P., Swiggs, J. (2015). Egg Development and Hatchling Output of the Leatherback Turtle. Pp. 74-83. En: Spotila, J. R., Santidrián Tomillo, P. (Eds.). The Leatherback Turtle. Biology and Conservation. Johns Hopkins University Press, Baltimore. 219 pp. Sotherland, P. R., Wallace, B. P., Spotila, J. R. (2015). Leatherback Turtle Eggs and Nests, and Their Effects on Embryonic Development. Pp. 136-148. En: Spotila, J. R., Santidrián Tomillo, P. (Eds.). The Leatherback Turtle. Biology and Conservation. Johns Hopkins University Press, Baltimore. 219 pp. Suganuma, H., Yusuf, A., Bakarbessy, Y., Kiyota, M. (2005). New leatherback turtle conservation project in Papua, Indonesia. Mar. Turtle Newslet., 109: 8. Tomillo, P. S., Saba, V. S., Piedra, R., Palkdino, F. V., Spotila, J. R. (2008). Effects of Illegal Harvest of Eggs on the Population Decline of Leatherback Turtles in Las Baulas Marine National Park, Costa Rica. Conservation Biology, 22: 1216-1224. Tomillo, P. S., Velez, E., Reina, R. D., Piedra, R., Paladino, F. V., Spotila, J. R. (2007). Reassessment of the leatherback turtle (Dermochelys coriacea) nesting population at Parque Nacional Marino Las Baulas, Costa Rica: Effects of conservation efforts. Chelon. Conserv. Biol., 6: 54-62. Tucker, A. D., Frazer, N. B. (1991). Reproductive variation in leatherback turtles, Dermochelys coriacea, at Culebra National Wildlife Refuge, Puerto Rico. Herpetologica, 47: 115-124. Wallace, B. P., Sotherland, P. R., Spotila, J. R., Reina, R. D., Franks, B. F., Paladino F. V. (2004). Abiotic and biotic factors affect the nest environment of embryonic leatherback turtles, Dermochelys coriacea. Physiol. Biochem. Zool., 77: 423-432. Wallace, B. P., Sotherland, P. R., Tomillo, P. S., Bouchard, S. S., Reina, R. D., Spotila, J. R., Paladino, F. V. (2006). Egg components, egg size, and hatchling size in leatherback turtles. Comp. Biochem. Physiol. A-Mol. Integr. Physiol., 145: 524-532. Witt, M. J., Broderick, A. C., Coyne, M. S., Formia, A., Ngouessono, S., Parnell, R. J., Sounguet, G. P., Godley, B. J. (2008). Satellite tracking highlights difficulties in the design of effective protected areas for Critically Endangered leatherback turtles Dermochelys coriacea during the inter-nesting period. Oryx, 42: 296-300.
Adolfo Marco, Juan Patino-Martínez, Maite Ikaran y Liliana Quiñones Fecha de publicación: 30-07-2009 Otras contribuciones: 1. Alfredo Salvador. 20-11-2015; 2. Alfredo Salvador. 28-01-2016 Marco, A., Patino-Martínez, J., Ikaran, M., Quiñones, M. L. (2016). Tortuga laúd – Dermochelys coriacea. En: Enciclopedia Virtual de los Vertebrados Españoles. Salvador, A., Marco, A. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
|
|
|
|
|
|
|