|
|
|
|
|
|
Para más información sobre cada apartado hacer click en:
|
Key words: Pyrenean Rock Lizard, identification, description, size, variation.
Sinónimos y combinaciones Lacerta (Podarcis) monticola bonnali Lantz, 1927; Lacerta muralis bonnali – Mertens y Müller, 1928; Lacerta monticola bonnali – Mertens, 1929; Lacerta (Archaeolacerta) monticola bonnali – Mertens y Müller 1940; Lacerta bonnali – Arribas, 1993; Archaeolacerta bonnali – Böhme y Corti 1993; Iberolacerta bonnali – Arribas, 1997; Iberolacerta (Pyrenesaura) bonnali – Arribas, 1999. El estatus específico de I. bonnali fue confirmado por Arribas (1993) y Pérez-Mellado et al., (1993).
Origen y evolución La datación y secuencia de diferenciaciones entre las distintas especies de lagartijas pirenaicas, difieren según la aproximación genetica empleada. A partir del estudio de electroforesis de aloenzimas, Iberolacerta aranica comienza a diferenciarse tempranamente del antepasado común de I. aurelioi y I. bonnali, hace aproximadamente entre 2,25 y 1,55 (media de 2) millones de años respectivamente (Dnei= 0.45 respecto a I. bonnali y Dnei=0.31 respecto a I. aurelioi) coincidiendo con las fases iniciales del Pleistoceno mientras que estas últimas dos especies se habrían diferenciado hace 450.000 años (Dnei=0.09 entre I. aurelioi e I. bonnali) durante el Pleistoceno Medio. Las diferencias genéticas encontradas en la secuenciación del gen mitocondrial 12S rRNA son aproximadamente de un 2% entre las especies pirenaicas. Eso quiere decir que su diferenciación se remonta según esta técnica y este gen a unos 2 millones de años, es decir, al inicio de las glaciaciones pleistocénicas. Según el método de agregación (distancia o parsimonia -mínimo número de cambios posibles) la especie más diferenciada varía. Con el primero, por distancias genéticas, aparentemente es la lagartija pirenaica la más diferenciada, pero esto no está tan claro observando las distancias recíprocas entre ellas. Concretamente, la diferencia menor es entre la lagartija pirenaica (I. bonnali) y la pallaresa (I. aurelioi), que sería de 1,8 % (aprox. 1,8 millones de años de divergencia) y que casa bien con la hipótesis previas basadas en osteología y cariotipos. La distancia genética de la lagartija pallaresa a la aranesa, sería de 2.2% (2,2 millones de años de separación entre las poblaciones de Barlonguere y Orlà -pertenecientes a I. aranica- respecto a las de Mont-Roig -ya perteneciente a I. aurelioi-). La diferencia entre la aranesa (I. aranica) y la pirenaica (I. bonnali) es de 2,4% (2.4 millones de años). Si se toma como criterio el arbol de mínima extensión, también aparece la lagartija aranesa como la más diferenciada. Otro estudio que tiene en cuenta el gen mitocondrial Cyt b (citocromo b) arroja estas diferencias: 6,2 % entre la pirenaica y la pallaresa, 7,4 % entre la pallaresa y la aranesa, y 9,8 % entre la pirenaica y la aranesa. Si se toma en conjunto los tres genes (Cyt b+12s rRNA+CMos; este último, un gen nuclear de evolución muy lenta), las diferencias conservan la misma escala recíproca: 2,5 % entre la pirenaica y la pallaresa, 3 % entre la pallaresa y la aranesa, y 3.7% entre la pirenaica y la aranesa. Está claro que la barrera más importante es el curso de la Garona, ya que las diferencias más importantes se acumulan en todos los casos entre la lagartija pirenaica (I. bonnali) hoy presente al S y W del Valle de Arán, en la Maladeta y Aigües-Tortes, y la lagartija aranesa (I. aranica) del Mauberme y sus contrafuertes. Esto debió suceder entre 2,4 millones de años (con el gen 12s rRNA) o alrededor de 4,2 ± 1,4 millones de años según la combinación de todos los genes estudiados (3,7% de divergencia). Ambas fechas pueden correlacionarse con el inicio de las glaciaciones, es decir con la presencia intermitente de glaciar en el valle de la Garona, o con el modelado y entalladura fluvial de la cuenca de la Garona que es de finales del Terciario en la forma que lo conocemos hoy en día. La segunda barrera más importante es el estrecho margen "en filo de cuchillo" que separa el Tuc de Mill del Macizo de Mont-Roig (al menos, es la zona en la que actualmente no vive ninguna especie de este grupo de lagartijas), que separó a la lagartija aranesa de la pallaresa, cuyo aislamiento entre poblaciones debió darse entre 2,2 millones de años (gen 12s rRNA) y 3,8 ± 1,4 millones de años con el combinado de genes (3% de divergencia). El aislamiento debe estar relacionado, al igual que en el caso anterior con el modelado del relieve (haciendose la zona alpina de crestas muy estrecha) probablemente por acción de los glaciares de la alta Noguera Pallaresa. La tercera barrera es el valle de la Noguera Pallaresa, también glaciar, con una situación y génesis muy parecido al del Garona, que separó las poblaciones de lagartija pirenaica de las de la pallaresa hace unos 1,8 millones de años (gen 12s rRNA) o bien cerca de 4,2 ± 1,4 millones de años (un 2,5% de divergencia). En todos los casos está claro que el margen de diferencias entre ellas es muy pequeño, quedaron aisladas "casi a la vez" o sea, en un margen muy estrecho de tiempo, y en general parece que de forma muy ligada a la dinámica de aparición glaciar o de sobreexcavación por éstos de las altas cuencas de la Garona y la Noguera Pallaresa. El tratamiento de las distancias mutuas entre las especies pirenaicas no resuelve las relaciones de parentesco entre ellas de forma inequívoca. Según el algoritmo de agregación (el método de construcción de árbol), la lagartija aranesa aparece como especie hermana de las otras dos (la pallaresa y la pirenaica serían más parientas entre sí) o bien sólo de la lagartija pallaresa (siendo entonces la pirenaica la más diferenciada). La primera hipótesis: (aranesa (pirenaica+pallaresa)) coincide con los resultados más plausibles de la osteología y cromosomas, mientras que la segunda (pirenaica (pallaresa+aranesa)) coincide con la del estudio de los microsatélites del DNA (Mayer y Arribas, 1996; Arribas, 1997, 2007; Mayer y Arribas, 2003; Carranza et al., 2004; Crochet et al., 2004). La solución definitiva, todavía no se conoce, pero en todo caso el fenómeno debió ocurrir en un tiempo geológica y evolutivamente corto para no haber dejado una traza clara en las diferencias relativas entre sus tres genomas. Datos preliminares no publicados de Fulgione, Odierna y Arribas (Arribas, 2007), basados en el estudio de cinco microsatélites del ADN (véanse resultados detallados en el texto de I. aranica y en Arribas, 2007), muestra que el número medio de alelos resultó más bajo en I. aranica e I. aurelioi que en I. bonnali, lo que está de acuerdo con la menor diversidad genética encontrada en esas especies. Iberolacerta bonnali (de Monte Perdido, Huesca) muestra la mayor diversidad, mientras que I. aurelioi (Pica d’Estats, Lérida) e I. aranica (Barrados, Lérida) mostraron valores de heterocigosidad (0,515, 0,098 y 0, 373, respectivamente) significativamente menores que los encontrados en otros lagartos, incluyendo especies insulares, probablemente debido a fuertes cuellos de botella poblacionales y a sus áreas pequeñas y fragmentadas (excepto en I. bonnali). También Bloor (2006) amplificó seis microsatélites y los encontró polimórficos en I. bonnali, cinco en I. aranica y solo tres en I. aurelioi (Arribas, 2014)1.
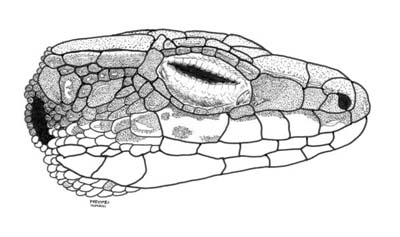
Descripción Descripciones previas del taxón bonnali (sin distinción entre las tres especies pirenaicas), se encuentran en Lanza (1963), Martínez-Rica (1977), Salvador (1984), Brown y Pérez-Mellado (1993) y Pérez-Mellado (1998). Folidosis Entre 0 y 15 (media = 4,73) gránulos supraciliares en el lado derecho y entre 0 y 17 (4,50) en el lado izquierdo; de 17 a 25 (21,64) gularia en machos y 17 a 27 (22,34) en hembras; 5 a 15 (10,10) collaria; 36 a 48 (42,81) dorsalia; 25 a 29 (26,29) escamas ventrales en machos y 25 a 31 (28,32) en hembras; 9 a 18 (13,87) poros femorales en el lado derecho y 10 a 18 (13,88) en el lado izquierdo; 20 a 31 (26,10) lamellae bajo el cuarto dedo del pié; 6 a 15 (9,22) escamas circumanales. Escamas rostral e internasal generalmente en contacto (97,28 % de los ejemplares); postocular y parietal generalmente en contacto (91,23 %), al igual que ocurre entre supranasal y loreal (79,42 %). Generalmente más de una escama entre masetérica y timpánica. Anomalías de las escamas de la cabeza muy frecuentes (Martinez-Rica, 1977; Arribas, 1994b). Coloración Dorso de color grisáceo o grisáceo-parduzco (pero nunca claramente marrón como en I. aurelioi), ocasionalmente con reflejos oliváceos. A lo largo del dorso puede haber dos líneas paravertebrales de manchas, más marcadas en la primera mitad del cuerpo y más abundantes en machos, en algunos de los cuales definen una zona central con el color de fondo del dorso más oscuro. También el píleo de estos individuos más pigmentados (generalmente machos) puede tener algunos puntos. Este patron paravertebral oscuro se extiende dorsalmente a la base de la cola. Generalmente, las líneas claras dorsolaterales no están marcadas o como mucho aparecen muy irregularmente en la parte anterior del dorso. Bandas laterales (costales o temporales) de color pardo muy oscuro y generalmente uniforme. Banda lateral inferior presente en forma de una serie de manchas, más marcadas en machos, y muy frecuentemente ausentes, especialmente en hembras. Partes inferiores siempre blancas (blanco hueso), con pocas manchas oscuras (sin manchas en el 52,9% de los machos y en el 95,2% de las hembras; con manchas en el par de series de ventrales exteriores en el 43% de los machos y en el 4,1% de las hembras; con manchas en los dos pares de series de ventrales exteriores en el 3,9% del los machos y menos del 1% de las hembras). Raras veces la parte interior de la pantorrilla puede presentar color amarillo claro (un carácter atávico, resto posiblemente de la coloración del antepasado común con las otras Pyrenesaura). Puntos azules en las ventrales externas muy raros, ausentes en el 96,94% de los ejemplares, pero en caso de existir, son reflectantes en ultravioleta (Arribas, 20121). Albinismo. Se ha encontrado una hembra en Bigorre (Lac Bleu) con áreas despigmentadas en la cabeza y parte superior de la cola. Melanismo. Se han citado cuatro ejemplares: Una hembra y un juvenil de Bigorre (Lac Bleu), un recién nacido de Llac de Llauset (Ballibierna) y un ejemplar del Ibón de Respumoso (macizo de Arriel). Ejemplares concolor. Se han encontrado ejemplares muy claros y sin patrón oscuro en Bigorre (un juvenil) y en Llac de Llauset (una hembra adulta). Variación con la edad. El dorso de los recién nacidos (primer año calendario) es gris o gris pardusco, normalmente uniforme, con las dos bandas costales oscuras y sin más marcas apreciables. Ocasionalmente hay manchas oscuras paravertebrales. Vientre blanco, con manchas oscuras en el borde anterior de las escamas ventrales muy conspicuas. Cola generalmente grisácea. A pesar de lo que frecuentemente se dice, rara vez tiene tonos azulados o verdosos. Juveniles y subadultos (hasta el tercer año calendario incluido) son muy similares a recién nacidos, sin ningún color llamativo en la cola y con el patrón oscuro ventral progresivamente reducido (Arribas, 1994b).
Figura 1. Hembra de lagartija pirenaica. © O. Arribas
Figura 2. Aspecto ventral de la lagartija pirenaica. © O. Arribas
Figura 3. Aspecto lateral de la cabeza. © O. Arribas
Tamaño El tamaño medio de longitud de cabeza y cuerpo de los machos mide 52,17 mm y el de las hembras 55,03mm. El macho más grande encontrado mide 58,73 mm y la hembras más grande 65,36 mm (Arribas, 1994b).
Dimorfismo sexual Iberolacerta bonnali presenta un grado intermedio de dimorfismo sexual, comparado con el de las otras dos especies de Pyrenesaura. Las partes más dimórficas son las proporciones de la cabeza y, sobre todo, de los miembros anteriores y posteriores, que son proporcionalmente mayores en los machos, según su mayor o menor grado de adaptación a la vida saxícola (en general ligada al tipo de roca y su inclinación). Iberolacerta bonnali es una especie marcadamente saxícola. Los machos presentan cabezas largas, platicéfalas y miembros, especialmente los posteriores, largos. Las hembras son mayores que los machos, tanto en media como en dimensiones absolutas. Existen diferencias en ventralia entre los machos y hembras (mayores conteos en estas últimas), relacionadas con la mayor longitud corporal de estas. Los machos presentan vientres más punteados que las hembras (Arribas, 1997, 2000b)1.
Cariotipo Se compone de 24 cromosomas en los machos y 23 en las hembras. Cromosomas sexuales con sistema Z1Z2W. NOR en una posición telomérica en el brazo largo del tercer par de cromosomas bibraquiales (Odierna et al., 1996; Arribas, 1994b, 1997, 1999 b).
Osteología Cráneo con proceso anterodistal del postfrontal presente. Proceso anteromedial del postorbitario ausente por reducción secundaria. Hueso postorbitario igual o algo más corto que el postfrontal. Premaxila con siete dientes y processus nasalis esbelto y de lados subparalelos. De 14 a 18 dientes maxilares y 17 a 21 dentarios, generalmente bicúspides, aunque algunos individuos son intermedios u unicúspides. Los machos tienen normalmente 26 vértebras presacras y las hembras 27. La tercera vértebra tiene a menudo asociada una costilla ósea. Fotanela esternal ovalada. Clavículas abiertas e interclavícula de forma cruciforme. Generalmente seis costillas dorsales posteriores, a veces cinco o siete. Primeras vértebras caudales con proceso perpendicular en su parte anterior (“tipo A”) (Arribas, 1994 a, 1997, 1998 a, 1999 a, 1999 b).
Hemipenes El aspecto general de los hemipenes es muy parecido a las de las otras especies de Iberolacerta (aunque I. aurelioi tiene el hemipene claramente más pequeño) pero difiere de estas por tener el labio externo notablemente desarrollado. Micro ornamentación hemipenial usualmente espinosa (digitiforme). Ocasionalmente tiene tubérculos aislados en forma de corona (cononiformes) (Arribas, 1994 a, 1997).
Datos aloencimáticos Esta especie difiere de I. aurelioi en un alelo (PGM-2), y de I. aranica en cuatro alelos (AK , GOT-1, PGM-2 and MDH-1) (Mayer y Arribas, 1996).
Variación geográfica Unl estudio morfológico multivariante ha revelado que las poblaciones de Posets más Maladeta y Ballibierna forman un grupo central, con respecto a las cuales aparecen más diferenciadas las de Bigorre hacia el norte, Monte Perdido hacia el oeste y Aigüestortes hacia el este. La variación más importante de la coloración es la del dorso y se relaciona con el tipo de roca en las que viven. En Monte Perdido por ejemplo, son muy claras ya que habitan sobre roca caliza, mientras que en Posets y sobre esquistos son muy oscuras (Arribas, 1994b, 1996, 1997, 1998b). El estudio de varios fragmentos concatenados de ADNmt (Arribas, 2007, con datos inéditos de S. Carranza y O Arribas), consistentes en 2.013 pares de bases (cyt b + 12S + 16S), sugiere que en I. bonnali existen dos clados, uno oriental que habita Aigüestortes y La Maladeta, y uno occidental, que ocupa desde el límite este de la especie hasta el reborde norte calcáreo del batolito de La Maladeta (Puerto de Benasque. En este mismo macizo, al sur, en la zona granítica está el haplotipo oriental). Dentro del haplotipo oriental hay una posición de diferencia entre los de Maladeta (Llauset) y los de Aigüestortes (Port de Rus y Caballers). Un espécimen de Aigüestortes también varía en una posición. Todos los ejemplares del haplotipo occidental son idénticos, excepto dos de los tres ejemplares de Neouvielle, y por otro lado tres de los cuatro ejemplares estudiados de Benasque diferían en una base. La existencia de dos haplotipos diferentes en I. bonnali fue mencionada por ya por Carranza et al. (2004) y confirmada posteriormente también por Mouret et al. (2011). Estos haplotipos no se corresponden con diferencias morfológicas, cariológicas ni osteológicas (Arribas, 2000), y probablemente proceden de diferenciación durante alguno de los vaivenes climáticos pleistocenos. Estos últimos autores, basándose en análisis de coalescencia y con un buen muestreo de la vertiente norte pirenaica, sugieren que las poblaciones periféricas divergieron simultáneamente al final de la última glaciación. Encuentran alta diversidad mitocondrial en poblaciones periféricas mientras que las axiales pirenaicas están más empobrecidas. También se confirma que son reinmigrantes de corta distancia desde refugios cercanos (in situ) (Arribas, 2014)1. Un análisis de genes mitocondriales y nucleares de 13 poblaciones francesas de la especie ha revelado que el flujo de genes es muy reducido incluso a distancias pequeñas (2-3 km) junto con una señal moderada de aislamiento por distancia. No se ha encontrado correlación entre diversidad nuclear y diversidad mitocondrial. Los resultados de este trabajo apoyan un escenario de fragmentación de poblaciones periféricas después del último máximo glacial y colonización postglacial y expansión de poblaciones centrales (Ferchaud et al., 2015)1.
Referencias Arribas, O. (1993). Intraspecific variability of Lacerta (Archaeolacerta) bonnali Lantz, 1927 (Squamata: Sauria: Lacertidae). Herpetozoa, 6: 129-140. Arribas, O. (1994 a). Una nueva especie de lagartija de los Pirineos Orientales: Lacerta (Archaeolacerta) aurelioi sp. nov. (Reptilia: Lacertidae). Boll. Mus. reg. Sci. nat. Torino, 12 (1): 327-351. Arribas, O. (1994 b). Diagnosis and redescription of Lacerta bonnali Lantz, 1927.). Boll. Mus. reg. Sci. nat. Torino, 12 (2): 357-366. Arribas, O. (1996). Taxonomic revision of the Iberian 'Archaeolacertae' I: A new interpretation of the geographical variation of 'Lacerta' monticola Boulenger, 1905 and 'Lacerta' cyreni Müller & Hellmich, 1937 (Squamata: Sauria: Lacertidae). Herpetozoa, 9 (1/2): 31-56. Arribas, O. (1997). Morfología, filogenia y biogeografía de las lagartijas de alta montaña de los Pirineos. Tesis doctoral. Universidad Autónoma de Barcelona. 353 pp. Arribas, O. (1998a). Osteology of the Pyrenaean Mountain Lizards and comparison with other species of the collective genus Archaeolacerta Mertens, 1921 s.l. from Europe and Asia Minor (Squamata: Lacertidae). Herpetozoa, 11: 47-70. Arribas, O. (1998 b). Estudio sobre la morfología y diferenciación local de las poblaciones de lagartija pirenaica (‘Lacerta’ bonnali Lantz, 1927; Squamata: Lacertidae) en el Macizo de la Maladeta y el Parque Nacional de Aigüestortes y Lago de San Mauricio. Pp. 225-235. En: Actas IV Jornades sobre la Recerca al Parc Nacional d’Aigüestortes i Estany de Sant Maurici. Espot (Pallars Sobirà). 22, 23 i 24 d’octubre de 1997. Arribas, O. (1999a). Taxonomic revision of the Iberian “Archaeolacertae” II: Diagnosis, morphology and geographic variation of ‘Lacerta’ aurelioi Arribas, 1994. Herpetozoa, 11: 155-180. Arribas, O. (1999b). Phylogeny and relationships of the mountain lizards of Europe and Near East (Archaeolacerta Mertens, 1921, Sensu Lato) and their relationships among the Eurasian Lacertid Radiation. Russ. J. Herpetol., 6: 1-22. Arribas, O. (2000). Taxonomic revision of the Iberian ‘Archaeolacertae’ III: Diagnosis, morphology, and geographic variation of Iberolacerta bonnali (Lantz, 1927). Herpetozoa, 13(3/4): 99-131. Arribas, O. J. (2007). Istòria Naturau e Evolucion dera Cernalha Aranesa, Iberolacerta aranica. Conselh Generau d’Aran. 446 pp. Arribas, O. J. (2014). Iberolacerta (Pyrenesaura) bonnali (Lantz, 1927). Pp. 433-444. En: Salvador, A. (Coordinador). Reptiles, 2ª edición revisada y aumentada. Fauna Ibérica, vol. 10. Ramos, M. A. et al. (Eds.). Museo Nacional de Ciencias Naturales, Consejo Superior de Investigaciones Científicas, Madrid. 1367 pp. Bloor, P. (2006). Polymorphic microsatellite markers for the Iberian rock lizard species, Iberolacerta cyreni, and cross-species priming in other Iberolacerta species. Molecular Ecology Notes, 6 (4): 1252-1254. Brown, R.P., Pérez-Mellado, V. (1993) Population differentiation in scalation of the Iberian rock lizard (Lacerta monticola). Journal of Zoology, 230 (3): 451-458. Carranza, S., Arnold, E. N., Amat, F. (2004). DNA phylogeny of Lacerta (Iberolacerta) and other lacertine lizards (Reptilia, Lacertidae). Did competition cause long-term mountain restriction?. Systematics and Biodiversity, 2 (1): 57-77. Crochet, P. A., Chaline, O., Surget-Groba, Y., Debain, C., Cheylan, M. (2004). Speciation in mountains: phylogeography and phylogeny of the rock lizards genus Iberolacerta (Reptilia: Lacertidae). Molecular Phylogenetics and Evolution, 30: 860-866. Ferchaud, A. L., Eudeline, R., Arnal, V., Cheylan, M., Pottier, G., Leblois, R., Crochet, P. A. (2015). Congruent signals of population history but radically different patterns of genetic diversity between mitochondrial and nuclear markers in a mountain lizard. Molecular Ecology, 24 (1): 192-207. Lantz, L.A. (1927). Quelques observations nouvelles sur l'herpetologie des Pyrénées centrales. Rev. hist. Nat. Appl., 8: 54-61. Lanza, B. (1963). Note erpetologiche sulla zona del Lac Bleu di Bagnères de Bigorre (Hautes-Pyrénées). Vie et Milieu, 14 (3): 629-639. Martínez-Rica, J. P. (1977). Observaciones ecológicas de Lacerta monticola bonnali, Lantz en el Pirineo español. Publicaciones del Centro Pirenaico de Biología Experimental, 8: 103-122. Mayer, W., Arribas, O. (1996). Allozyme differentiation and relationship among the Iberian-Pyrenean Mountain Lizards (Squamata: Sauria: Lacertidae). Herpetozoa, 9 (1/2): 57-61. Mayer, W., Arribas, O. (2003). Phylogenetic relationships of the European lacertid genera Archaeolacerta and Iberolacerta and their relationships to some other 'Archaeolacertae' (sensu lato) from Near East, derived from mitochondrial DNA sequences. J. Zool. Syst. Evol. Research, 41: 157-161. Mouret, V., Guillaumet, A.., Cheylan, M., Pottier, G., Ferchaud, A.-L., Crochet, P.-A. (2011). The legacy of ice ages in mountain species: post-glacial colonization of mountain tops rather than current range fragmentation determines mitochondrial genetic diversity in an endemic Pyrenean rock lizard. Journal of Biogeography, 38 (9): 1717-1731. Odierna, G., Aprea, G., Arribas, O., Capriglione, T., Olmo, E. (1996). The karyology of Iberian Rock Lizards. Herpetologica, 52: 542-550. Pérez_Mellado, V. (1998) Lacerta monticola Boulenger, 1905. Pp. 207-215. En: Salvador, A. (Coord.). Reptiles. En: Ramos, M. A. et al. (Eds.). Fauna Ibérica. Vol. 10. Museo Nacional de Ciencias Naturales, CSIC, Madrid. 705 pp. Pérez-Mellado, V., Barbadillo, L. J., Barahona, F., Brown, R. P., Corti, C., Guerrero, F., Lanza, B. (1993). A systematic survey of the Iberian Rock Lizard, Lacerta (Archaeolacerta) monticola. Pp. 85-105. En: Valakos, E., Böhme, W., Perez-Mellado, V., Maragou, P. (Eds.). Lacertids of the Mediterranean Region. Hellenic Zoological Society, Athens. Salvador, A. (1984). Lacerta monticola Boulenger, 1905 – Iberische Gebirgseidechse. Pp. 276-289. En: Böhme, W. (Ed.). Handbuch der Reptilien und Amphibien Europas. Band 2/I. Echsen (Sauria). II. Lacertidae II: Lacerta). Aula Verlag, Wiesbaden.
Oscar Arribas Fecha de publicación: 22-07-2008 Otras contribuciones: 1. Alfredo Salvador. 1-09-2015 Arribas, O. (2015). Lagartija pirenaica – Iberolacerta bonnali. En: Enciclopedia Virtual de los Vertebrados Españoles. Salvador, A., Marco, A. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
|
|
|
|
|
|
|