|
|
|
|
|
|
Para más información sobre cada apartado hacer click en:
Descargar: Pdf
|
Key words: Pond Slider, activity, home range, thermal biology.
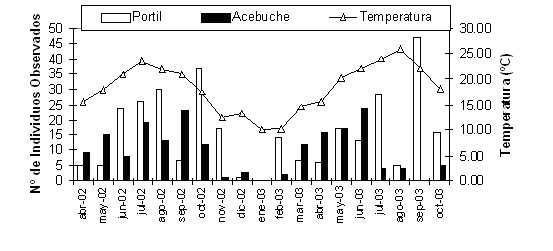
Actividad Actividad anual En España, el patrón de actividad anual de Trachemys scripta elegans se ha descrito para los individuos de poblaciones establecidas en Huelva (Pérez-Santigosa et al., 2006a). El periodo de actividad se considera a partir del mes en que se observaron individuos asoleándose. Se observaron galápagos exóticos activos entre febrero y noviembre (ambos inclusive). Por el contrario, la actividad disminuyó considerable o completamente durante los meses más fríos, no observándose ningún individuo activo en enero (Figura 1). A partir de febrero se observó un incremento progresivo de las observaciones, con un máximo a final de verano o principios de otoño. Este patrón anual es similar al descrito para esta especie en su área de distribución original, donde también se observaba la reducción de la actividad de los galápagos en los meses más fríos, mientras que estaban activos desde la primavera temprana hasta finales de otoño (Spotila et al., 1990).
Figura 1. Número total de individuos de T. s. elegans observados asoleándose a lo largo de dos años de estudio en 2002 y 2003 en dos lagunas de Huelva (El Acebuche y El Portil). Según Pérez-Santigosa et al. (2006a).
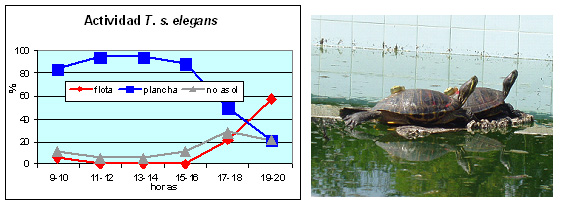
Según datos obtenidos a través de radioseguimiento de individuos en la laguna de El Portil (Huelva), se puede decir que en estas áreas invadidas, los galápagos de Florida presentan periodos cortos de hibernación discontinua (Pérez-Santigosa, 2007; Pérez-Santigosa et al., 20131), es decir, se registraron pequeños movimientos durante el periodo de inactividad, como también describen Schubauer y Parmenter (1981) y Spotila et al. (1990) en Norteamérica. En España, el periodo de inactividad invernal fue menor que el que presentaron los galápagos autóctonos del mismo área, que iniciaron su actividad en primavera (Emys orbicularis en abril y Mauremys leprosa en febrero y marzo). La escasa hibernación de T. s. elegans detectada en el sur de España, le confiere a esta especie una ventaja competitiva frente a las especies autóctonas, colonizando más temprano las áreas óptimas para búsqueda de alimento o asoleamiento, cuando los individuos de M. leprosa y E. orbicularis aún se encuentran inactivos (Pérez-Santigosa, 2007; Pérez-Santigosa et al., 2008c; Pérez-Santigosa et al., 20131). Igualmente, en Francia, Cadi y Joly (2003) observaron que individuos de T. s. elegans desplazaban a los de E. orbicularis de los mejores sitios de asoleamiento en un experimento realizado en cautividad. Estas dos especies presentaron un mismo patrón de asoleamiento prefiriendo aguas profundas y distantes de la orilla. Este desplazamiento, según estos autores, era debido a la ocupación temprana de los lugares de asoleamiento por T. s. elegans, ya que no observaron interacciones entre ellos. Actividad diaria En general, se considera que su actividad es eminentemente diurna (Gibbons et al., 1990), presentando un patrón diario de actividad unimodal en primavera y otoño, y bimodal en verano, es decir con dos picos de actividad diarios, uno por la mañana y otro por la tarde (Spotila et al., 1990). Para individuos de poblaciones españolas, Díaz-Paniagua et al. (2005) registraron observaciones de hembras adultas mantenidas en cautividad en piscinas en las que se habían colocado plataformas de corcho para que se asolearan. Las hembras habían sido capturadas en lagunas de Huelva. Estos individuos se encontraron activos a lo largo de todo el periodo de observación (de 9 h a 20h solar), presentando mayor actividad entre las 11 y 14hs (Figura 2).
Figura 2. Izquierda) Promedio del porcentaje de tiempo que pasaron 3 individuos de T. s. elegans asoleándose (sobre plancha o flotando) frente al que pasaron en actividades de no asoleamiento (nadar y hundido). Derecha) Imagen tomada en piscina con plataformas de asoleamiento (Díaz-Paniagua et al., 2005). © N. Pérez-Santigosa.
También se observó que estos individuos pasaban la mayor parte del día (entre las 9h y las 16 h solar) tomando el sol sobre las plataformas (Figura 2), disminuyendo este comportamiento por la tarde, cuando se incrementaba el denominado “flotando en superficie”. En sus áreas de origen, Auth (1975) registró los máximos picos de la actividad de asoleamiento en T. s. scripta entre las 10 y las 11 de la mañana entre agosto y septiembre, retrasándose de una a dos horas entre octubre y noviembre.
Dominio vital Las áreas de movimientos de cualquier especie acuática están limitadas por la extensión del medio acuático en el que habitan. En España, Pérez-Santigosa (2007) y Pérez-Santigosa et al. (20131) estudiaron el área utilizada por galápagos de Florida seguidos mediante transmisores en la Laguna de El Portil (Huelva). El área máxima detectada (7,56 ha), fue notablemente menor que la media detectada para las hembras de T. scripta en Carolina del Sur (EEUU) (39,75±6,1 ha, según Schubauer et al., 1990). La extensión media de sus áreas acuáticas de campeo en la laguna del Portil (Huelva) se estimó en 5,4 ha (mínimo: 2,84 ha; máximo: 7,56 ha) (Pérez-Santigosa et al., 2013)1. Los individuos de Huelva mostraron fidelidad hacia zonas concretas de la laguna donde concentraban la mayoría de sus desplazamientos. Durante el invierno, cuando los galápagos reducían considerablemente sus movimientos, se mantenían en las denominadas áreas de hibernación, de extensión media de 0,35 + 0,48 ha. Hembras de T. s. elegans, liberadas en zonas de la laguna diferentes a donde se capturaron, volvieron a su zona de captura, siendo allí donde concentraron sus movimientos (Pérez-Santigosa, 2007; Pérez-Santigosa et al., 20131). También en El Foix (Barcelona, Cataluña), se observa cierta fidelidad a una zona concreta en la población estudiada de Trachemys, donde la mayoría de los ejemplares observados se mantienen en la cola del pantano (Martínez-Silvestre et al., 2007b), pudiendo deberse a las distintas profundidades que se dan en esa zona y a las variaciones estacionales que dejan al descubierto más áreas posibles de nidificación que en otras zonas del mismo.
Biología térmica La temperatura ambiental a la cual T. scripta alcanza su mayor actividad se sitúa entre 25 y 30º C. Con respecto a la temperatura del agua, medio en el cual se encuentra, el límite inferior es de 2º C y el superior de 44,5º C (Spotila et al., 1990). Por otra parte, 41 y 41,7º C se consideran temperaturas críticas para T. scripta (Hutchison, 1992), mientras que Ernst y Lovich (2009), señalan que a temperaturas del agua inferiores a 10ºC, T. scripta está inactiva. En las localidades de Huelva donde se han establecido poblaciones reproductoras, las temperaturas registradas se encuentran dentro del umbral adecuado para el desarrollo de las actividades de T. scripta, por lo que se considera que esta especie no presenta limitaciones ni en las mínimas temperaturas detectadas en invierno, ni tampoco en las máximas que se detectaron en el interior del agua de las lagunas en verano (Pérez-Santigosa, 2007). En los individuos mantenidos en piscinas en el sur de España, se llegó a medir una temperatura máxima de 36ºC sobre el caparazón, mientras que el agua se mantenía a una temperatura aproximada de 17ºC (Díaz-Paniagua et al., 2005). En los mismos individuos, se registró posteriormente la variación de temperatura cloacal y la del caparazón a lo largo de un día. Se observó una relación significativa entre ellas presentando el caparazón a 36ºC un incremento de aproximadamente 5,5ºC sobre la cloacal (Pérez-Santigosa, 2007). Según Polo-Cavia et al. (2010a), las características morfológicas de T. s. elegans incrementan su capacidad de calentarse y enfriarse en comparación a las especies autóctonas. La forma redondeada y la relación superficie-volumen facilitan la retención del calor adquirido mediante la exposición al sol. En sus áreas originales de distribución, se han registrado diferencias en el patrón de asoleamiento o termorregulación tanto estacional como diario entre machos y hembras. Según Morreale et al. (1983) y Thomas et al. (1999), estas diferencias se deben a las estrategias reproductivas de machos y hembras: los machos presentan el pico de actividad en primavera y otoño, cuando se produce la búsqueda de hembras; y las hembras con mayor actividad en primavera-verano, durante la maduración de los huevos.
Referencias Auth, D. L. (1975). Behavioral ecology of masking in the Bellow-bellied turtle, Chrysemys scripta scripta (Schoepff). Bulletin of the Florida State Museum. Biological Sciences, 20: 1-45. Cadi, A., Joly, P. (2003). Competition for basking places between the endangered european turtle (Emys orbicularis galloitalica) and the introduced slider turtles (Trachemys scripta elegans). Canadian Journal of Zoology, 81: 1392-1398. Díaz-Paniagua, C., Pérez-Santigosa, N., Hidalgo-Vila, J., Portheault, A. (2005). Bases científicas para la elaboración de un programa de erradicación de galápagos exóticos introducidos en el medio natural. Informe Técnico no Publicado. Convenio Consejería Medio Ambiente Junta de Andalucía- CSIC. Sevilla. Ernst, C. H., Lovich. J. E. (2009). Turtles of the United States and Canada (Second edition). Johns Hopkins University Press, Baltimore. Gibbons, J. W., Greene, J. L., Congdon, J. D. (1990). Temporal and spatial movement patterns of sliders and other turtles. Pp. 201-215. En: Gibbons, J.W. (Ed.) Life History and Ecology of the Slider Turtle. Smithsonian Institution Press, Washington D. C. Hutchison, A.M. (1992). A reproducing population of Trachemys scripta elegans in southern Pinellas country, Florida. Herpetological Review, 23: 74-75. Martínez-Silvestre, A., Soler-Massana, J., Salom, M. (2007b). Essais d'elimination des tortues invasives a Catalogne (NE Spagne): Recherche biosanitaire. Pp. 63-64. En: Premier Congrès Méditerranéen d'Herpétologie (CMHI), Marrakesh, Programme and Abstract book. Morreale, S. J., Gibbons, J. W., Congdon, J. D. (1983). Significance of activity and movement in the yellow-bellied slider turtle (Pseudemys scripta). Canadian Journal of Zoology, 62: 1038-1042. Pérez-Santigosa, N. (2007). Ecología del galápago exótico, Trachemys scripta elegans, en la península Ibérica. Efectos sobre las poblaciones de Mauremys leprosa y Emys orbicularis. Tesis Doctoral. Universidad de Sevilla. Pérez-Santigosa, N., Díaz-Paniagua, C., Hidalgo-Vila, J. (2008c). Actividad y uso del espacio de Trachemys scripta elegans frente a Mauremys leprosa y Emys orbicularis. Pp. 94. En: X Congreso Luso-Español/ XIV Congreso Español de Herpetología. Coimbra, Portugal. Programme and Abstract book. Pérez-Santigosa, Díaz-Paniagua, C., Hidalgo-Vila, J., Marco, A., Andreu, A., Portheault, A. (2006a). Características de dos Poblaciones Reproductoras del Galápago de Florida, Trachemys scripta elegans, en el suroeste de España. Revista Española de Herpetología, 20: 5-16. Pérez-Santigosa, N., Hidalgo-Vila, J., Díaz-Paniagua, C. (2013). Comparing activity patterns and aquatic home range areas among exotic and native turtles in Southern Spain. Chelonian Conservation and Biology, 12 (2): 313-319. Polo-Cavia, N., López, P., Martín, J. (2010a). Competitive interactions during basking between native and invasive freshwater turtle species. Biological Invasions, 12: 2141-2152. Schubauer, J. P., Parmenter, R. R. (1981). Winter feeding by aquatic turtles in a southeastern reservoir. Journal of Herpetology, 14: 444-447. Schubauer, J. P., Gibbons, J.W., Spotila, J. R. (1990). Home range and movement patterns of slider turtles inhabiting Par Pond. Pp: 223-232. En: Gibbons, J. W. (Ed.) Life History and Ecology of the Slider Turtle. Smithsonian Institution Press, Washington D.C. Spotila, J. R., Foley, R. E., Standora, E. A. (1990). Thermoregulation and climate space of the slider turtle. Pp: 288-298. En: Gibbons, J. W. (Ed.) Life History and Ecology of the Slider Turtle. Smithsonian Institution Press, Washington D.C. Thomas, R.B., Vorgrin, N., Alting, R. (1999). Sexual and seasonal differences in behavior of Trachemys scripta (Testudines: Emydidae). Journal of Herpetology, 33: 511-515.
Albert Martínez-Silvestre1, Judit Hidalgo-Vila2, Natividad Pérez-Santigosa2, Carmen Díaz-Paniagua2 Fecha de publicación: 11-03-2011 Otras contribuciones: 1. Alfredo Salvador. 12-11-2015 Martínez-Silvestre, A., Hidalgo-Vila, J., Pérez-Santigosa, N., Díaz-Paniagua, C. (2015). Galápago de Florida – Trachemys scripta. En: Enciclopedia Virtual de los Vertebrados Españoles. Salvador, A., Marco, A. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
|
|
|
|
|
|
|