|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Para más información sobre cada apartado hacer click en:
|
Key words: Hermann's Tortoise, activity, home range, behaviour.
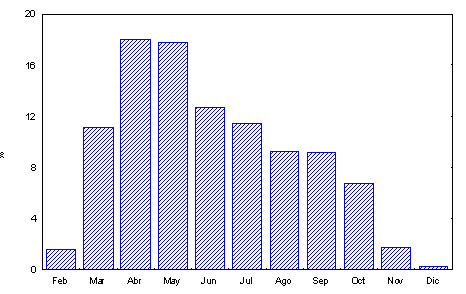
Actividad Actividad anual El período de actividad anual en la tortuga mediterránea tiene una duración variable según la región climática y la altitud en donde se encuentran las poblaciones. La extensión mínima del período de actividad se ha registrado en Rumanía (Cruce y Răducan, 1975), en donde las tortugas están activas entre 6 y 7 meses (principalmente de abril a septiembre). El período máximo de hasta 9 meses, pero mayormente concentrado entre los meses de marzo a octubre, se ha registrado en las poblaciones de las Maures (Francia; Cheylan, 1981; Stubbs y Swingland, 1985), de Toscana (Italia; Calzolai y Chelazzi, 1991), de Tirana (Albania; Haxhiu, 1995), de Córcega (Francia; Nougarède, 1998) y del delta del Ebro (Bertolero, 2002). En el delta del Ebro el patrón de actividad anual del conjunto de la población presenta un solo pico anual durante la primavera (Figura 1). Sin embargo, existen diferencias sexuales en los momentos de máxima actividad, de manera que en las hembras el pico de actividad se da en primavera y en los machos entre finales de verano y principios del otoño (Bertolero, 2002, 2010a). De manera general, el ciclo de actividad anual en el delta del Ebro se caracteriza por empezar en la segunda quincena de febrero, pero con muy baja intensidad y aprovechando los días más soleados; en marzo se produce un incremento importante de la actividad y el pico máximo se da en los meses de abril y mayo. Posteriormente, la intensidad de la actividad va disminuyendo de forma gradual entre junio y octubre, para presentar un drástico descenso en noviembre y ser mínima en diciembre y enero (Figura 1; Bertolero, 2002, 2010a). En los años muy calurosos también se observa una acusada reducción de la actividad en julio y agosto. Asimismo, si durante el verano se producen lluvias diurnas, las tortugas se muestran más activas y aprovechan para beber.
Figura 1. Actividad mensual a lo largo del ciclo anual (porcentaje respecto al total anual) para el conjunto de la población del delta del Ebro (Bertolero, 2002, 2010a).
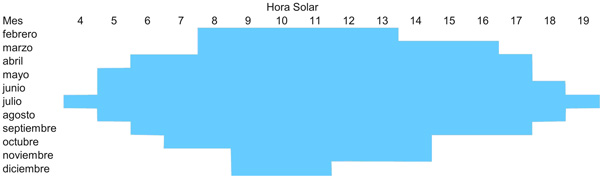
Actividad circadiana El número de horas diarias durante las cuales las tortugas están activas varía a lo largo del año según la disponibilidad térmica de cada mes, alargándose cuando aumenta la temperatura ambiente y reduciéndose si ésta disminuye. Ahora bien, durante los períodos de máximo calor la actividad diaria puede presentar un patrón bimodal, ya que durante las horas centrales del día (de más calor) la actividad se interrumpe y las tortugas se quedan escondidas en sus refugios o entre la vegetación más densa. Este número de horas de actividad diarias (o mensuales) se refiere al conjunto de la población, ya que, en general, cada individuo está activo sólo una parte de este tiempo (Huey, 1982). Además, en la tortuga mediterránea Huot-Daubremont y Grenot (1997) han demostrado que cada individuo sólo utiliza una pequeña fracción de este tiempo para desarrollar sus comportamientos activos, oscilando entre las 0,4 horas medias en noviembre y las 4,8 horas en mayo y junio. Así, aunque las tortugas disponen durante el período anual de actividad de bastantes horas favorables diarias, son capaces de satisfacer sus necesidades biológicas en una fracción muy inferior de este tiempo diario e incluso, aunque las condiciones ambientales sean favorables, pueden permanecer inactivas todo el día. Esto se debe a que se trata de organismos ectotérmicos y, por lo tanto, requieren menores tasas energéticas que un mamífero o un ave de tamaño similar (Pough, 1980). En el delta del Ebro el número de horas en que se encuentran tortugas activas es mínimo en diciembre, con una franja de tres horas comprendidas entre las 9 y las 11 de la mañana (hora solar). El máximo se alcanza en julio, con una duración de hasta 16 horas desde el alba hasta el atardecer, si bien hay un descenso de la actividad entre las 12 y 15 horas (Figura 2) (Bertolero, 2002, 201a).
Figura 2. Periodo del día en el que se encuentran tortugas activas a lo largo del ciclo anual en la población del delta del Ebro (Bertolero, 2002).
Biología térmica La tortuga mediterránea regula su temperatura corporal gracias a las pautas de comportamiento que sigue. Así, para alcanzar una temperatura óptima a partir de la cual desarrollan la mayor parte de sus actividades, las tortugas se asolean durante las primeras horas de la mañana en los meses de primavera y otoño, mientras que en verano, al ser las temperaturas ambientales más altas, pueden iniciar sus actividades con el calentamiento obtenido en sus refugios nocturnos o con un período de insolación muy corto. Durante el comportamiento de insolación las tortugas adoptan posturas típicas, ya sea subidas parcialmente en la vegetación para recibir mejor los rayos solares o tumbadas con las patas y el cuello estirados (Figura 3). Por otra parte, si su temperatura corporal sube mucho, buscan los lugares a la sombra de la vegetación o dentro de agujeros (excavados por ellas mismas o en madrigueras de otras especies) para resguardarse y disminuir su temperatura corporal.
Figura 3. Diferentes formas de soleamiento de la tortuga mediterránea. (C) A. Bertolero.
En un estudio de termorregulación realizado en el delta del Ebro a lo largo de todo un ciclo anual (Carretero et al., 1995), se encontró que las temperaturas corporales de las tortugas variaban en un rango comprendido entre los 13,4 y los 37,2ºC, siendo la temperatura media anual de los machos de 27,6ºC, la de las hembras de 24,9ºC y la de los juveniles de 28,6ºC. Las hembras alcanzaron menores temperaturas corporales, a pesar de encontrarse en un mismo ambiente térmico. Por otra parte, la temperatura corporal dependió en mayor medida de la temperatura del aire (especie helioterma) que de la del substrato. También se observó que entre los 15 y los 30ºC de temperatura de substrato las tortugas son termoconformistas, mientras que a mayor temperatura termorregulan (su temperatura corporal es menor que la del substrato).
Dominio vital El tamaño de los dominios vitales de la tortuga mediterránea ha sido estudiado con cierto detalle por diversos autores a lo largo de su distribución (Hailey, 1989; Swingland et al., 1986; Calzolai y Chelazzi, 1991; Nougarède, 1998; Longepierre et al., 2001), pero en las poblaciones españolas solo ha sido abordado en el delta del Ebro (Bertolero, 2002). Por otra parte, con la excepción de Swingland et al. (1986), cuyos resultados se basan en muestras con más de 20 ejemplares, el resto de trabajos se han realizado con un máximo de 14 tortugas (Hailey, 1989; Calzolai y Chelazzi, 1991; Nougarède, 1998; Bertolero, 2002) o durante períodos bastante cortos, de uno a tres meses (Hailey, 1989; Longepierre et al., 2001). Los resultados obtenidos por los diferentes autores se sintetizan en la tabla 1, pero hay que señalar que las comparaciones se deben hacer con cautela, ya que según el método utilizado para estimar el tamaño del dominio vital, este está correlacionado con el número de localizaciones utilizadas (a mayor número de localizaciones, mayor es la superficie del dominio vital; p.ej. ver Swingland et al., 1986). Teniendo en cuenta esta consideración, se observa que en la mayor parte de poblaciones las hembras presentan dominios vitales mayores que los machos, menos en el delta del Ebro en que es al contrario. Se ha interpretado que esta mayor área en los dominios vitales de las hembras se podría deber a la necesidad de las hembras de realizar desplazamientos hacia las zonas favorables para las puestas. Sin embargo, tres de estas poblaciones ocupan hábitats dunares (Aliky, zona del lago Burano en Toscana y delta del Ebro), por lo que no parece que sea necesario que las hembras realicen grandes desplazamientos para encontrar sitios favorables de nidificación. El radioseguimiento de 13 adultos (6 machos y 7 hembras) en Albera no mostró diferencias significativas entre sexos en el tamaño del dominio vital, siendo 2.01 ha de tamaño medio según el método del 95% Kernel, y 3.01 ha según el método del polígono convexo mínimo (Vilardell-Bartino et al., 2015)1.
Tabla 1. Superficie de los dominios vitales (ha) para diferentes poblaciones de tortuga mediterránea de Francia (FR), Italia (IT), España (ES), Grecia (GR) y Rumanía (RU). (a) Dominios vitales semanales. MCP: mínimo polígono convexo.
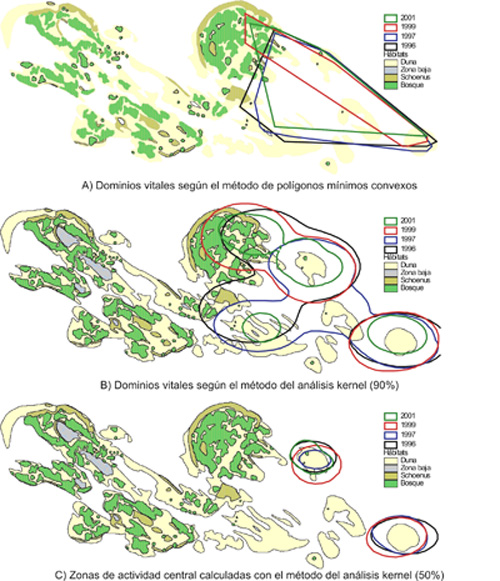
En el delta del Ebro, en donde se ha realizado un seguimiento a largo plazo, se ha observado que las tortugas ocupan las mismas áreas a lo largo de los años, estimándose que el porcentaje medio de solapamiento intraindividual entre años consecutivos es del 66% (Figura 4; Bertolero, 2002). Sin embargo, también se ha observado en algunas ocasiones que hay hembras adultas que, después de ocupar de manera regular una misma zona, la abandonan y establecen un nuevo dominio vital en zonas alejadas de la primera. Por otra parte, el dominio vital de los juveniles es más pequeño que el de los adultos y se ha detectado que tiende a aumentar con la edad de las tortugas (Bertolero, 2002, 2010a).
Figura 4. Ejemplo de dominio vital de una hembra adulta durante cuatro años para la población del delta del Ebro (Bertolero, 2002). El método de estimación por mínimo polígono convexo es el más sencillo (a), pero el método kernel (b y c) ofrece una mejor idea de la utilización del espacio y define las áreas que son usadas más intensamente a lo largo de cada ciclo anual. En este caso (c), la hembra usó las mismas dos pequeñas dunas de manera más intensa durante los cuatro años en que se obtuvieron suficientes observaciones.
Patrón social y comportamiento Los comportamientos inactivos, como son estar quieta o durmiendo, representan entre el 60% y 70% de las observaciones realizadas en ejemplares radioseguidos en el delta del Ebro, mientras que entre el 30% y 40% corresponden de comportamientos activos (Bertolero, 2002). Entre los comportamientos activos, el más frecuente es el de locomoción, seguido en orden de importancia de los de insolación, de alimentación y de los comportamientos relacionados con la reproducción (intentos de cópulas, combates entre machos o nidificación).
Referencias Bertolero, A. (2002). Biología de la tortuga mediterránea Testudohermanni aplicada a su conservación. Tesis doctoral. Universidad de Barcelona, Barcelona. Bertolero, A. (2010a). Tortuga mediterránea Testudo hermanni. En: Enciclopedia Virtual de los Vertebrados Españoles. Salvador, A. y Marco, A. (Eds.). Museo Nacional de Ciencias Naturales. Madrid. http://www.vertebrados ibericos.org/ Bossuto, P., Giacoma, C., Rolando, A., Balletto, E. (2000). Caratteristiche delle aree familiari in una popolazione di Testudo hermanni Gmelin del Parco Naturale della Maremma (GR). Proceedings of the first National Congress of the Societas Herpetologica Italica, Turin, 1996: 543-551. Calzolai, R., Chelazzi, G. (1991). Habitat use in a central Italy population of Testudo hermanni Gmelin (Reptilia Testudinidae). Ethol. Ecol. Evol., 3: 153-166. Carretero, M. A., Bertolero, A., Llorente, G. A. (1995). Termal ecology of a population of Testudo hermanni in the Ebro Delta (NE Spain). Pp. 208-212. En: Llorente, G. A., Montori, A., Santos, X., Carretero, M. A. (Eds.). Scientia Herpetologica. Barcelona. Casamitjana, M., Loaiza, J. C., Simon, N., Frigola, P. (2012). Aspectos ecológicos y efectos del manejo forestal en una población de tortuga mediterránea (Testudo hermanni hermanni) en Cataluña (España). Basic and Applied Herpetology, 26: 73-86. Cheylan, M. (1981). Biologie et écologie de la tortue d’Hermann Testudo hermanni Gmelin 1789. Contribution de l’espèce a la connaissance des climats quaternaires de la France. Mémoires et Travaux de l’Institut de Montpellier (E.P.H.E.), vol 13, Montpellier. Cruce, M., Răducan, I. (1975). Cycle d’activité chez la tortue terrestre (Testudo hermanni hermanni Gmel.). Rev. Roum. Biol. Serie Biol. Anim., 20: 285-289. Hailey, A. (1989). How far do animals move? Routine movements in a tortoise. Can. J. Zool., 67: 208-215. Haxhiu, I. (1995). Results of studies on the chelonians of Albania. Chelonian Conserv. Biol., 1: 324-326. Huey, R.B. (1982). Temperature, physiology, and the ecology of reptiles. Pp. 24-91. En: Gans, C., Pough, F. H. (Eds.). Biology of the Reptilia vol 12, Physiology C. Academic Press. London. Huot-Daubremont, C., Grenot, C. (1997). Rythme d'activité de la tortue d'Hermann (Testudo hermanni hermanni) en semi-liberté dans le massif des Maures (Var). Rev. Ecol. (Terre Vie), 52: 331-344. Longepierre, S; Hailey, A., Grenot, C. (2001). Home range area in the tortoise Testudo hermanni in relation to habitat complexity: implications for conservation of biodiversity. Biodiv. Conserv. 10: 1131-1140. Loy, A., Cianfrani, C. (2010). The ecology of Eurotestudo h. hermanni in a mesic area of southern Italy. First evidences of sperm storage. Ecology, Ethology & Evolution, 22 (1): 1-16. Mazzotti, S., Pisapia, A., Fasola, M. (2002). Activity and home range of Testudo hermanni in Northern Italy. Amphibia-Reptilia, 23 (3): 305-312. Nougarède, J.-P. (1998). Principaux traits d'histoire naturelle d'une population de tortue d'Hermann (Testudo hermanni) dans le sud de la Corse. Diplôme de l'Ecole Pratique des Hautes Etudes, Montpellier. Pough, F.H. (1980). The advantatges of ectothermy for tetrapods. Am. Nat., 115: 92-112. Rozylowicz, L., Popescu, V. D. (2013). Habitat selection and movement ecology of eastern Hermann’s tortoises in a rural Romanian landscape. European Journal of Wildlife Research, 59 (1): 47-55. Stubbs, D., Swingland, I. R. (1985). The ecology of a Mediterranean tortoise (Testudo hermanni): a declining population. Can. J. Zool., 63: 169-180. Swingland, I. R., Stubbs, D., Newdick, M., Worton, B. (1986). Movement patterns in Testudo hermanni and implications for management. Pp. 573-578. En: Rocek, Z. (Ed.). Studies in Herpetology, Proc. of the Europ. Herp. Meeting Prague. Vilardell-Bartino, A., Capalleras, X., Budo, J., Bosch, R., Pons, P. (2015). Knowledge of habitat preferences applied to habitat management: the case of an endangered tortoise population. Amphibia-Reptilia, 36 (1): 13-25.
Albert Bertolero Fecha de publicación: 16-03-2010 Otras contribuciones. 1. Alfredo Salvador. 9-11-2015 Bertolero, A. (2015). Tortuga mediterránea – Testudo hermanni. En: Enciclopedia Virtual de los Vertebrados Españoles. Salvador, A., Marco, A. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||