|
|
|
|
|
|
Para más información sobre cada apartado hacer click en:
|
Key words: sea lamprey, adult, larva, sexual dimorphism, description, variation
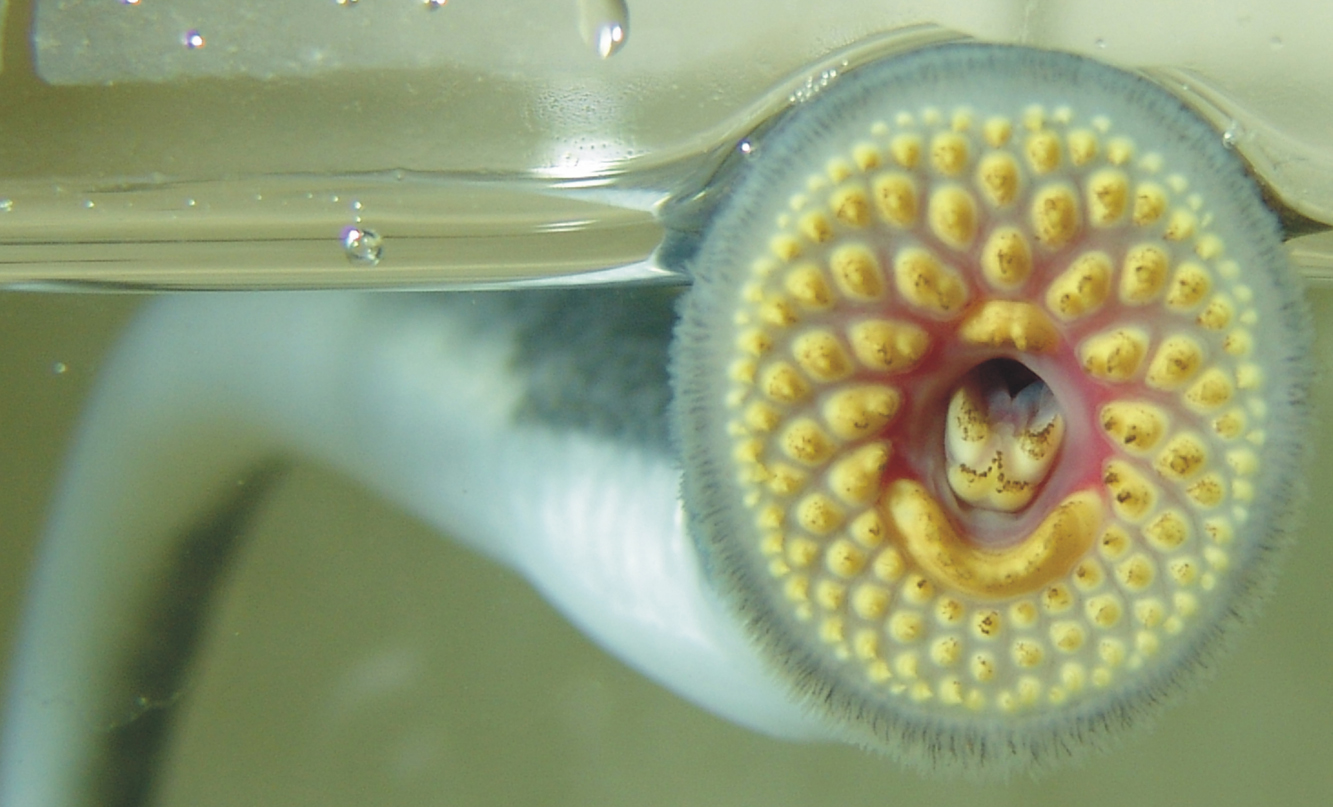
IdentificaciónLos individuos juveniles y adultos de la especie son fácilmente identificables por su embudo bucal, dotado de un gran número de dentículos (próximo a la centena; Figura 1). Durante la fase larvaria esta especie se diferencia de otras similares por caracteres morfológicos y merísticos (número de miómeros del tronco) (Gardiner, 2003; Renaud, 2011). Así, en P. marinus toda la capucha oral esta pigmentada. En las demás especies de lampreas presentes en la península ibérica, incluidas dentro del género Lampetra, la zona pigmentada no se extiende hasta el borde del labio superior. En P. marinus también existe una mayor pigmentación de las aletas. Por último, en P. marinus el número de miómeros del tronco (67-74) es mayor que en las especies del género Lampetra (Renaud, 2011; Mateus et al., 2013).
Figura 1. Embudo bucal de un individuo postmetamórfico de P. marinus. MorfologíaLas lampreas se caracterizan por su cuerpo anguiliforme, la presencia de siete pares de orificios branquiales, un orificio nasal impar y por la ausencia de aletas pares, mandíbulas y escamas. Petromyzon marinus es la especie de lamprea de mayor tamaño. En la península ibérica el tamaño medio de los individuos adultos suele oscilar entre los 80-90 cm de longitud total y los 1050-1400 g de peso (Cobo et al., 2012, 2013; Araújo et al., 2016). La coloración varía a lo largo del ciclo vital, de manera que las larvas, también llamadas ammocetes (del latín ammocoete?s, literalmente: que yace en la arena, del griego ammos arena + koit? cama, de keisthai yacer), presentan un color marrón oscuro en el dorso, que se torna más pálido en la zona ventral, mientras que los individuos recién transformados son de color azul metálico, también con un tono más oscuro en el dorso que se desvanece de forma gradual hacia la región ventral, de color blanco. Con el avance de la fase postmetamórfica se pierde el característico brillo metálico y se adquiere un tono más oscuro y un patrón moteado que se extiende por todo el cuerpo, a excepción del vientre. Esta es la coloración característica de la fase marina de P. marinus. Con la vuelta a los ríos y con el desarrollo de la maduración sexual el color cambia a un marrón verdoso que aún mantiene el patrón moteado (Figura 2). Las dos aletas dorsales se encuentran perfectamente separadas en los ejemplares juveniles, mientras que tienden a fusionarse durante la maduración sexual. En el adulto también destaca su embudo bucal, desprovisto de mandíbulas y dotado de un gran número de dentículos, que no aparece en la larva debido a su tipo de alimentación microfágica filtradora. Otra diferencia entre larvas y adultos es la ausencia de ojos diferenciados en la fase larvaria (Figura 2). Los cambios externos asociados a la metamorfosis empiezan en el mes de junio y se completan en otoño, entre los meses de octubre y noviembre (Cobo et al., 2012, 2013; Silva et al., 2016a). Estos cambios adaptan al individuo al nuevo hábitat y modo de vida, pasando de un modo de vida sedentario en bancos de arena del río y con alimentación filtradora a un modo de vida pelágico en el mar y con alimentación hematófaga.
Figura 2. Ammocete y larvas en metamorfosis (superior izquierda), individuo postmetamórfico (superior derecha) y adultos (inferiores) de P. marinus. Dimorfismo sexualNo existe un dimorfismo sexual claro hasta el retorno de los individuos al río para reproducirse, después del cese de la alimentación hematófaga. Las diferencias aumentan a medida que avanza la maduración sexual, que está íntimamente relacionada con el tiempo de estancia en el río. De esta manera los machos maduros se caracterizan por un marcado engrosamiento medio dorsal con forma de cuerda y por la proyección de la papila urogenital, mientras que las hembras desarrollan una pseudoaleta entre el ano y la aleta caudal (Figura 3). Figura 3. Reproductores de P. marinus en el río Tambre durante la construcción del nido (izquierda; nótese el marcado cordón dorsal del macho) y detalle de la pseudoaleta anal de la hembra postreproductora junto con algunos huevos adheridos a su cuerpo (derecha). Variación geográficaLa elevada dispersión durante la fase hematófaga (Silva et al., 2014) y la ausencia de filopatria (Waldman et al., 2008) hacen que no se aprecien diferencias significativas desde el punto de vista genético entre lampreas procedentes de diferentes ríos de la península ibérica o de toda Europa (Almada et al., 2008). Sin embargo, recientes estudios basados en caracteres morfométricos y perfiles de ácidos grasos cardíacos sugieren la existencia de diferentes stocks en la península ibérica (Lança et al., 2014). Por otro lado existe un gradiente latitudinal de tamaño, con individuos de mayor tamaño en el norte de Europa (Beaulaton et al., 2008; Cobo et al., 2010). ReferenciasAlmada, V. C., Pereira, A. M., Robalo, J. I., Fonseca, J. P., Levy, A., Maia, C., Valente, A. (2008). Mitochondrial DNA fails to reveal genetic structure in sea-lampreys along European shores. Molecular Phylogenetics and Evolution, 46: 391-396. Araújo, M. J., Silva, S., Stratoudakis, Y., Gonçalves, M., Lopez, R., Carneiro, M., Martins, R., Cobo, F., Antunes, C. (2016). Sea lamprey fisheries in the Iberian Peninsula. Pp. 115-148. En: Jawless Fishes of the World, Volume 2. Orlov A., Beamish, R. (Eds.). Cambridge Scholars Publishing: Newcastle upon Tyne, UK. Beaulaton, L., Taverny, C., Castelnaud, G. (2008). Fishing, abundance and life history traits of the anadromous sea lamprey (Petromyzon marinus) in Europe. Fisheries Research, 92: 90-101. Cobo, F., Silva, S., Vieira-Lanero, R., Servia, M. J., Sánchez-Hernández, J., Barca, S., Rivas, S., Couto, M., Gómez, P., Nachón, D., Morquecho, C., Lago, L., Cobo, M. C. (2010). Estado de conservación das poboacións de lamprea mariña en ríos de Galicia. Xunta de Galicia, Consellería do Medio Rural. 124 pp. Cobo, F., Sánchez, J., Vieira-Lanero, R., Servia, M. J., Silva, S., Nachón, D., Barca, S., Gómez, P., Morquecho, C., Lago, L., Couto, M. T., Rivas, S., Cobo, M. C. (2012). Documento Marco de Gestión y Conservación de las Especies de Peces Migradores del Espacio SUDOE. Ríos de Galicia. Fundación Centro de Estudos Eurorrexionais Galicia-Norte de Portugal, Santiago de Compostela 110 pp. Cobo, F., Sánchez-Hernández, J., Vieira-Lanero, R., Servia, M. J., Silva, S., Nachón, D., Barca-Bravo, S., Gómez-Sande, P., Morquecho, C., Lago-Meijide, L., Couto-Mendoza, M. T., Rivas-Rodríguez, S., Cobo, M. C. (2013). O río animado. Biodiversidade dos ecosistemas acuáticos continentais galegos (2ª edición). Editorial: Fernando Cobo, Rufino Vieira (Eds.), Santiago de Compostela. 84 pp. Gardiner, R. (2003). Identifying Lamprey: A Field Key for Sea, River and Brook Lamprey: Petromyzon marinus, Lampetra fluviatilis and L. planeri. Conserving Natura 2000 Rivers Conservation Techniques Series No. 4. English Nature, Peterborough. Lança, M. J., Machado, M., Mateus, C. S., Lourenço, M., Ferreira, A. F., Quintella, B. R., Almeida, P. R. (2014). Investigating population structure of sea lamprey (Petromyzon marinus, L.) in western Iberian Peninsula using morphological characters and heart fatty acid signature analyses. PLoS One, 9(9): e108110. Mateus, C., Alves, J., Quintella, B., Almeida, P. R. (2013). Three new cryptic species of the lamprey genus Lampetra Bonnaterre, 1788 (Petromyzontiformes: Petromyzontidae) from the Iberian Peninsula. Contributions to Zoology, 82 (1): 37-53 Renaud, C. B. (2011). Lampreys of the world. An annotated and illustrated catalogue of lamprey species known to date. Food and Agriculture Organization of the United Nations. 109 pp. Silva, S., Araújo, M. J., Bao, M., Mucientes, G., Cobo, F. (2014). The haematophagous feeding stage of anadromous populations of sea lamprey Petromyzon marinus: low host selectivity and wide range of habitats. Hydrobiologia, 734 (1): 187-199. Silva, S., Barca, S., Cobo, F. (2016a). Advances in the study of sea lamprey Petromyzon marinus Linnaeus, 1758, in the NW of the Iberian Peninsula. Pp. 346-385. En: Jawless Fishes of the World, Volume 1. Orlov A., Beamish, R. (Eds.). Cambridge Scholars Publishing: Newcastle upon Tyne, UK. Waldman, J., Grunwald, C., Wirgin, I. (2008). Sea lamprey Petromyzon marinus: an exception to the rule of homing in anadromous fishes. Biology letters, 4 (6): 659-662.
Sergio Silva, Sandra Barca, Rufino Vieira-Lanero, Fernando Cobo Fecha de publicación: 13-05-2019 Silva, S., Barca, S., Vieira-Lanero, R., Cobo, F. (2019). Lamprea marina – Petromyzon marinus. En: Enciclopedia Virtual de los Vertebrados Españoles. López, P., Martín, J., Cobo, F. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
|
|
|
|
|
|
|