|
Para más información sobre cada apartado hacer click en:
Portada
Identificación
Estatus
de conservación
Distribución
Hábitat
Ecología
trófica
Biología
de la reproducción
Interacciones
entre especies
Comportamiento
Bibliografía
|
Key words: bottlenose dolphin, diet, foraging mode.
Ecología trófica
En general se tiende a considerar al delfín mular como un depredador oportunista que consume mayoritariamente peces demersales (Barros y Odell, 1990; Gannier, 1995), aunque también puede consumir peces pelágicos, demerso-pelágicos y otros tipos de presas como cefalópodos y otros moluscos, crustáceos o anélidos poliquetos (Santos et al., 2007). En cuanto a los peces que consume, varían enormemente a lo largo y ancho de su área de distribución, aunque todos los estudios al respecto coinciden en la gran variedad de especies consumidas. No obstante, en la mayor parte de estudios sobre la alimentación del delfín mular, las presas principales son aquellas especies de peces más abundantes en la región (Blanco et al., 2001; Santos et al., 2007; Fernández et al., 2011).
Parecen mostrar preferencia por especies de las familias Sciaenidae, Scombridae y Mugillidae. Muchas de sus presas provienen del fondo marino y consumen a menudo especies de peces que producen sonidos, presumiblemente por su mayor facilidad de ecolocalización (Wells y Scott, 2018).
La dieta del delfín mular varía enormemente no sólo a nivel geográfico (Santos et al., 2007) sino que también puede variar entre ecotipos. Así, en algunos estudios llevados a cabo en el Atlántico noreste no se han encontrado evidencias de diferencias sustanciales en la dieta de ecotipos pelágicos y costeros (Louis et al., 2014), mientras que sí ha podido constatarse en otros casos como el Golfo de Vizcaya (Spitz et al., 2006) o Galicia (Fernández et al., 2011).
Respecto a la variabilidad geográfica en la selección de presas, hay que destacar que la bacaladilla (Micromesistius poutassou) y la merluza (Merluccius merluccius) constituyen las presas principales en Galicia (Santos et al., 2007) así como en Asturias (Arronte et al., 2009). La merluza también resulta una presa dominante entre los delfines mulares del Mediterráneo (Blanco et al., 2001) y del Golfo de Cádiz (Giménez et al., 2017) aunque no es así en otras partes del mundo (van Waerebeek et al., 1990). Respecto a la bacaladilla, es mucho menos relevante para los delfines del Estrecho de Gibraltar (Giménez et al., 2017) y está aparentemente ausente en la dieta de aquellos del Mediterráneo (Blanco et al., 2001) a pesar de encontrarse presente en dichas aguas (Froese y Pauly, 2018).
Las presas principales en diferentes puntos de la Península Ibérica se muestran en la Figura 1 y el porcentaje de ocurrencia en la Tabla 1.
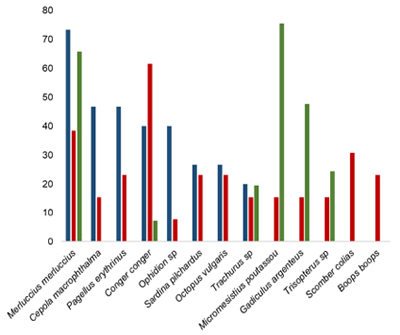
Figura 1. Porcentaje de ocurrencia de especies presa en tres regiones ibéricas. Azul: Costa mediterránea (Blanco et al., 2001). Rojo: Golfo de Cádiz (Giménez et al., 2017). Verde: Galicia (Santos et al., 2007).
Tabla 1. % ocurrencia de diferentes especies o grupos de presas en tres regiones ibéricas.
| Presa |
Costa mediterránea española |
Golfo de Cádiz |
Galicia |
| n= 16 |
n= 13 |
n= 82 |
| Blanco et al., 2001 |
Giménez et al., 2017 |
Santos et al., 2007 |
| Argentina sp. |
Argentinas |
|
|
3,7 |
| Spicara maena |
Chucla |
|
7,69 |
|
| Conger conger |
Congrio |
40 |
61,54 |
7,3 |
| Macrorhamphosus sp. |
Trompeteros |
|
7,69 |
4,9 |
| Trachyrincus scabrus |
Pez rata |
|
|
1,2 |
| Micromesistius poutassou |
Bacaladilla |
|
15,38 |
75,6 |
| Trisopterus sp. |
Fanecas |
|
15,38 |
24,4 |
| Gadiculus argenteus |
Faneca plateada |
|
15,38 |
47,6 |
| Plectorhinchus mediterraneus |
Burro |
|
7,69 |
|
| Merluccius merluccius |
Merluza |
73,3 |
38,46 |
65,8 |
| Beryx decadactylus |
Palometa roja |
|
|
1,2 |
| Trachurus sp. |
Jureles |
20 |
15,38 |
19,5 |
| Mugil sp. |
Mújoles |
|
7,69 |
12,2 |
| Liza sp. |
Lisas |
|
15,38 |
|
| Aphanopus carbo |
Sable negro |
|
7,69 |
1,2 |
| Scomber scombrus |
Caballa o verdel |
|
|
6,1 |
| Scomber colias |
Estornino |
|
30,77 |
|
| Citharus linguatula |
Pelua |
|
15,38 |
|
| Atherina presbyter |
Abichón |
|
|
6,1 |
| Callionymus maculatus |
Lagarto |
|
|
1.2 |
| Cepola macrophthalma (sinónimo Cepola rubescens) |
Cinta |
46,7 |
15,38 |
|
| Ophidion sp. |
Brótulas |
40 |
7,69 |
|
| Argyrosomus regius |
Perca regia o corvina |
|
15,38 |
|
| Helicolenus dactylopterus |
Gallineta o cabrilla |
|
7,69 |
|
| Serranus hepatus |
Cherna o afanecada |
|
7,69 |
|
| Pagellus erythrinus |
Breca |
46,7 |
23.08 |
|
| Pagellus acarne |
Aligote |
|
15,38 |
|
| Diplodus sp. |
Sargos |
|
7,69 |
|
| Dentex maroccanus |
Sama marroquí |
|
7,69 |
|
| Dentex sp. |
Dentones o samas |
|
15,38 |
|
| Boops boops |
Boga |
|
23,08 |
|
| Phycis blennoides |
Brótola del fango |
20 |
|
|
| Sardina pilchardus |
Sardina europea |
26,7 |
23,08 |
|
| Engraulis encrasicolus |
Boquerón o anchoa |
13,3 |
7,69 |
|
| Solea senegalensis |
Lenguado senegalés |
|
7,69 |
|
| Solea solea |
Lenguado común |
|
7,69 |
|
| Clupeidae |
|
|
|
4,9 |
| Bothidae |
|
|
7,69 |
|
| Sparidae |
|
|
|
8,5 |
| Ammodytidae |
|
|
|
7,3 |
| Gobiidae |
|
|
|
11 |
| Zoarcidae |
|
|
|
1,2 |
| Triglidae |
|
|
7,69 |
|
| Octopus vulgaris |
Pulpo de roca |
26,7 |
23,08 |
|
| Eledone sp. |
Pulpos |
13,3 |
15,38 |
9,8 |
| Sepiolidae |
|
6,7 |
|
6,1 |
| Sepia elegans |
Choco o castaño |
6.7 |
|
|
| Loligo vulgaris |
Calamar |
13,3 |
7,69 |
|
| Todarodes sagittatus |
Pota europea |
20 |
|
4,9 |
| Todaropsis eblanae |
Calamar volador menor |
6,7 |
|
|
| Rondeletiola minor |
Calamar de cola corta |
6,7 |
|
|
| Chiroteuthis sp. |
Calamares chiroteútidos |
|
|
3,7 |
| Otros molúscos |
|
|
|
7,3 |
| Crustacea |
|
13,3 |
23,08 |
24,4 |
| Poliquetos |
|
|
|
2,4 |
Aunque los peces, ya sean bacaladillas (Micromesistius poutassou), merluzas (Merluccius merluccius) o congrios (Conger conger), constituyan las presas principales del delfín mular, los cefalópodos como hemos visto también se encuentran presentes en su dieta en mayor o menor medida. Un estudio de los contenidos digestivos de los delfines mulares en Galicia mostró que el 57,14% contenían solo peces, el 7,14% solo cefalópodos, el 28,57% peces y cefalópodos y el 7,14% el estómago vacío (n= 14) (González et al., 1994). Las especies de cefalópodos identificadas en los estómagos de los delfines mulares del citado estudio fueron las presentes en la Tabla 2.
Tabla 2. Cefalópodos presentes en el estómago de delfines mulares varados en Galicia (González et al., 1994).
Especie |
Masa total estimada (g) |
% |
Todarodes sagittatus |
76 |
11,3 |
Illex coindentii |
144 |
21,5 |
Eledone cirrhosa |
450 |
67,2 |
La pota europea (Todarodes sagittatus) también parece la especie de cefalópodo más común entre las presas del delfín mular en aguas de Asturias (Arronte et al., 2009), así como la segunda más frecuente tras el pulpo de roca (Octopus vulgaris) en la costa mediterránea española (Blanco et al., 2001). También en Asturias la prevalencia de peces (96,6%) en la dieta del delfín mular resulta sustancialmente mayor que la de cefalópodos (3,4%) (Arronte et al., 2009).
No hay estudios detallados acerca de la dieta del delfín mular en aguas de Canarias, aunque el análisis estomacal de un ejemplar varado en Tenerife en 1996 llevado a cabo por Fernández et al. (2009) reveló el consumo tanto de peces como de cefalópodos. Entre los diversos restos de peces pudo identificarse la presencia de agujas (Belone belone) mientras que todos los cefalópodos hallados fueron sepias (Sepia sp.). También se encontró la concha de un ejemplar de molusco escafópodo perteneciente al género Dentalium.
Estrategias alimentarias
La captura de las presas puede llevarse a cabo de forma individual o bien cooperativa (Shane et al., 1986), con gran actividad de ecolocación, con vocalizaciones que van de los 40 a los 130 Hz (Wang et al., 2014). Aunque las inmersiones en busca de presas suelen tener una profundidad de entre 10 y 50 m (Hastie et al., 2006), existen diferencias entre poblaciones.
Los delfines mulares oceánicos pueden sumergirse hasta 1000 m con inmersiones de hasta 13 min (Wells y Scott, 2018). Un estudio realizado en aguas de Bermuda mostró que durante el día el 96% de las inmersiones no superaban los 50 m de profundidad y la duración era menor de 1 min en el 52,7% de los casos. En cambio, durante la noche el 8,9% de las inmersiones superaba los 450 m de profundidad y la duración era mayor de 5 min en el 46,4% de los casos. Este patrón de búsquedas de presas está relacionado con las migraciones verticales nocturnas de las presas mesopelágicas (Klatsky et al., 2007). Las poblaciones litorales realizan inmersiones de menor duración (generalmente salen a superficie cada 30 s) (Wang et al., 2014).
Los delfines mulares comunes de áreas litorales muestran una extensa variedad de estrategias alimentarias en grupo (Shane et al., 1986). Para ello suelen emplear diferentes técnicas como persecución a gran velocidad, la producción de burbujas para forzar el ascenso de las presas a superficie o el aturdimiento de las mismas mediante saltos o golpes con la aleta caudal (Wang et al., 2014), así como excavar en el fondo (Nowacek, 2002), remover y levantar el sedimento (Lewis y Schroeder, 2003), golpear con la cola praderas de algas para provocar la salida de las presas (Nowacek, 2002) o incluso varar voluntariamente en la playa para capturar a sus presas (Sargeant et al., 2005).
Esta especie además ha sido capaz de adaptarse a la actividad humana, no sólo siguiendo los barcos pesqueros para alimentarse de los descartes (Chilvers y Corkeron, 2001) o sustraer presas de diferentes artes de pesca (Brotons et al., 2008), sino también frecuentando las jaulas flotantes de maricultura (Díaz y Bernal, 2006), e incluso trabajando cooperativamente con pescadores (Pryor et al., 1990; Simões-Lopes et al., 1998).
-Se observan diferentes técnicas de caza, como las descritas en torno a piscinas de acuicultura marina en el Mediterráneo (Díaz, 2006):
- Cerco (Encircling cage) individual: un solo delfín nada por debajo de un grupo de peces cerca de la pared exterior y súbitamente se mueve hacia la superficie, obligando a los peces a subir y en ocasiones a saltar fuera del agua.
- Cerco (Encircling cage) cooperativo: uno o más delfines dirigen a un banco de peces hacia otros delfines, cerrándoles el paso.
- Estampida (Feeding rush) (Shane, 1990): varios delfines escalonados verticalmente nadan precipitadamente hacia los grupos de peces que hay junto a la red de la piscifactoría. Justo antes de llegar a la pared, frenan de forma súbita y capturan los peces desorientados que han quedado atrapados entre los delfines y la red.
- Natación en carrusel (Carousel swim) (Bel'kovich et al., 1991): un grupo de delfines nada en círculos en torno a un banco de peces, obligándolos a concentrarse cada vez más. Por turnos, los delfines van atacando al grupo de peces mientras el resto continúa nadando en círculos a su alrededor.
-Técnicas descritas en la bahía de Florida (Torres y Read, 2009):
- Inmersiones profundas (Deep Diving), en las que los delfines sacan la caudal al sumergirse para lograr verticalidad y ascienden de forma muy rápida, sorprendiendo a los peces.
- Herd and chase, técnica mediante la cual un grupo de delfines persigue a un grupo de peces contra alguna superficie que les impide continuar como un banco de arena, algas o alguna construcción humana.
- Alimentación con anillos de barro (Mud ring feeding): técnica usada en aguas poco profundas con fondos lodosos. Un ejemplar nada formando un círculo en torno a un grupo de peces, golpeando el fondo con la aleta caudal de modo que el lodo se levanta y crea un anillo de barro. Los delfines esperan alrededor del anillo a que los peces comiencen a saltar para capturarlos en el aire.
Referencias
Arronte, J. C., Valdés, P., Pérez, C. (2009). Diet of the bottlenose dolphin (Tursiops truncatus) in the central Cantabrian Sea. 23rd Annual Conference of the European Cetacean Society. Istanbul, Turkey.
Barros, N. B., Odell, D. K. (1990) Food habits of bottlenose dolphins in the southeastern United States. Pp. 309-328. En: Leatherwood, S., Reeves, R. R. (Eds.) The bottlenose dolphin. Academic Press, San Diego.
Blanco, C., Salomón, O., Raga, J. A. (2001). Diet of the bottlenose dolphin (Tursiops truncatus) in the western Mediterranean Sea. J. Mar. Biolog. Assoc. UK, 81: 1053-1058.
Brotons, J. M., Grau, A., Rendell, L. (2008). Estimating the impact of interactions between bottlenose dolphins and artisanal fisheries around the Balearic Islands. Mar. Mamm. Sci., 24 (1): 112-127.
Chilvers, B. L., Corkeron, P. J. (2001). Trawling and bottlenose dolphins' social structure. Proc. R. Soc. Lond. B Biol. Sci. 268: 1901-1905.
Díaz, B. (2006). Bottlenose Dolphin (Tursiops truncatus) predation on a marine Fin Fish farm: some underwater observations. Aquat. Mamm., 3 (3): 305-310.
Díaz, B., Bernal, J. A. (2006). Estudio multiescalar de la influencia de la acuicultura en la presencia de Delfines mulares Tursiops truncatus (Montagu, 1821). Pp. 282-290. En: IV Congreso Iberoamericano Virtual de Acuicultura.
Fernández, R., Santos, M. B., Carrillo, M., Tejedor, M., Pierce, G. J. (2009). Stomach contents of cetaceans stranded in the Canary Islands 1996–2006. J. Mar. Biolog. Assoc. UK, 89 (5): 873-883.
Fernández, R., Santos, M. B., Pierce, G. J., Llavona, A., López, A., Silva, M. A., Ferreira, M., Carrillo, M., Cermeño, P., Lens, S., Piertney, S. B. (2011). Fine-scale genetic structure of bottlenose dolphins, Tursiops truncatus, in Atlantic coastal waters of the Iberian Peninsula. Hydrobiologia, 670: 111-115.
Froese R., Pauly D. (2018). FishBase. En: Roskov, Y., Orrell, T., Nicolson, D., Bailly, N., Kirk, P. M., Bourgoin, T., DeWalt, R. E., Decock, W., e Wever, A. de, Nieukerken, E. Van, Zarucchi J., Penev, L. (Eds.) Species 2000 & ITIS Catalogue of Life. Species 2000: Naturalis, Leiden.
Gannier, A. (1995). Les cétacés de Méditerranée nord-occidentale: estimation de leur abondance et mise en relation de la variation saisonnière de leur distribution avec l'écologie du milieu. Tesis. Ecole Pratique des Hautes Etudes, Montpellier.
Giménez, J., Marçalo, A., Ramírez, F., Verborgh, P., Gauffier, P., Esteban, R., Nicolau, L., González-Ortegón, E., Baldó, F., Vilas, C., Vingada, J., Forero, M. G., de Stephanis, R. (2017). Diet of Bottlenose Dolphin (Tursiops truncatus) from the Gulf of Cadiz: Insights from stomach content and stable isotope analyses. PLoS ONE, 12 (9): e0184673
González, A. F., López, A., Guerra, A. Barreiro, A. (1994). Diets of marine mammals stranded on the northwestern Spanish Atlantic coast with special reference to Cephalopoda. Fish. Res., 21: 179-191.
Hastie, G. D., Wilson, B.,Thompson, P. M. (2006). Diving deep in a foraging hotspot: acoustic insights into bottlenose dolphin dive depths and feeding behaviour. Mar. Biol., 148 (5): 1181-1188.
Klatsky, L. J., Wells, R. S., Sweeney, J. C. (2007). Offshore bottlenose dolphins (Tursiops truncatus): movement and dive behavior near the Bermuda Pedestal. J. Mammal., 88 (1): 59-66.
Louis, M., Viricel, A., Luca, T., Peltier., H., Alfonsi, E., Berrow, S., Brownlow, A., Covelo, P., Dabin, W., Deaville, R., de Stephanis, R., Gally, F., Gauffier, P., Penrose, R., Silva, M. A., Guinet, C., Simon-Bouhet, B. (2014). Habitat-driven population structure of bottlenose dolphins, Tursiops truncatus, in the North-East Atlantic. Mol. Ecol., 23: 857-874.
Nowacek, D. P. (2002). Sequential foraging behaviour of bottlenose dolphins, Tursiops truncatus, in Sarasota Bay, Fla. Behaviour, 139: 1125-1145.
Pryor, K., Lindbergh, J., Lindbergh, S., Milano, R. (1990). A dolphin-human fishing cooperative in Brazil. Mar. Mamm. Sci., 6: 77-82.
Santos, M. B., Fernández, R., López, A., Martínez, J. A., Pierce, G. J. (2007). Variability in the diet of bottlenose Dolphin, Tursiops truncatus, in Galician waters, north-western Spain, 1990-2005. J. Mar. Biolog. Assoc. UK, 87: 231-241.
Sargeant, B. L., Mann, J., Berggren, P., Krützen, M. (2005). Specialization and development of beach hunting, a rare foraging behavior, by wild bottlenose dolphins (Tursiops sp.). Can. J. Zool., 83 (11): 1400-1410.
Shane, S. H., Wells, R. S., Würsig, B. (1986). Ecology, behavior and social organization of the bottlenose dolphin: a review. Mar. Mamm. Sci., 2: 34-63.
Simões-Lopes, P. C., Fabian, M. E., Menegheti, J. O. (1998). Dolphin interactions with the mullet artisanal fishing on southern Brazil: a qualitative and quantitative approach. Rev. Bras. Zool., 15: 709-726.
Spitz, J., Rousseau, Y., Ridoux, V. (2006). Diet overlap between harbour porpoise and bottlenose dolphin: an argument in favour of interference competition for food? Estuar. Coast. Shelf. S., 70: 259-270.
Torres, L. G., Read, A. J. (2009). Where to catch a fish? The influence of foraging tactics on the ecology of bottlenose dolphins (Tursiops truncatus) in Florida Bay, Florida. Mar. Mamm. Sci., 25 (4): 797-815.
van Waerebeek, K., Reyes, J.C., Read, A. J., McKinnon, S. (1990). Preliminary observations of bottlenose dolphins from the Pacific coast of South America. Pp. 143-154. En: Leatherwood, S., Reeves, R. R. (Eds.) The bottlenose dolphin. Academic Press, San Diego.
Wang, J. Y., Riehl, K. N., Dungan, S. Z. (2014). Family Delphinidae. En: Wilson, D. E., Mittermeier, R. A. (Eds.). Handbook of the Mammals of the World Vol. 4: Sea Mammals. Lynx Edicions, Barcelona.
Wells, R. S., Scott, M. D. (2018). Bottlenose dolphin, Tursiops truncatus, common bottlenose dolphin. Pp. 118-125. En: Würsig, B., Thewissen, J. G. M., Kovacs, K. (Eds.). Encyclopedia of Marine Mammals. Third Edition. Academic Press, London.
Carmen M. Arija
Sea Wolves
Urb. Pinar de Garaita, 86, 03530 La Nucía, Alicante
Fecha de publicación: 21-08-2020
Arija, C. M. (2020). Delfín mular común – Tursiops truncatus. En: Enciclopedia Virtual de los Vertebrados Españoles. López, P., Martín, J., Barja, I. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http: //www.vertebradosibericos.org
|