|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Para más información sobre cada apartado hacer click en:
|
Key words: Wood Mouse, identification, description, size, variation. SistemáticaEl ratón de campo es un micromamífero perteneciente al orden Rodentia, familia Muridae, subfamilia Murinae y género Apodemus (Kaup, 1829). El número de especies que forman el género Apodemus y las relaciones filogenéticas existentes entre ellas, es un tema de gran interés y controversia en la comunidad científica (Serizawa et al., 2000; Michaux et al., 2002; Filippucci et al., 2002). Estudios moleculares recientes, han dado luz a la problemática fijando en 15 el número de especies incluidas dentro de este género (Liu et al. 2004), las cuales se distribuyen por la práctica totalidad del planeta (Nowak, 1999). En la Península Ibérica se encuentran presentes el ratón de campo (Apodemus sylvaticus Linnaeus, 1758) y el ratón leonado (Apodemus flavicollis Melchior, 1834), dos especies del subgénero Sylvaemus (Michaux et al., 2002; Filippucci et al., 2002; Hoofer et al., 2007) que conviven en las áreas del tercio norte peninsular (Arrizabalaga y Torre, 2007). Debido a las similitudes morfológicas existentes entre ambas especies, es necesario el uso de técnicas bioquímicas y genéticas, así como la comparación de algunos caracteres morfológicos para poder identificarlas a nivel específico (Pasquier, 1974; Arrizabalaga et al., 1999; Torre et al., 2002; Barčiová y Macholán, 2009). Identificación y morfologíaEl ratón de campo es un mamífero de tamaño mediano que se caracteriza por presentar unos ojos oscuros y orejas redondeadas que destacan notablemente en proporción al tamaño de la cabeza, rasgo característico que le permite ser separado fácilmente del género Mus (Jubete, 2002) (Figura 1). Además, posee las extremidades posteriores considerablemente más largas que las delanteras, posibilitándole de este modo incorporar saltos en su desplazamiento, y una cola de longitud igual o superior a la longitud cabeza-cuerpo, delgada, con pelos cortos y finos, y cubierta con una funda tegumentaria que se desprende con facilidad como mecanismo de huida ante un depredador (Torre et al., 2002).
Figura 1. Mus spretus (izquierda) y Apodemus sylvaticus (derecha). (C) B. Sánchez-González
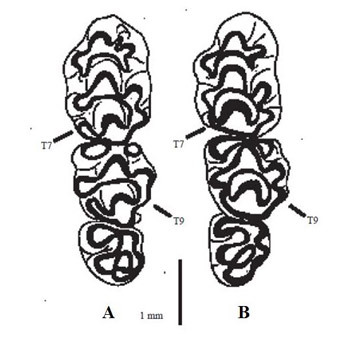
La coloración del pelaje varía con la edad (Torre et al., 2002), estando claramente dividida la zona dorsal de la ventral. Así, el pelaje de los individuos juveniles entre el primer y segundo mes de vida, momento en el ocurre la primera muda, es de color grisáceo en la zona dorsal (Sans-Coma et al., 1987) y blanquecino en la zona ventral. Tras la primera muda, el pelaje dorsal pasa de tonos parduscos en los individuos subadultos a rojizo en los adultos (Gosàlbez, 1987), y de blanquecino a amarillento en la zona ventral (Torre et al., 2002). Además, en algunos individuos se puede observar una mancha en el pecho de tamaño variable y color leonado, aunque no es un carácter determinante. A. sylvaticus tiene una talla menor que la de A. flavicollis. Collar amarillo reducido o ausente en A. sylvaticus y bien desarrollado en A. flavicollis. A. flavicollis tiene el dorso más marrón y el vientre más blanco que A. sylvaticus (Niethammer, 1978). El cráneo tiene una forma alargada, presentando un acusado estrechamiento en la región nasal, un diastema como característica evidente, y con forma algo cóncava en la zona lateral en la que se pueden observar los arcos zigomáticos apenas separados del cráneo (Jubete, 2002; Torre et al., 2002). Presenta una dentición de crecimiento limitado, con una fórmula dentaria caracterizada por la ausencia de caninos y premolares: 1.0.0.3/1.0.0.3. (Torre et al., 2002). Las funciones de las piezas dentales que posee se centran en roer la superficie de los alimentos que consume (semillas) en el caso de los incisivos, y moler el alimento en el caso de los molares, los cuales están sometidos a un gran desgaste con el paso del tiempo y sirven como indicador de la edad aproximada del individuo (Torre et al., 2002). El tamaño del cráneo, menor en A. sylvaticus que en A. flavicollis, puede ser de utilidad para separara las dos especies del género Apodemus presentes en la Península Ibérica. Sin embargo,el menor índice de Longitud / Anchura del M2 y la presencia del tubérculo 9 bien desarrollado en dicho molar en el ratón de campo, son dos de los caracteres básicos para su identificación (Pasquier, 1974; Gil, 1990; Tormo, 2010) (Figura 2). Además, los cuatro alvéolos presentes en el M1 del ratón de campo, lo diferencian nuevamente del género Mus que tienen únicamente tres. Un ejemplar de Fresno Alhándiga (Salamanca) presentaba un tubérculo externo supernumerario en el primer molar inferior de la mandíbula derecha (García y Mateos, 2008).
Figura 2. Esquema de la serie molar superior de Apodemus flavicollis (A) y Apodemus sylvaticus (B). Se señalan los tubérculos 7 del M1 y 9 del M2. Según Arrizabalaga et al. (1999).
La determinación del sexo en función de la distancia ano-genital parece ser también un carácter de gran utilidad, siendo ésta mayor en los machos que en las hembras (Gurnell y Flowerdew, 2006) (Figuras 3A y 3B). En las hembras se pueden observar tres pares de mamas: uno pectoral y dos inguinales (Jubete, 2002), notablemente más visibles durante el periodo reproductor (Figura 3C).
Figura 3. Macho reproductor con los testículos descendidos (A); Hembra reproductora con la vagina perforada (B); Hembra reproductora lactante con las mamas prominentes (C). d = distancia ano-genital. En rojo se señala la distancia ano-genital. (C) B. Sánchez-González
Biometría La Tabla 1 recoge valores medios de longitud de cabeza y cuerpo (LCC, mm) de varias poblaciones ibéricas.
Tabla 1. Valores medios de longitud de cabeza y cuerpo (LCC, mm) y masa corporal (g) de varias poblaciones ibéricas.
Masa corporal La Tabla 1 recoge valores medios de masa corporal (g) de varias poblaciones ibéricas. La masa corporal varía entre hábitats. En el Sistema Central, los ratones de campo que viven en bosques tienen mayor masa corporal aunque su tamaño corporal no difiere que los que viven en zonas de matorrales y herbáceas (Alcántara y Díaz, 1996). En robledales y zonas de ecotono próximas del Pirineo aragonés se registra un aumento de la masa corporal según transcurre la primavera tanto en machos como en hembras (García García, 1993). Dimorfismo sexualHay mayor tamaño corporal de los machos adultos con respecto a las hembras (Alcántara y Díaz, 1996).
Cariotipo El cariotipo estándar está formado por 2n = 48 cromosomas (Niethammer, 1978).
Huellas Debido a la ligereza de la especie no es común encontrar huellas plantares como signo de su presencia. Por ello, numerosos trabajos analizan la presencia de este pequeño roedor mediante señales indirectas como la presencia de restos óseos en egagrópilas (Delibes et al., 1984; Gómez, 1986; Ballesteros, 1994; Avenant, 2005), en excrementos (Torre et al., 2003; Rosellini et al., 2008) o en muestras de contenido gástrico de sus depredadores más comunes (Delibes, 1978).
Excrementos Deposita excrementos de tamaño pequeño (5-8 mm de longitud) y aspecto cilíndrico (Figura 4).
Figura 4. Excrementos de ratón de campo depositados en el interior de una trampa de vivo Sherman. (C) B. Sánchez-González
Voz Aunque no existen datos concretos para la Península Ibérica, estudios llevados a cabo en otras áreas han registrado el elevado número de vocalizaciones ultrasónicas emitidas por esta especie (Sewell, 1967; Stoddart y Sales, 1985), siendo éstas de gran importancia durante la infancia (Pontet et al., 1989), el periodo reproductor (Gyger y Schenk, 1983) y en las luchas con individuos de rango inferior (Torre et al. 2002). Además, también son capaces de emitir sonidos de baja frecuencia en situaciones de dolor o miedo (Stoddart y Sales, 1985). Variación geográficaEn Apodemus sylvaticus se han descrito un total de 32 subespecies, de las cuales cinco estarían presentes en el territorio español ocupando diferentes rangos de distribución (Niethammer, 1978). Así, en el norte de la Península habitaría Apodemus sylvaticus callipides Cabrera, 1907 (Gosálbez, 1987; Jubete, 2002), mientras que (Apodemus sylvaticus dichrurus Rafinesque, 1814) lo haría por el resto de la Península y las islas de Mallorca y Menorca. Sin embargo, las escasas diferencias morfológicas encontradas entre ambas subespecies hacen que no exista consenso en cuanto a su validez taxonómica (Gosálbez, 1987). En las islas Baleares se han descrito dos subespecies diferenciables de las peninsulares por su mayor tamaño corporal, el ratón de campo de Ibiza (Apodemus sylvaticus eivissensis Alcover, 1977) y el ratón de campo de Formentera (Apodemus sylvaticus frumenteriae Sans-Coma y Kahmann, 1977). Se observa variación latitudinal de la talla corporal. Así, aumenta el tamaño corporal del nordeste al sudoeste en su área de distribución (Niethammer, 1978). Esto supone una contradicción a la Regla de Bergmann para una especie endoterma, como es el ratón de campo. Sin embargo, la reducción del tamaño de sus apéndices (orejas, extremidades y cola) encontrada en el gradiente contrario (de sudoeste a nordeste) concuerda con lo enunciado en la Regla de Allen. La falta de concordancia estricta con las reglas térmicas generales ha demostrado la necesidad de tener en cuenta otros factores ecológicos que puedan influir en los factores climáticos estudiados en la variación geográfica del tamaño corporal (Alcántara, 1992). En este sentido, Alcántara (1992) ha profundizado en el posible efecto que puede tener la competitividad entre dos especies simpátridas de morfología y tamaño similares, como son el ratón de campo y el ratón leonado, pudiendo producirse un aumento gradual de tamaño a medida que se produce una reducción del mismo en la especie competidora dominante. También existen diferencias de tamaño entre las poblaciones que habitan la Península Ibérica y aquellas que se encuentran en las islas de Ibiza y Formentera, poniéndose especial atención al gigantismo observado en estas últimas. Así, estudios previos han documentado un incremento del tamaño de las poblaciones de las islas en relación al que presentan los ejemplares que habitan en la Península. Además, este incremento es más acusado en las islas de menor superficie, como Ibiza y Formentera (Alcover y Gosálbez, 1988), que en islas mediterráneas próximas pero de mayor tamaño (Sara y Casamento, 1995). Estos resultados ponen de manifiesto de nuevo la problemática existente sobre la validez taxonómica de las subespecies insulares, pues la proximidad genética demostrada entre los grupos peninsulares e insulares (Sara y Casamento, 1995) parece eliminar la posibilidad de una deriva genética como origen de estas últimas, confirmando a su vez la validez del síndrome de insularidad (Blondel, 1986; Libois et al., 1993) como posible causa del gigantismo observado. Hay variaciones clinales de la forma de las mandíbulas y molares, lo que podría estar relacionado con cambios en la dieta. En Ibiza el tamaño corporal y de la mandíbula es mayor, pero el tamaño molar es similar a las poblaciones peninsulares (Renaud y Michaux, 2007). Las poblaciones ibéricas, incluidas las de las islas Baleares, pertenecen al linaje que se extiende desde Pirineos a Escandinavia (Michaux et al., 1996, 1998). Las poblaciones occidentales del ratón de campo provienen de la recolonización postglacial a partir de un refugio glacial ibérico (Michaux et al., 2005). El tiempo de separación entre el linaje europeo oriental, presente en Italia, Balcanes y oeste de Turquía, y el linaje europeo occidental habría sido hace 1,5-1,6 millones de años. El linaje de Sicilia se habría diferenciado de las poblaciones de Italia hace 0,8-0,9 millones de años. Los ratones de campo del noroeste de África se habrían diferenciado hace 0,4 millones de años de linaje occidental (Michaux et al., 2003). Por tanto, el linaje occidental se correspondería con la subespecie A. s. sylvaticus, descrita de Suecia, que sería la que ocupa la Península Ibérica y las islas Baleares y no serían válidos los taxones callipides, frumentariae y eivissensis. El taxón Apodemus sylvaticus dichrurus Rafinesque, 1814, descrito de Sicilia, estaría restringido a esta isla.
ReferenciasAbad, P. L. (1991). Biology of Apodemus sylvaticus in Leon Province, Spain. Mammalia, 55 (4): 579-589. Alcántara, M. (1992). Distribución y preferencias de hábitat de los micromamíferos (Insectívora y Rodentia) de la Sierra de Guadarrama. Tesis Doctoral, Universidad Complutense de Madrid. Alcántara, M., Díaz, M. (1996). Patterns of body weight, body size, and body condition in the wood mouse Apodemus sylvaticus L.: effects of sex and habitat quality. Pp. 141-149. En: Mathias, M. L., Santos-Reis, M., Amori, G., Libois, R., Mitchell-Jones, A., Saint-Girons, M. C. (Eds.). European mammals. Proceedings of the 1 European Congress of Mammalogy. Museu Nacional de História Natural, Lisboa. 314 pp. Alcover, J. A. (1977). The Long-tailed Field Mouse or Wood mouse Apodemus sylvaticus Linné 1758 from the island of Ibiza, Pityusics. Säugetierk. Mitt., 25: 204-213. Alcover, J. A. (1983). Contribució al coneixement dels mamífers de les Balears i Pitiüses: Carnivora, Rodentia. Tesis doctoral. Universidad de Barcelona. 723 pp. Alcover, J. A., Gosálbez J. (1988). Estudio comparado de la fauna de micromamíferos de las Islas Baleares y Pitiusas. Bull. Ecol., 19: 321-328. Arrizabalaga, A., Torre, I., Catzeflis, F., Renaud, F., Santalla, F. (1999). Primera citació d’Apodemus flavicollis (Melchior, 1834) al Montseny. Determinació morfològica i genètica. Pp. 193-195. En: III i IV Trobada d'Estudiosos del Montseny: III Trobada: Comunicacions presentades el dia 11 de desembre de 1992 a Sant Pere de Vilamajor. IV Trobada: Comunicacions presentades el dia 19 de desembre de 1996 a Seva. Monografies, Servei de Parcs Naturals, 27. Diputació de Barcelona. 321 pp. Arrizabalaga, A., Torre, I. (2007). Ratón leonado Apodemus flavicollis (Melchior, 1834). Pp. 445-448. En: Palomo L. J., Gisbert, J., Blanco, J.C. (Eds.). Atlas y libro rojo de los mamíferos terrestres de España. Dirección General de Conservación de la Naturaleza-SECEM-SECEMU, Madrid. Avenant, N. (2005). Barn owl pellets: a useful tool for monitoring small mammal communities. Belg. J. Zool., 135: 39-43. Ballesteros, T. (1994). Dieta de la lechuza común (Tyto alba) en una localidad del delta del Llobregat. Butlletí Naturalista del delta del Llobregat, 1: 45-48. Barčiová, L., Macholán. M. (2009). Morphometric key for the discrimination of two wood mice species, Apodemus sylvaticus and A. flavicollis. Acta Zoologica Academiae Scientiarum Hungaricae, 55 (1): 31-38. Blondel, J. (1986). Biogéographie évolutive. Masson, Paris. Delibes, M. (1978). Feeding habits of the stone marten, Martes foina (Erxleben, 1777), in northern Burgos, Spain. Zeitschrift für Säugetierkunde, 43: 282-288. Delibes, M., Brunet-Lecomte, P., Máñez, M. (1984). Datos sobre la alimentación de la lechuza común (Tyto alba), el buho chico (Asio otus) y el mochuelo (Athene noctua) en una misma localidad de Castilla la Vieja. Ardeola, 30: 57-63. Filippucci, M. G., Macholan, M., Michaux, J. R. (2002). Genetic variation and evolution in the genus Apodemus (Muridae: Rodentia). Biol. J. Linn. Soc., 75 (3): 395-419. García García, D. (1993). Uso de microhábitat del ratón de campo (Apodemus sylvaticus L.) en robledales y áreas ecotonales del Pirineo. Doñana Acta Vertebrata, 20 (2): 125-143. García, P., Mateos, I. (2008). Descripción de una anomalía dentaria en un ratón de campo Apodemus sylvaticus (Linnaeus, 1758) en la provincia de Salamanca. Galemys, 20 (1): 81-85. Gil, E. (1990). Los múridos del Pleistoceno Medio de Atapuerca (Burgos, España). Distribución estratigráfica. Geogaceta, 7: 31-33. Gómez, M. A. G. (1986). Estudio de la dieta alimenticia de la lechuza: identificación de las presas de la lechuza a partir de las egagrópilas recogidas en el paraje de Cuasiermas (Tarazona, Motilleja, Albacete). Al-Basit: Revista de estudios albacetenses, (19): 189-203. González-Esteban, J., Gosálbez, J., Castién, E. (1996). Estudio morfométrico y del crecimiento de Apodemus sylvaticus L., 1758 (Rodentia, Muridae) en el norte de la Península Ibérica. Doñana Acta Vertebrata, 23 (1): 63-73. Gosàlbez, J. (1987). Insectívors i rosegadors de Catalunya. Ketres, Barcelona. Gurnell, J., Flowerdew, J. R. (2006). Live trapping small mammals. A practical guide. 4th edn. Mammal Society, London. Gyger, M., Schenk, F. (1983). Semiotical approach to the ultrasonic vocalization in the wood mouse, Apodemus sylvaticus L. Behaviour, 84 (3): 244-257. Hoofer, S. R., Gaschak, S., Dunina-Barkovskaya, Y., Makluk, J., Meeks, H. N., Wickliffe, J. K., Baker, R.J. (2007). New information for systematics, taxonomy, and phylogeography of the rodent genus Apodemus (Sylvaemus) in Ukraine. J. Mammal., 88 (2): 330-342. Jubete, F. (2002). Apodemus sylvaticus (Linnaeus, 1758). Pp. 404-407. En: Palomo, L. J., Gisbert, J. (Eds.). Atlas de los mamíferos terrestres de España. Dirección General de Conservación de la Naturaleza-SECEM-SECEMU, Madrid. Libois, R., Fons, R., Bordenave, D. (1993). Mediterranean small mammals and insular syndrome: biometrical study of the long tailes field mouse (Apodemus sylavticus) (Rodentia Muridae) of Corsica. Bonner Zoologische Beiträge, 44 (3-4): 147-163. Michaux, J., Chevret, P., Filippucci, M., Macholan, M. (2002). Phylogeny of the genus Apodemus with a special emphasis on the subgenus Sylvaemus using the nuclear IRBP gene and two mitochondrial markers: cytochrome b and 12S rRNA. Mol. Phylogenet. Evol., 23 (2): 123-136. Michaux, J. R., Libois, R., Filippucci, M. G. (2005). So close and so different: comparative phylogeography of two small mammal species, the Yellow-necked fieldmouse (Apodemus flavicollis) and the Woodmouse (Apodemus sylvaticus) in the Western Palearctic region. Heredity, 94 (1): 52-63. Michaux, J. R., Libois, R., Fons, R. (1996). Differenciation genetique et morphologique du mulot, Apodemus sylvaticus, dans le bassin Mediterraneen occidental. Vie et Milieu, 46 (3-4): 193-203. Michaux, J., Libois, R., Ramalhinho, M. G., Maurois, C. (1998). On the mtDNA restriction patterns variation of the Iberian wood mouse (Apodemus sylvaticus). Comparison with other west Mediterranean populations. Hereditas, 129 (3): 187-194. Michaux, J. R., Magnanou, E., Paradis, E., Nieberding, C., Libois, R. (2003). Mitochondrial phylogeography of the Woodmouse (Apodemus sylvaticus) in the Western Palearctic region. Molecular Ecology, 12 (3): 685-697. Niethammer, J. (1978). Apodemus sylvaticus (Linnaeus, 1758) – Waldmaus. Pp. 337-358. En: Niethammer, J., Krapp, F. (Eds.). Handbuch der Säugetiere Europas. Band 1. Rodentia I (Sciuridae, Castoridae, Gliridae, Muridae). Akademische Verlagsgesellschaft, Wiesbaden. 476 pp. Pasquier, L. (1974). Dynamique évolutive d’un sousgenre de muridae, Apodemus (Sylvaemus). Etude biométrique des caractères dentaires des populations fossiles et actuelles d’Europe occidentale. Université de Montpellier. Pontet, A., Gyger, M., Schenk, F. (1989). Ontogeny of ultrasonic vocalizations in the woodmouse (Apodemus sylvaticus L.). I: Temporal organization. Behaviour, 108 (3): 241-261. Renaud, S., Michaux, J. R. (2007). Mandibles and molars of the wood mouse, Apodemus sylvaticus (L.): integrated latitudinal pattern and mosaic insular evolution. Journal of Biogeography, 34 (2): 339-255. Rosellini, S., Barja, I., Piñeiro, A. (2008). The response of European pine marten (Martes martes L.) feeding to the changes of small mammal abundance. Pol. J. Ecol., 56 (3): 497-503. Sans-Coma, V., Gosálbez, J., Rosado, L. M. (1987). Un estudio de la morfometría y del comienzo de la actividad reproductora de Apodemus sylvaticus (L., 1758) en la Península Ibérica basado en las consideraciones de los pelajes y las mudas como indicadores de la edad. Pp. 89-98. En: Sans-Coma, V., Mas-Coma, S., Gosálbez, J. (Eds.). Mamíferos y helmintos. Volumen homenaje al Prof. Dr. Herman Kahmann en su 81 aniversario. Ketres, Barcelona. 338 pp.Sans-Coma, V., Kahmann, H. (1977). Die Waldmaus (Apodemus) der Pityuseninsel Formentera. Säugetierk. Mitt., 25: 35-43. Sara, M., Casamento, G. (1995). Morphometrics of the wood mouse (Apodemus sylvaticus, Mammalia, Rodentia) in the Mediterranean. Ital. J. Zool., 62 (3): 313-320. Serizawa, K., Suzuki, H., Tsuchiya, K. (2000). A phylogenetic view on species radiation in Apodemus inferred from variation of nuclear and mitochondrial genes. Biochem. Genet., 38 (1-2): 27-40. Sewell, G. D. (1967). Ultrasound in adult rodents. Nature, 215 (5100): 512. Stoddart, D. M.,Sales, G. D. (1985). The olfactory and acoustic biology of wood mice, yellow-necked mice and bank voles. Pp. 117-139. En: Flowerdew, J. R., Gurnell, J., Gipps, J. H. W. (Eds.). The ecology of woodland rodents. Bank voles and wood mice. Symp. Zool. Soc. Lond., London. Tormo, C. (2010). Los roedores e insectívoros de los niveles gravetienses de la Cova de les Cendres (Teulada-Moraria, Alicante). Implicaciones paleoclimáticas 1. Archivo de Prehistoria Levantina, 28: 47. Torre, I., Arrizabalaga, A., Díaz, M. (2002). Ratón de campo (Apodemus sylvaticus Linnaeus, 1758). Galemys, 14 (2): 1-26. Torre, I., Ballesteros, T., Degollada, A. (2003). Cambios en la dieta de la gineta (Genetta genetta Linnaeus, 1758) con relación a la disponibilidad de micromamíferos: ¿posible preferencia por el topillo rojo? Galemys, 15: 13-24.
Beatriz Sánchez-González, Álvaro Navarro-Castilla, Mª Carmen Hernández e Isabel Barja Fecha de publicación: 12-12-2016 Sánchez-González, B., Navarro-Castilla, A., Hernández, M. C., Barja, I. (2016). Ratón de campo – Apodemus sylvaticus. En: Enciclopedia Virtual de los Vertebrados Españoles. Salvador, A., Barja, I. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||