|
|
|
|
|
|
Para más información sobre cada apartado hacer click en:
|
Key words: Common shelduck, foraging mode, diet.
Ecología trófica Modo de obtención de alimento Obtiene su alimento explotando al máximo las estrategias que le permite su carácter nadador, desde aguas muy someras hasta las profundidades que puede alcanzar con el basculamiento completo del cuerpo o “upending” (Patterson, 1982). Se alimenta removiendo, guadañeando(“scything”) o chapoteando en agua somera o sedimento expuesto, y basculando en aguas de hasta 40 cm de profundidad. Al igual que otras especies con pollos precoces, los tarros blancos adultos no alimentan a sus crías, sino que las acompañan mientras obtienen su propio alimento. Éstas bucean, desde el primer día de vida, pero este comportamiento de alimentación disminuye rápidamente transcurridas dos semana (Carboneras y Kirwan, 2019). El buceo puede ser virtualmente la única técnica que les permite acceder al alimento, en especial cuando son trasladados a masas de agua seguras, relativamente profundas y carentes de orillas someras (por ejemplo cubetas salineras, depuradoras de lagunaje, balsas de riego). En comparación con los realizados en ambientes atlánticos (Patterson, 1982; Thompson, 1982; Ferns y Reed, 2009), son escasos los estudios de comportamiento alimentario en el Mediterráneo, con la excepción de Walmsley y Moser (1981) en las salinas de Camarga.
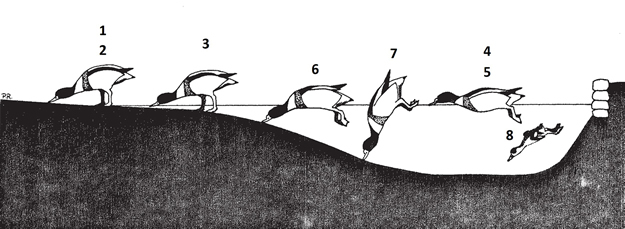
Figura 1. Métodos de alimentación utilizados por el tarro blanco en el sureste ibérico. 1) Guadañeo en fango. 2) Picoteo en fango. 3) Guadañeo en aguas someras. 4) Guadañeo en agua libre. 5) Picoteo en agua libre. 6) Sumergir la cabeza. 7) Bascular. 8) Buceo (solo pollos). Según Robledano (1986).
En España Robledano (1986) realizó un estudio de su actividad trófica en dos humedales costeros, ambos de uso salinero, aunque con diferente morfología y manejo, las Salinas de San Pedro del Pinatar (Murcia) y la Laguna de la Mata (Alicante). Considerando todas las observaciones en su conjunto, en invierno se registra una mayor utilización de pautas de alimentación en aguas libres (>10 cm de profundidad) en las que las aves invierten el 84,11% del tiempo total de alimentación. Los métodos más utilizados en agua libre son “bascular” (33,12%) y “sumergir la cabeza” (29,69%). La alimentación en fango o aguas someras (<10 cm) ocupa el resto del tiempo, predominando el “guadañeo en fango” (13,92%). En la época estival, se observaron algunas diferencias entre el comportamiento alimentario de los adultos no reproductores y los territoriales. En los primeros predominaron los métodos de alimentación por guadañeo en fango y agua somera (44,33 y 31,87%, respectivamente. En los segundos el primer método por si sólo ocupó el 74,08% del tiempo de alimentación. Estas pautas cambian radicalmente con el nacimiento de los pollos, que son llevados a aguas más profundas en las que desarrollan la mayor parte de su actividad alimentaria. Los adultos pasan entonces a utilizar casi exclusivamente técnicas de alimentación en aguas abiertas, principalmente “guadañeo en agua libre” (82,06%) y basculamiento (11,39%). Pocos trabajos realizados en otros países mediterráneos (tanto en el litoral de este mar como en el atlántico) cuantifican la utilización de distintos métodos de alimentación, y todos se refieren al periodo invernal. Las diferencias metodológicas dificultan la comparación pero en general pueden contrastarse con las observaciones realizadas en el sureste de España. En Grecia, Liordos (2010) estudió el comportamiento alimentario de los gremios de aves acuáticas en un humedal costero que incluye aguas abiertas, llanos fangosos intermareales y pastizales halófilos. Los tarros blancos, asignados al gremio de los “generalistas de aguas someras”, utilizaron principalmente aguas someras (85%) aunque para el autor esta categoría incluye desde la línea de marea hasta los 6 m de profundidad, lo cual abarcaría aguas profundas y someras (según la clasificación utilizada en el SE de España). Las técnicas de alimentación predominantes fueron tamizar (sieving), probablemente equivalente a nuestro guadañeo (48,7%), bascular (38,5, y sumergir cabeza y cuello (12,8%). En un complejo de lagos salados de Argelia (Boulkhssaim et al., 2013) registraron como métodos principales la búsqueda de alimento en superficie y basculando. Vadear (wading) en agua somera o en las orillas fue un método poco usado (3-9%), siendo dominante bascular (68% en promedio), seguido por la alimentación en la superficie del agua (29%). El tiempo dedicado a este último método de alimentación se incrementó desde menos de un 20% en diciembre hasta casi un 40% en primavera a medida que disminuía el nivel del agua. En las salinas de Camarga (sur de Francia), un conjunto de lagunas salinas no mareales, los tarros blancos utilizaron cinco métodos de alimentación: chapoteo en fango expuesto (con una superficie húmeda), guadañeo (scything) en la orilla o en agua más profunda, chapoteo en agua somera (1-10 cm), sumergir la cabeza (10-25 cm) por aves que se desplazan a nado, y bascular en agua más profunda (25-40 cm). Cada una de estas técnicas sirve para obtener un tipo característico de alimento, y estos a su vez estaban disponibles en periodos concretos a lo largo de la invernada (Walmsley y Moser,1981). El método de alimentación más frecuente era el chapoteo en agua somera, utilizado por los tarros para alimentarse de la bioderma algal (tapetes de cianofíceas), seguido por sumergir la cabeza y guadañear, utilizados respectivamente para consumir adultos y cistes (huevos durables) del crustáceo Artemia. Los estudios realizados en regiones atlánticas de Francia pueden ser representativos del comportamiento alimentario de las poblaciones del litoral cantábrico español. En las zonas intermareales del litoral atlántico francés el método de obtención del alimento más frecuente es el movimiento de guadañeo, tamizando con el pico los dos primeros centímetros de sedimento para retener invertebrados de menos de 8 mm de longitud, preferentemente el molusco Hydrobia ulvae (Viain et al., 2013; Saint-Béat et al., 2013). Muestra una gran flexibilidad en su comportamiento alimentario, pudiendo sustituir la técnica preferida en respuesta a cambios naturales o inducidos por el hombre. Ferns y Reed (2009) observaron cómo los tarros invernantes en la bahía de Cardiff cambiaron del guadañeo en el sedimento mientras caminaban, en busca de poliquetos (Nereis)y moluscos (Hydrobia), a capturar a nado larvas de dípteros (Chironomidae), sumergiendo la cabeza y basculando. Todo ello tras la conversión de fangos intermareales en un lago permanente de agua dulce por la construcción de un embalse, y sin que cambiara significativamente el tiempo dedicado diariamente a la alimentación (30-37%), si bien el tamaño de la población se redujo en un 89%. En cambio, en el suroeste de Holanda, la transformación de zonas intermareales en en lagos de agua dulce hizo que el máximo de abundancia de tarros blancos se desplazara del invierno a primavera y verano. Esto probablemente esté relacionado con un cambio en los recursos alimenticios aprovechables, de invertebrados predominantemente marinos en el hábitat original a larvas y pupas de quironómidos en los nuevos hábitats de agua dulce, cuyo pico de abundancia se produce a finales de primavera (Meininger y Snoek, 1992). Esto ilustra la adaptabilidad del tarro blanco a cualquiera de los muy variados tipos de masa de agua que utiliza, desde marismas con orillas someras hasta lagunas y embalses artificiales con riberas abruptas y aguas relativamente profundas, siempre y cuando la oferta trófica sea adecuada. Los pollos bucean, lo que unido al uso de prácticamente todas las técnicas de los adultos, les otorga una amplitud de métodos de búsqueda de alimento superior a la de éstos (Robledano, 1986). La técnica más utilizada es el buceo (55,62% del tiempo, en promedio), seguida por el “guadañeo en agua libre” (35,66%). La eficiencia de los buceos, expresada como la relación entre la duración de éstos y la de las pausas entre buceos consecutivos, dentro de una misma secuencia de alimentación, aumenta a lo largo de su desarrollo, aumento que se logra principalmente mediante una reducción de las pausas: en las Salinas de San Pedro del Pinatar (Murcia), la duración media de los buceos varío de 9,02 segundos (N=79) a 8,36 segundos (N=40) entre la primera y la tercera quincena de desarrollo, mientras que la de las pausas cayó de 13,39 a 4,78 segundos en el mismo tiempo. La duración de los buceos es en general inferior que la registrada en los pollos de especies buceadoras (por ejemplo, Salvador, 2017) Composición de la dieta El tarro blanco basa su alimentación fundamentalmente en invertebrados acuáticos (moluscos, insectos y crustáceos), a menudo con preferencia por presas muy pequeñas para un ave tan corpulenta (Patterson, 1982). Entre éstas destacan ciertos moluscos de aguas costeras como Hydrobia ulvae, especialmente en el Noroeste de Europa. Estos moluscos parecen tener importancia tanto en la dieta invernal como en la estival (una hembra que volvía a incubar tras una hora de alimentación, contenía más de 11.800 ejemplares). En cambio, en las salinas de Camarga, donde la especie Hydrobia acuta está presente en elevadas densidades, nunca apareció como componente de la dieta (Walmsley y Moser, 1981). En los cuarteles europeos de muda consume también otros moluscos (Cerastoderma, Mytilus, Littorina). También consume peces de pequeño tamaño y frezas, gusanos (oligoquetos), y materia vegetal (algas, semillas de plantas acuáticas y grano). En aguas eutrofizadas, el desarrollo de masas de algas filamentosas no le afecta negativamente, pudiendo alimentarse de los invertebrados asociados (Troadec, 2006; Pringle y Burton, 2017). Ha sido observado depredando huevos de Focha común (Fulica atra). En zonas estuarinas también se añaden a su dieta crustáceos como el anfípodo Corophium y poliquetos (Nereis), capturados principalmente por los pollos (Patterson, 1982; Kear, 2005; Edwards, 2009; Carboneras y Kirwan, 2019). En el sur de Europa y Asia las presas preferidas son pequeños crustáceos y larvas de insectos, especialmente dípteros (Dolichopodidae, Ephydridae y Chironomidae). Una fuente de alimento destacable en verano fue el crustáceo Artemia salina, tanto adultos (media de 1.800 individuos, máximo 19.800 por estómago analizado) como huevos (media de 10.150, máximo 36.800), también importante en el Mediterráneo. Otras presas fueron hormigas voladoras (Formicidae) y langostas de la especie Calliptamus italicus, consumidas por los pollos, así como algas unicelulares. Menos se sabe sobre la dieta invernal en la parte oriental de su área de distribución, citándose una mayor importancia de las algas y semillas de plantas acuáticas (por ejemplo Ruppia), así como algunos moluscos de los géneros Hydrobia y Theodoxus (Dementiev y Gladkov, 1952; Walmsley y Moser, 1981). En el norte de África, Walmsley (2015) cita los crustáceos Branchinellia y Artemia salina como principales presas invernales en lagos salados de Argelia. En las poblaciones del norte de Europa, la transformación de hábitats intermareales a masas permanentes de agua dulce o salobre parece llevar asociado un cambio de la dieta típica basada en moluscos hacia larvas y pupas de Chironomidae (Meininger y Snoek, 1992; Ferns y Reed, 2009). Las larvas de dípteros parecen tener mucha mayor relevancia en la época primaveral y en los ambientes no mareales utilizados por las poblaciones mediterráneas y orientales (un ave en Rusia contenía 63.880 larvas de Chironomidae, siendo la media de 5.970 por estómago), aunque en general la composición de la dieta resulta peor conocida en estas zonas (Dementiev y Gladkov, 1952). En la Península Ibérica apenas hay estudios de ecología trófica, por lo que la dieta sólo ha podido inferirse a partir de las observaciones de aves alimentándose en hábitats cuyos recursos han sido investigados, asumiendo la especificidad de ciertas técnicas para tipos característicos de alimento, y por otras referencias indirectas. Suárez-R y Uríos (1999) encontraron semillas de Scirpus y Ruppia en el contenido estomacal de un ejemplar del Parque Natural de El Hondo. En las orillas de la Laguna de la Mata (Alicante), el consumo de tapetes de cianofíceas (bioderma algal) ha sido establecido por las huellas de su “raspado” con el pico tras observar a los tarros blancos realizar en ellas el típico movimiento de “guadañeo”. Al igual que el las Salinas de Camarga, la disponibilidad de estos tapetes, y su uso como fuente de alimento, parece relacionarse con la precipitación previa y con otros aportes de agua dulce, que favorece su desarrollo en las cubetas desecadas o en las orillas de los humedales salinos (Robledano, 1986).
Referencias Boulkhssaim, M., Houhandi, M., Samraoui, B. (2013). Status and diurnal behaviour of the Shelduck Tadorna tadorna in the Hauts Plateaux, northeast Algeria. Wildfowl, 56: 65-78. Carboneras, C., Kirwan, G. M. (2019). Common Shelduck (Tadorna tadorna). En: Del Hoyo, J., Elliott, A., Sargatal, J., Christie, D. A., De Juana, E. (Eds.). Handbook of the Birds of the World Alive. Lynx Edicions, Barcelona. https://www.hbw.com/node/52839 Dementiev, G. P., Gladkov, N. A. (Eds.) (1952). Birds of the Soviet Union. Vol. 4. (English translation). Israel Programme for Scientific Translations, Jerusalem. Edwards, R. (2009). Common Shelduck predating eggs of Common Coot. British Birds, 102: 634. Ferns, P. N., Reed, J. P. (2009). Effects of the Cardiff Bay tidal barrage on the abundance, ecology and behaviour of shelducks Tadorna tadorna. Aquatic Conservation: Marine and Freshwater Ecosystems, 19 (4): 466-473. Kear, J. (Ed.) (2005). Ducks, Geese and Swans. Oxford University Press, Oxford. Liordos, V. (2010). Foraging Guilds of Waterbirds Wintering in a Mediterranean Coastal Wetland. Zoological studies, 49 (3): 311-323. Meininger, P. L., Snoek, H. (1992). Non-breeding Shelduck Tadorna tadorna in the southwest Netherlands: effects of habitat changes on distribution, numbers, moulting sites and food. Wildfowl, 43: 139-151. Patterson, I. J. (1982). The Shelduck. A study in behavioural ecology. Cambridge University Press, Cambridge. Pringle, H. E. K., Burton, N. H. K. (2017). Improving understanding of the possible relationship between improving freshwater and coastal water quality and bird interest on designated sites-phase 1 review. BTO Research Report No. 696, British Trust of Ornithology, Norfolk. Robledano, F. (1986). La población de Tarro Blanco (Tadorna tadorna) del Sureste de España. Aproximación ecológica y etológica. Tesis de Licenciatura, Universidad de Murcia. Saint-Béat, B., Dupuy, C., Bocher, P., Chalumeau, J., De Crignis, M., Fontaine, C., Guizien, K., Lavaud, J., Lefebvre, S. Montanié, H., Mouget, J. L., Orvain, F., Pascal, P. Y., Quaintenne, G., Radenac, G., Richard, P., Robin, F., Vézina, A. F., Niquil, N. (2013). Key Features of Intertidal Food Webs That Support Migratory Shorebirds. PLoS ONE, 8 (10): e76739. Salvador, A. (2017). Malvasía cabeciblanca – Oxyura leucocephala. En: Salvador, A., Morales, M. B. (Eds.). Enciclopedia Virtual de los Vertebrados Españoles. Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/ Suárez-R., C., Uríos, V. (1999). La contaminación por saturnismo en las aves acuáticas del Parque Natural de El Hondo y su relación con los hábitos alimenticios. Humedales Mediterráneos, 1: 83-90. Thompson, D. B. A. (1982). The abundance and distribution of intertidal invertebrates, and an estimation of their selection by Shelduck. Wildfowl, 33: 151-158. Troadec, V. (2006). Suivi de la reproduction du tadorne de Belon (Tadorna tadorna L.) dans le baie de Saint-Brieuc. Master Aménagement, Environnement - Institut de Géoarchitecture U.B.O., Brest, 69p. Viain, A., Corre, F., Delaporte, P., Joyeux, E., Bocher, P. (2013). Numbers, diet and feeding methods of Common Shelduck Tadorna tadorna wintering in the estuarine bays of Aiguillon and Marennes-Ol. Wildfowl, 61: 121-141. Walmsley, J. G., Moser, M. E. (1981). The winter food and feeding habits of Shelduck in the Camargue, France. Wildfowl, 32: 99-106. Walmsley, J. G. (2015). The common Shelduck Tadorna tadorna, an important coastal breeding species and bio-indicator of saline environments in the Mediterranean. En: Yésou, P., Sultana, J., Walmsley, J. G., Azafzaf, H. (Eds.). Conservation of Marine and Coastal Birds in the Mediterranean. Proceedings of the UNEP-MAP-RAC/SPA Symposium, Hamamet (Tunisia).
Francisco Robledano Aymerich
Fecha de publicación: 30-03-2020
Robledano, F. (2020). Tarro blanco – Tadorna tadorna. En: Enciclopedia Virtual de los Vertebrados Españoles. López, P., Martín, J. Amat, J. A. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
|
|
|
|
|
|
|