|
|
|
|
|
|
Para más información sobre cada apartado hacer click en:
|
Key words: Coal Tit, habitat use, body mass regulation, food hoarding and caching, diet, starvation, fattening.
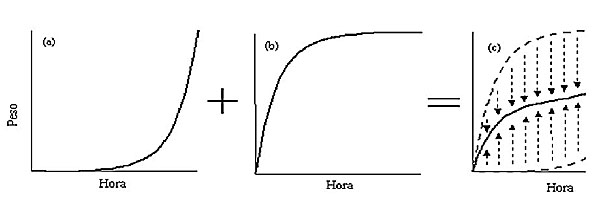
Ecología trófica Uso del espacio El Carbonero Garrapinos es una especie insectívora que emplea más del 90% del tiempo de búsqueda del alimento en la explotación de los diferentes componentes del sustrato arbóreo y, muy raramente, del suelo. Es, gracias a su pequeña talla, un ejemplo de adaptación a los segmentos más finos del hábitat forestal, donde se especializa en merodear entre acículas y ramas muy finas, sustratos de uso más dificultado para las especies de mayor talla (Polo y Carrascal, 1999a). Por tanto, siguiendo la clasificación de May (1982), puede incluirse a la especie en el gremio de aves insectívoras de tronco, ramas y follaje. En un estudio sobre uso del espacio, llevado a cabo en el periodo primavera-verano en un bosque subalpino de Pinus sylvestris de la Sierra de Guadarrama (Carrascal, 1984a), se observó que el tiempo destinado a alimentación en esta especie se reparte en un 98% en los árboles (5% en el tronco, 15% en ramas de más de 1cm de grosor, 23% en ramas finas y 55% en el follaje de acículas y en las piñas) y tan solo un 2% fuera de los mismos, utilizando las partes más altas del árbol, a una altura preferente de 8-16 metros sobre el suelo. Resultados parecidos se observaron durante el invierno en el mismo área (Moreno, 1981) y en un estudio realizado en bosques fragmentados con una mezcla de componentes autóctonos y de repoblaciones de Pinus radiata del norte de la Península Ibérica (Carrascal y Tellería, 1985), así como en un abetal pirenaico (Vila y Rodríguez-Teijeiro, 1992a) y en un bosque mixto de Pinus nigra y sotobosque de Quercus ilex y Juniperus spp. en las Sierras de Cazorla y del Segura (Obeso, 1987b). Además, el Carbonero Garrapinos sigue una rutina circadiana en los ritmos de uso del espacio y de la amplitud de nicho, forrajeando a menor altura y más cerca del tronco al mediodía que hacia el inicio del día o al final de la tarde y presentando más amplia variedad en los sustratos usados en las horas medianas (Vila y Rodríguez-Teijeiro, 1992b; Vila et al., 1996). P. ater utiliza acículas y conos durante más del 60% del tiempo que emplea en actividades tróficas y 33% las ramas finas (Obeso, 1987b), mostrando preferencia por zonas elevadas superiores a los 10 metros. La relativa estabilidad estacional en la oferta trófica de esos sustratos favorece su estrategia de especie residente en los medios forestales (Carrascal, 1984b; Herrera, 1978). Composición de la dieta Su dieta es mixta y presenta acusadas variaciones estacionales (Guitián, 1984, 1985; Obeso, 1987b). Se alimenta sobre todo de pequeños invertebrados durante la primavera y el verano, pasando a depender de materia vegetal durante las épocas más restrictivas del otoño y el invierno, cuando los insectos escasean (Senar y Borras, 2004). El orden decreciente de importancia de la ingesta de invertebrados es: dípteros, coleópteros, lepidópteros y arañas, y en menor medida: áfidos, larvas, homópteros y hormigas (Guitián, 1984; Obeso 1987a). Gonzalez-Cano (1981) ha observado aumentos estacionales de la densidad de individuos en torno a concentraciones elevadas de nidos de ‘procesionaria del pino’ en una repoblación de Pinus nigra del este peninsular, pasando a constituir estas más del 60% de su ingesta diaria. El tamaño preferido de las presas está comprendido en el rango de 2-4 mm (Guitián, 1984). El porcentaje de material vegetal del total de la ingesta pasa del 18,2% en verano al 61,7% en invierno (Obeso, 1987b; Guitián, 1984), y se debe fundamentalmente a piñones y en menor medida a bellotas, semillas de gramíneas y otras semillas indeterminadas (ver Herrera et al., 1994). Los piñones son la base fundamental de su supervivencia durante el invierno, llegando a constituir cerca del 60% del volumen de la dieta diaria de enero a comienzos de abril (Herrera, 1984; Obeso, 1987b), momento en el que los bosques de coníferas producen altos picos de productividad interanual. Las semillas contienen una elevada concentración de lípidos y es importante para el mantenimiento del elevado consumo metabólico durante el invierno (Guitián, 1984; Fuentes, 1994), sin embargo, el alimento proteico derivado de la ingesta de artrópodos es vital tanto para el crecimiento de los pollos como para la posterior fase de muda de los adultos (Obeso, 1987b; Monros et al., 1997). La alimentación de los pollos la realizan ambos progenitores, siendo arañas, áfidos, y en menor medida pequeñas orugas, las presas más frecuentemente recolectadas (Monros et al., 1997). El tamaño de las presas que los adultos llevan al nido es menor que en otros Parus spp. (media = 4.7 mm, sd = 4.1, n = 906; Monros et al., 1997). Modo de forrajeo Mientras buscan alimento en los árboles, se desplazan más a menudo en un eje horizontal que en un eje vertical. El uso de modos de locomoción depende de la dirección. Saltan sobre todo para dirigirse hacia arriba, mientras que vuelan más frecuentemente cuando se mueven hacia abajo (Brotons, 2007)1. Es un ave de extremada agilidad, fácil de observar adoptando posturas "acrobáticas" en los extremos de ramas finas y grupos de acículas. En un estudio realizado por Carrascal y Tellería (1985) se midió la postura del Carbonero Garrapinos cuando buscaba el alimento, observándosele un 53,5% de las veces en posición horizontal, un 33,4% en posición colgante y un 13,1% en postura vertical (ver Moreno, 1981, para un resultado similar). Esta peculiar postura colgante es una consecuencia combinada de la especialización de la especie a alimentarse en las acículas y las piñas y a un conjunto de adaptaciones ecomorfológicas (Moreno y Carrascal 1993a), entre las que su reducido peso corporal juega un papel preponderante. P. ater presenta una peculiar morfología de la pata, en particular, una corta longitud de los huesos y un retrasado punto de inserción del músculo flexor del tarsometatarso (Moreno y Carrascal 1993a), que le faculta para adoptar una cómoda postura colgante, imposible para la mayoría de especies. La morfología esquelética del Carbonero Garrapinos ha sido comparada con la de otras especies del mismo género para establecer los patrones ecomorfológicos que tratan de explicar la amplia variabilidad de uso de las distintas especies de la postura colgada (Carrascal et al. 1990 y 1994, Moreno y Carrascal 1993b). Según estos estudios, el Carbonero Garrapinos presenta, junto con el Carbonero Común, capacidad intermedia para colgarse entre el Herrerillo Común (el que más se cuelga) y el Herrerillo Capuchino (el que menos lo hace), lo que se refleja en diferencias en la morfología respectiva de sus patas. Barluenga et al. (2001) han apuntado que la menor capacidad de permanecer colgado del Herrerillo Capuchino con respecto al Carbonero Garrapinos debe reflejarse en un mayor engorde diario del primero para afrontar su peor acceso a los recursos alimentarios durante el periodo restrictivo del invierno; sin embargo, otros datos del porcentaje de ganancia diaria de peso con respecto al inicio de la mañana, tomados durante el invierno en el mismo área de estudio, han arrojado resultados contrarios (6.9% para el Herrerillo Capuchino, Polo y Carrascal 1997; 8.9% para el Carbonero Garrapinos, Polo 1999). Barbosa et al. (2000) indican que los individuos menos pesados utilizan más frecuentemente la postura de alimentación colgada que los más pesados y explican esta diferencia por una merma en la capacidad de colgarse con el peso. Sin embargo, dado que el grado de dominancia se correlaciona con la talla corporal en esta especie (Brotons, 1999; V. Polo datos no publicados), y que un estudio experimental no ha arrojado diferencias en el tiempo máximo que los individuos pueden permanecer colgados entre el inicio de la mañana y tras un 8% de ganancia de peso al final de la tarde (L. M. Carrascal y V. Polo, datos no publicados), los resultados de Barbosa et al. (2000) podrían ser explicados si los individuos dominantes (más grandes y pesados) fuerzan a los subordinados (más livianos) a buscar el alimento explotando los sustratos más costosos (i.e., colgantes) desde un punto de vista energético. Almacenamiento de alimento El Carbonero Garrapinos construye diariamente almacenes externos de alimento (Brotons y Haftorn, 1999; Brotons, 2000a), una adaptación conductual, típica de especies residentes, que le permite sobrevivir durante las fases más duras del invierno, cuando el alimento se vuelve más escaso e impredecible y los gastos de termorregulación se disparan (Senar y Borras, 2004). Esta estrategia le permite estabilizar los aportes energéticos sin necesidad de acarrear cantidades elevadas de grasa corporal, que aumentarían las demandas energéticas en movilidad, les obligaría a buscar más alimento y aumentaría el riesgo a ser depredados. En este punto, destacan los trabajos realizados por Lluís Brotons sobre el papel de variables como la estacionalidad, la dominancia, el sexo, la edad, el estatus de residencia y la presencia de conespecíficos en los patrones de almacenamiento de una población pirenaica durante el otoño y el invierno. Los Carboneros Garrapinos almacenan, sobre todo piñones, en el tronco (30% de ocasiones) y las ramas gruesas (50% de observaciones), a una altura media y baja sobre el suelo, que son las zonas de menor uso y, por tanto, menos expuestas a posibles robos por competidores (Brotons y Haftorn, 1999; Brotons, 2000a). Hay acusadas variaciones geográficas en los patrones de almacenamiento (Brotons y Haftorn, 1999), que pueden ser explicadas por diferencias poblacionales en las presiones de competencia entre individuos y en los condicionantes ambientales de oferta de alimento. La localización de los almacenes no es al azar sino que usan en un 95% de las ocasiones las partes inferiores y laterales de las ramas y tan solo un 5% de las veces las partes superiores, más visitadas por conespecíficos y más propensas a ser cubiertas por la nieve y heladas (Brotons y Haftorn, 1999; Brotons, 1997a). Un estudio sobre variación estacional en la tasa de almacenamiento, en una población del Pirineo, mostró un incremento de dicha tasa hasta alcanzar un máximo en noviembre (hasta 6 piñones/10 min), con un posterior descenso hacia la primavera (Brotons 2000a). No aparecieron diferencias sexuales en la capacidad de almacenamiento. Los almacenes se realizan preferentemente dentro de un radio de 5 m del centro geométrico del área de campeo, cuando no hay competidores observando (Brotons, 2000a). Los adultos residentes utilizan lugares más protegidos frente a robo y a inclemencias del tiempo, situados en las partes más interiores del árbol, mientras que los juveniles y los adultos transeúntes se ven forzados a almacenar en lugares más vulnerables (zonas externas y elevadas del árbol) en los extremos del día (Brotons, 2000a). Brotons (2000a) no observó un claro patrón horario en el ritmo de almacenamiento (pero ver, sin embargo, el modelo propuesto por McNamara et al. (1990) para un patrón horario en los ritmos de almacenamiento/recuperación). Barbosa et al. (2000), en una población residente en un bosque de coníferas del centro de España, encuentran que la capacidad de almacenamiento de los individuos subordinados solo se encuentra mermada con respecto a la de los dominantes cuando estos se hallan presentes. Rutinas diarias de engorde La ingesta total en el día es del orden de 2 g en peso seco (que suponen una energía de 55 kJ) para individuos mantenidos en cautividad con acceso no restringido al alimento (Polo y Bautista 2002; ver Moreno (1981), para un balance diario similar medido con agua doblemente marcada en individuos libres). Esta ingesta tiene que hacer frente a la energía necesaria para mantener las actividades rutinarias durante el día más el incremento de unos 0,8 g de reservas de grasa, usados en termorregulación durante el periodo inactivo de la noche. El balance de actividades llevadas a cabo por el Carbonero Garrapinos depende, como en cualquier ave pequeña, de la adecuada gestión de sus reservas energéticas, fundamentalmente grasa subcutánea. A este respecto, Polo y Carrascal (1998) han mostrado una relación entre la condición física de los individuos durante el invierno y la capacidad de regenerar plumas perdidas en la cola con un experimento de campo con 22 individuos de la Sierra de Guadarrama (Madrid). A todos los individuos les fueron retiradas las quintas plumas rectrices y se les mantuvo en grandes aviarios al aire libre con acceso ad libitum al alimento, por un periodo de unos dos meses (un mes para el inicio de la regeneración y otro para el crecimiento de la pluma), hasta su regeneración, en su caso. Los 8 individuos que no regeneraron las plumas en este periodo mostraron una condición corporal inferior, medida como el peso corporal corregido por la longitud del tarso-metatarso, que los 14 que si las repusieron. En estos últimos, el par de plumas de la cola crecidas durante la época restrictiva del invierno fue de menor tamaño y mostró mayor grado de asimetría que el par de plumas crecidas en la muda normal a finales del verano. El engorde diario viene determinado por unas reglas mucho más complejas de lo que pudiera parecer a simple vista (Polo, 1999; Polo y Bautista, 2006a), en el que las pequeñas aves se encuentran enfrentadas a un constante compromiso entre el riesgo de perecer de inanición, cuando sus reservas de grasa son bajas, y el de ser capturadas por un depredador o gastar demasiada energía para desplazarse, cuando acarrean pesos excesivos. Polo y Bautista (2004, 2006a) determinan que la forma de la trayectoria de engorde con la hora del día debe ser exponencial cuando el factor dominante al que se enfrentan las aves es el riesgo a sufrir depredación (figura 1a), y decelerada cuando el factor dominante es el riesgo a perecer de inanición (i.e., con rápidos incrementos del peso al comienzo de la mañana, cuando sus reservas son más bajas, Polo y Bautista (2006b); ver figura 1b). En general, ambos factores están presentes, aunque su importancia relativa va cambiando con el transcurso del día, lo que determina formas peculiares en las trayectorias de engorde, caracterizadas por rápidos engordes al inicio de la mañana y al final de la tarde y pequeñas variaciones del peso hacia el mediodía (Polo y Bautista (2004), 2006a; ver figura 1c). En un trabajo de campo, con 522 capturas/recapturas de 18 individuos procedentes de una población invernante en un bosque de Pinus sylvestris de la Sierra de Guadarrama (Polo, 1999), y en un experimento con 12 individuos mantenidos con fotoperiodo de 9h de luz y alimento ad libitum (Polo 1999), se observó: 1) que durante la noche los individuos gastan gran parte de sus reservas (8,9% de descenso de peso con respecto al peso al final de la tarde, rango 7-11%) para mantener la temperatura corporal y que estas reservas se recuperan durante el día siguiente; 2) que el gasto nocturno es tanto mayor cuanto mayor es el nivel de reservas al inicio de la noche y cuanto más peso se gana durante el día anterior; y 3) que tras primera media hora de la mañana, la forma en la que los Carboneros Garrapinos ganan peso es mayoritariamente acelerada.
Figura 1. Engorde diario del Carbonero garrapinos en función del riesgo de depredación (a) y del riesgo a perecer de inanición (b); la importancia relativa de ambos factores va cambiando con el transcurso del día, lo que determina rápidos engordes al inicio de la mañana y al final de la tarde y pequeñas variaciones del peso hacia el mediodía.
Dos experimentos de laboratorio con oferta variable de alimento, el primero con 8 P. ater aislados sometidos a fotoperiodo de 9,5h de luz (Polo y Bautista 2006b), y el segundo con 4 bandos de 4 individuos sometidos al mismo fotoperiodo (Polo y Bautista, 2000), pusieron a prueba alguna de las predicciones de un modelo general de Polo y Bautista (2006a) sobre estrategias diarias de engorde. Los resultados confirmaron que el Carbonero Garrapinos anticipa el proceso de adquisición de las reservas de grasa a las primeras horas del día y reduce su movilidad cuando se enfrenta a alimento escaso o impredecible (Polo y Bautista, 2006b) y que los individuos más subordinados del bando, al ser desplazados por los dominantes de las fuentes directas de alimento, presentan mayores fluctuaciones de su nivel de reservas, con lo que tienen que afrontar mayor riesgo de perecer de inanición que los dominantes (Polo y Bautista, 2000). Sin embargo, aun queda por demostrar en que medida este segundo resultado pueda ser aplicado a condiciones de libertad, pues los individuos subordinados podrían compensar el acceso reducido a las fuentes directas de alimento con un mayor conocimiento de su entorno y un mayor acceso a nuevas fuentes de alimento. Además, P. ater tiene la facultad de recuperarse rápidamente de drásticas reducciones en el acceso al alimento de duración limitada. Así, en un experimento con 12 individuos aislados se comprobó que la pérdida de peso tras 1h de ayuno hacia el mediodía (rango 0,2–0,3g) fue recuperada en la hora siguiente cuando el acceso al alimento fue ad libitum, lo que implica tasas de ganancia de peso tan elevadas como 0,65g/h (Carrascal y Polo, 1999). El elevado coste de la actividad de vuelo tiene un efecto directo sobre la regulación del peso corporal en las pequeñas aves. En un trabajo de campo, con 259 capturas/recapturas de 17 P. ater en la Sierra de Guadarrama (Madrid), se estudió el efecto de un descenso irreversible del 5-7% en superficie alar (mediante la retirada de la 7ª primaria) sobre el peso corporal (Carrascal y Polo, 2006). Un segundo experimento, con 9 individuos mantenidos en grandes aviarios al aire libre y alimento ad libitum, permitió analizar el efecto de una manipulación reversible de la misma magnitud (uniendo y liberando las primarias 6ª y 7ª) sobre el peso, el acceso a las fuentes de alimento y la actividad de vuelo (Carrascal y Polo, 2006). Tanto el trabajo de campo como el experimento mostraron un despreciable efecto de la reducción de superficie alar sobre el peso promedio en la población. Sin embargo, cuando se analizó el efecto separadamente en los individuos, se observó que la manipulación provocó un descenso del peso directamente proporcional a la talla del ave (en el trabajo de campo) y un descenso de la actividad de vuelo, pero no del peso, directamente proporcional al tamaño de las alas, corregida por el peso corporal. Son pues los individuos de mayor talla y los de alas más pequeñas para su talla los que tienen que afrontar mayores costes debidos a la actividad de vuelo. Estos resultados apoyan la existencia de un efecto conductual en los procesos de regulación del peso debido a los costes energéticos de vuelo. En otro experimento Polo y Carrascal (1999b) pusieron a examen una predicción funcional, según la cual el grado de asimetría entre plumas derecha e izquierda del ala debe ser inferior a la observada entra las plumas de la cola, ya que generar plumas muy simétricas es costoso y son las plumas del ala las que más directamente afectan a la aerodinámica del vuelo. Los resultados, en 21 individuos capturados en una población de la Sierra de Guadarrama (Madrid), confirmaron una mayor asimetría de las 5ª plumas rectrices (0,2 mm en diferencia absoluta entre pluma derecha e izquierda) que de las 7ª primarias del ala (0,1 mm). Como un resultado adicional, se comprobó la ausencia de correlación entre el grado de asimetría en la pluma del ala y de la cola dentro de un mismo individuo, lo que es una prueba en contra del grado de simetría como un indicador de calidad individual. El estatus de residencia y otras variables como la fecha y la temperatura también afectan a los patrones diarios de ganancia del peso del Carbonero garrapinos. El promedio diario de peso corporal se incrementa con el avance hacia el invierno, a una tasa de 0,03g/10 días (Polo, 1999), y con el descenso de la temperatura ambiente, a razón de 0,023g/ºC (Polo, 1999; Broggi y Brotons, 2001). Los resultados de un trabajo de campo en una población invernante en un bosque de coníferas del este de Pirineos mostró un incremento del grosor de los paquetes subcutáneos de grasa en los individuos transeúntes con respecto a los adultos residentes (Broggi y Brotons, 2001). Esto es debido a que los individuos transeúntes tienen un menor acceso a las fuentes de alimento y, como consecuencia, incrementan sus reservas de grasa para hacer frente a un riesgo incrementado a sufrir inanición (Broggi y Brotons, 2001). La temperatura y el nivel de reservas son dos factores importantes para la regulación de la pérdida de peso durante la noche cuyos efectos están asociados en condiciones naturales. Para investigar si la temperatura ambiental actúa como un factor proximal en la regulación del peso corporal durante la noche, se diseñó un experimento en cautividad en el que se manipuló la temperatura ambiental. La pérdida de masa corporal dependió del nivel de peso al anochecer y de la ganancia de peso el día anterior. Las mayores tasas de pérdida de peso durante la noche tuvieron lugar cuando las aves terminaron el periodo diurno del día anterior con los niveles de reserva más altos obtenidos después de elevadas tasas diurnas de incremento de peso. Sin embargo, cambios impredecibles en la temperatura ambiental no tuvieron influencia en la pérdida de peso durante la noche, lo que sugiere que las aves intentan mantener sus reservas dentro de márgenes estrechos cuando la temperatura ambiental es impredecible (Polo y Carrascal, 2008).1 Los carboneros garrapinos invernantes muestran patrones de ganancia de peso en los que las poblaciones meridionales (centro de España), con días más largos, tienen una mayor tendencia a retrasar la ganancia de peso hasta el final del día que los de poblaciones septentrionales (Escocia). Este patrón no es fijo pues responde bajo condiciones experimentales al fotoperiodo, lo que sugiere que las aves ajustan sus reservas energéticas en función de factores intrínsecos y extrínsecos (Polo et al., 2007).1
Bibliografía Barbosa, A., Barluenga, M., Moreno, E. (2000). Effects of body mass on the foraging behaviour of subordinate Coal Tits Parus ater. Ibis, 142: 428-434. Barluenga, M., Barbosa, A., Moreno, E. (2001). Differences in daily mass gain between subordinate species are explained by differences in ecological plasticity. Ecoscience, 8: 437-440. Broggi, J., Brotons, L. (2001). Coal Tit fat-storing patterns during the non-breeding season: the role of resident status. Journal of Avian Biology, 32: 333-337. Brotons, L. (1997a). Changes in foraging behaviour of the coal tit Parus ater due to snow cover. Ardea, 85: 249-257. Brotons, L. (2000a). Individual food-hoarding decision in a nonterritorial coal tit population: the role of social context. Animal Behaviour, 60: 395-402. Brotons, L. (2007). Locomotion patterns of foraging coal tits Parus ater in a coniferous forest. Revista Catalana d’Ornitologia, 23: 27-32. Brotons, L., Haftorn, S. (1999). Geographic variation of the storing behaviour in the coal tit Parus ater: role of winter residency and environmental conditions. Ibis, 141: 587-595. Carrascal L. M., Tellería, J. L. (1985). Estudio multidimensional del uso del espacio en un grupo de aves insectívoras forestales durante el invierno. Ardeola, 32: 95-113. Carrascal, L. M. (1984a). Cambios en el uso del espacio en un gremio de aves durante el periodo primavera-verano. Ardeola, 31: 47-60. Carrascal, L. M. (1984b). Organización espacial y temporal de la comunidad de aves de un bosque subalpine de Pinus sylvestris del Sistema Central (Sierra de Guadarrama). Tesis de Licenciatura. Universidad Complutense, Madrid. Carrascal, L. M., Moreno, E., Tellería J. L. (1990). Ecomorphological relationships in a group of insectivorous birds of temperate forests in winter. Holarctic Ecology, 13: 105-111. Carrascal, L. M., Moreno, E., Valido, A. (1994). Morphological evolution and changes in foraging behaviour of island and mainland populations of Blue Tit (Parus caeruleus) – a test of convergence and ecomorphological hypotheses. Evolutionary Ecology, 8: 25-35. Carrascal, L. M., Polo, V. (1999). Coal tits, Parus ater, lose weight in response to chases by predators. Animal Behaviour, 58: 281-285. Carrascal, L. M., Polo, V. (2006). Effects of wing area reduction on winter body mass and foraging behaviour in coal tits: field and aviary experiments. Animal Behaviour, 72 (3): 663-672. Fuentes, M. (1994). Diets of fruit-eating birds: what are the causes of interspecific differences? Oecologia, 97: 134-142. Gonzalez-Cano, J. M. (1981). Predación de ‘Procesionaria del pino’ por vertebrados en la zona de Mora de Rubielos (Teruel). Boletín de la Estación central de Ecología, 10: 53-77. Guitián, J. (1984). Ecología de una comunidad de Passeriformes en un bosque montano de la Cordillera Cantábrica Occidental. Tesis doctoral, Universidad de Santiago. Guitián, J. (1985). Datos sobre el régimen alimenticio de los paseriformes de un bosque montano de la Cordillera Cantábrica occidental. Ardeola, 32: 155-172. Herrera, C. M. (1978). Ecological correlates of residence and non-residence in a Mediterranean passerine bird community. Journal of Animal Ecology, 47: 871-890. Herrera, C. M. (1984). A study of avian frugivores, bird-dispersed plants and their interaction in Mediterranean scrublands. Ecological Monographs, 54: 1-23. Herrera, C. M., Jordano, P., López-Soria, L., Amat, J. A. (1994). Recruitment of a mast-fruiting, bird-dispersed tree: bridging frugivore activity and seedling establishment. Ecological Monographs, 64: 315-344. May, P. G. (1982). Secondary succession and breeding bird community structure: patterns of resource utilization. Oecologia, 55: 208-216. McNamara, J. M., Houston, A. I., Krebs, J. R. (1990). Why hoard? The economics of food storing in tits, Parus spp. Behavioral Ecology, 1: 12-23. Moreno, E., Carrascal. L. M. (1993a). Ecomorphological patterns of aerial feeding in oscines (Passeriformes: Passeri). Biological Journal of the Linnean Society, 50: 147-465. Moreno, E., Carrascal. L. M. (1993b). Leg morphology and feeding postures in four Parus species: an experimental ecomorphological approach. Ecology, 74: 2037-2044. Moreno, J. (1981). Feeding niches of woodland birds in a montane coniferous forest in central Spain during winter. Ornis Scandinavica, 12: 148-159. Obeso, J. R. (1987b). Uso del espacio y alimentación de los Parus spp. en bosques mixtos de la Sierra de Cazorla. Ardeola, 34: 61-77. Polo, V. (1999). Factores que determinan el ciclo diario de ganancia de peso en una población invernal de Carboneros Garrapinos (Parus ater). Tesis Doctoral. Universidad Complutense. Polo, V., Bautista, L. M. (2002). Daily body mass regulation in dominance-structured coal tit (Parus ater) flocks in response to variable food access: a laboratory study. Behavioral Ecology, 13: 696-704. Polo, V., Bautista, L. M. (2004). Estrategias para administrar las reservas de grasa. Cambios diarios en el peso de las aves pequeñas. Quercus, 222: 50-53. Polo, V., Bautista, L. M. (2006a). Daily routines of body mass gain in birds: I. An exponential model. Animal Behaviour, 72 (3): 503-516. Polo, V., Bautista, L. M. (2006b). Daily routines of body mass gain in birds: II. An experiment with reduced food availability. Animal Behaviour, 72 (3): 517-522. Polo, V., Carrascal, L. M. (1998). Relacion entre la condicion fisica invernal y la capacidad de regenerar plumas en el carbonero garrapinos (Parus ater). Ardeola, 45: 201-211. Polo, V., Carrascal, L. M. (1999a). Shaping the body distribution of Passeriformes: habitat use and body mass are evolutionarily and ecologically related. Journal of Animal Ecology, 68: 324-337. Polo, V., Carrascal, L. M. (1999b). Ptilochronology and fluctuating asymmetry in tail and wing feathers in coal tits Parus ater. Ardeola, 1999, 46: 195-204. Polo, V., Carrascal, L. M. (2008). Nocturnal body mass loss in coal tits Periparus ater: the combined effects of ambient temperature and body reserves. Acta Zoologica Sinica, 54 (4): 615-621. Polo, V., Carrascal, L. M., Metcalfe, N. B. (2007). The effects of latitude and day length on fattening strategies of wintering coal tits Periparus ater (L.): a field study and aviary experiment. Journal of Animal Ecology, 76 (5): 866-872. Senar, J. C., Borras, A. (2004). Sobrevivir al invierno: estrategias de las aves invernantes en la Península Ibérica. Ardeola, 51: 133-168. Vila, C., Rodriguez-Teijeiro, J. D. (1992a). Uso del hábitat por un grupo de passeriformes en un abetal pirenaico; caracterización y variación estacional. Historia Animalium, 1: 99-108. Vila, C., Rodriguez-Teijeiro, J. D. (1992b). Resource partitioning in forest passerines: the temporal dimension. Ardea, 80: 383-388 Vila, C., Rodriguez-Teijeiro, J. D., Oliva, F. (1996). Diurnal cycles in microhabitat use by forest passerines: consequences for community structure. Ibis, 138: 308-314. Vicente Polo Dirección actual: Fecha de publicación: 17-10-2005 Otras contribuciones: 1. Alfredo Salvador. 9-04-2010; 2. Alfredo Salvador. 14-04-2016 Polo, V. (2016). Carbonero Garrapinos – Periparus ater. En: Enciclopedia Virtual de los Vertebrados Españoles. Salvador, A., Morales, M. B. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
|
|
|
|
|
|
|