|
Para más información sobre cada apartado hacer click en:
Portada
Identificación
Estatus de conservación
Distribución
Hábitat
Voz
Movimientos
Ecología trófica
Biología de la reproducción
Interacciones entre especies
Comportamiento
Bibliografía
|
Key words: Common shelduck, reproduction, demography.
Biología de la reproducción
Gregarismo y comportamiento territorial
Los tarros blancos suelen formar bandos con cierta cohesión dentro de sus áreas de invernada, lo cual ha sido observado tanto en las poblaciones británicas, ampliamente estudiadas (Patterson, 1982), como en las españolas (Robledano, 1986; Calvo Sendín et al., 1987). Esta cohesión puede conducir a que todas las aves invernantes en una localidad formen una única unidad, si bien el concepto “bando invernal” debe tomarse con flexibilidad ya que no impide que esta unidad se escinda temporalmente en varios subgrupos que explotan diferentes recursos. Fuera de este periodo, las parejas de tarro blanco establecen territorios cuya función es asegurar la alimentación de las hembras durante el periodo de puesta e incubación. Al igual que en otras localidades europeas (Patterson, 1982), en el sureste de España las parejas reproductoras empiezan a abandonar a partir de febrero el bando invernal para visitar los territorios (Robledano, 1986). Walmsley (2015) considera que los censos realizados en el mes de marzo son un buen indicador del tamaño potencial de la población reproductora en cada año. En las Salinas de San Pedro del Pinatar los territorios estuvieron espacialmente separados de la zona de presencia de los bandos invernales, y las parejas los visitaron en fechas más tempranas (principio de febrero), aunque alternando con periodos de retorno al bando invernal. En la laguna de la Mata, en cambio, el establecimiento de los territorios fue algo más tardío (mediados de marzo), y coincidió con la ruptura del bando invernal que previamente ocupaba la misma zona (Robledano, 1986). La definición de territorio es en este caso la de un área defendida no estrictamente excluyente, de manera que las parejas pueden defender sólo una parte del mismo (en torno al punto en que se encuentren), o tolerar temporalmente la presencia de otros individuos en determinados momentos (Patterson, 1982), una particularidad que se añade a lo infrecuente que resulta que las anátidas defiendan un territorio (y además, como en este caso, por ambos miembros de la pareja). En el sureste de España los territorios suelen establecerse zonas de playa fangosa extensa, bordeada por carrizo, o en tramos de orilla en motas salineras desprovistas de vegetación (Figura 1), donde las aves pueden mantener una adecuada vigilancia de otros individuos (Robledano, 1986).
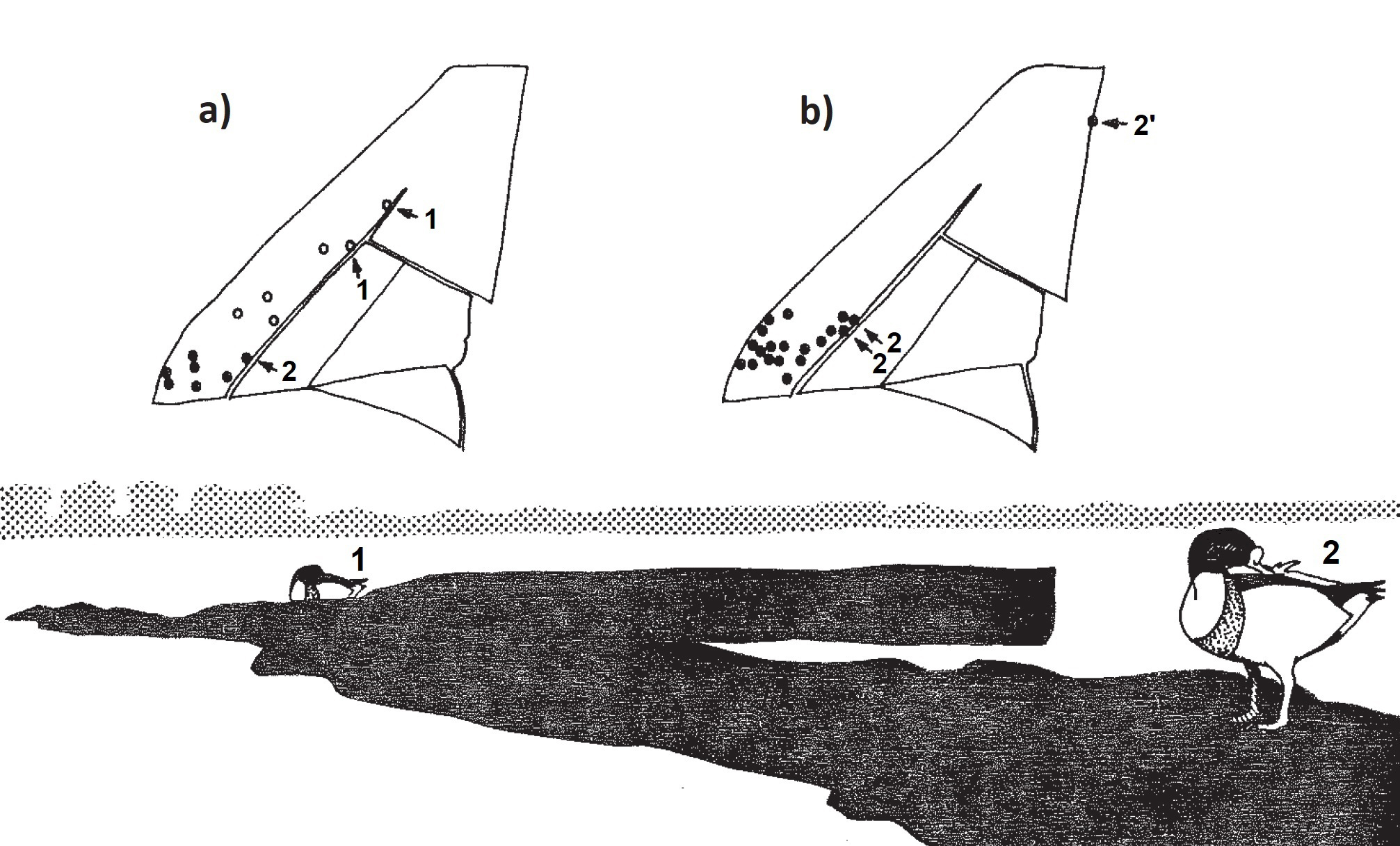
Figura 1. Posiciones y área de desplazamiento de dos machos territoriales de Tarro blanco en las Salinas de San Pedro del Pinatar (Murcia), en abril de 1986: a) 11/04/86; b) 19/04/86; la posición 2’ fue el punto al que se desplazó el ejemplar 2 tras la alteración de la mota salinera ocupada. Según Robledano (1986).
Cortejo
Las exhibiciones de cortejo incluyen la postura erguida del macho (“High-and-erect”, o “Rest-intent”), característica del género Tadorna, con las plumas de la nuca levantadas mientras silba y mantiene la cabeza quieta. Ésta permanece más alta, y el cuello más recto que en la postura de descanso, y algunos autores asocian esta exhibición a un comportamiento de alerta, especialmente en aves objeto de una intensa agresividad. En tierra, los individuos en esta postura pueden mantener el cuerpo levantado de manera que la franja pectoral y la banda abdominal resultan visibles desde el frente. Otra exhibición característica del macho, posiblemente la más llamativa, es la proyección de la cabeza o “Head-throwing”, en la cual la cabeza se retrae y luego se lanza rápidamente hacia arriba y hacia adelante. Este movimiento se repite de forma que la cabeza describe un círculo sobre los hombros. El número e intensidad de los círculos es variable pero siempre se acompaña de silbidos rítmicos y a menudo fuertes. Esta pauta suele ser frecuente en las interacciones prolongadas con otros machos o entre parejas (Figura 2). La hembra responde (y a veces parece inducir la conducta del macho) con un comportamiento incitante (“Inciting”), similar al de otras especies del género y generalmente con las mismas características vocales asociadas. Como en ellas, consta de movimientos laterales marcadamente ritualizados, en los que se mantienen la cabeza y el cuello extendidos, paralelos al suelo (o a la superficie del agua), moviendo entonces la cabeza de un lado a otro, a veces vigorosamente. Además de ésta, la hembra tiene una segunda exhibición de cortejo, el acicalamiento detrás del ala (“Preening-behind-the-wing”), que expone el espejuelo metálico a su pareja. La hembra lo adopta invariablemente cuando el macho regresa de un ataque a un oponente y realiza el mismo acicalamiento ritual en el mismo lado del cuerpo hacia la hembra (Johnsgard, 1965; Patterson, 1982; Kear, 2005).

Figura 2. Macho de tarro blanco atacando a un oponente. © V. Hernández Gil.
En el sureste de España, los machos de tarro blanco adoptaron al menos dos de las posturas características de cortejo, tanto en las proximidades del bando invernal como con su pareja en solitario (Figura 3). Una es estirar el cuello poniendo éste y el pico completamente verticales, inmediatamente después de posarse en alguna zona con la hembra. Puede ser la postura que denominada “Whistle shake”, a la que Patterson (1982) le atribuye significado de alarma débil o respuesta ante una amenaza o ataque de otro individuos. La segunda fue el “Head-throwing. La observación de un macho en esta actitud siempre vino precedida o seguida de ataques a otras aves. El comportamiento correspondiente de la hembra fue el característico “Inciting”), observado a veces como una serie de sacudidas verticales (en vez del típico movimiento lateral). En las Salinas del Rasall, V. Hernández (com. pers.) observó a finales de abril aproximaciones de un macho a su pareja con la cabeza colgante y continuas emisiones sonoras, que podían tener significado de cortejo (Calvo Sendín et al., 1987).

Figura 3. Arriba: posturas características del macho (izquierda y centro) y la hembra (derecha) de Tarro blanco durante el cortejo. De izquierda a derecha: whistle-shake, head-throwing e inciting (Calvo Sendín et al., 1987). (©) V.Hernández Gil.
La cópula tiene lugar en el agua, precedida por rápidos movimientos a nado. El comportamiento precopulatorio incluye vigorosas inmersiones de cabeza por ambas aves mientras nadan, que a veces parecen buceos poco profundos. A menudo, la hembra parece estar huyendo del macho, pero a veces asume una postura sumisa e inmóvil en el agua. Cuando esto sucede, el macho normalmente se acicala detrás del ala antes de montarla, exactamente igual que después de un encuentro agresivo. Luego, cuando la hembra comienza a llamar, el macho agarra su nuca con fuerza y tira de su cabeza hacia atrás, haciendo que ambos giren ligeramente en el agua. Al mismo tiempo, el macho asume una postura alta y erguida (High-and-erect), con el ala opuesta a la hembra ligeramente elevada. Cuando finalmente suelta a la hembra, ella comienza a bañarse de inmediato (Johnsgard, 1965).
Nido
A mediados de marzo los tarros blancos empiezan a prospectar las zonas de nidificación en busca de emplazamientos para el nido (Patterson, 1982). En general, los tarros blancos nidifican en cavidades naturales tales como madrigueras abandonadas de conejo u otras especies de mamíferos, y en troncos huecos de árboles. También en los túneles estrechos que quedan entre los apilamientos de balas de paja, o en cajas-nido, edificios en ruinas, y a veces entre la vegetación más o menos abierta, esto último quizá principalmente en islas. Los nidos en árboles pueden estar en la base del tronco pero también en ramas huecas a alturas de hasta 5 m, y los de pilas de heno hasta a 8 m del suelo. El nido propiamente dicho está hecho de hierba, musgo o helechos, y siempre forrado de plumón. El lugar es elegido por la hembra, que también es la que añade el material vegetal en los sitios abiertos (no en el caso de madrigueras), y puede encontrarse típicamente a distancias de hasta uno o incluso unos pocos kilómetros del agua (Patterson, 1982; Carboneras y Kirwan, 2019).
En las salinas mediterráneas de Francia los tarros blancos nidifican en islotes y diques cubiertos por vegetación halófila densa (Salicornia, Suaeda y Halimione), cuyos tallos se entrecruzan y forman una cobertura densa bajo la cual la actividad de prospección acaba formando túneles al final de los cuales se localiza el nido en una pequeña depresión (Walmsley, 2015). En España se ha citado la nidificación en madrigueras de conejo (en especial en dunas y otros ambientes sedimentarios cercanos a humedales salinos del litoral, pero también en el interior de la Península), entre la vegetación halófila y en cavidades en sustrato rocoso (Calvo Sendín et al., 1987). En el caso de nidos en madrigueras la distancia a la boca no suele ser mayor de 1 m, y sólo unos pocos se encuentran a más de 2 m, mientras que algunos de los situados entre balas de paja llegaban a 5 m (aunque este es un aspecto normalmente difícil de estudiar). Muchas cavidades tienen una curva en el túnel de acceso que impide que la hembra que incuba pueda ser vista desde el exterior. A veces tienen una segunda entrada para huir de potenciales predadores, en otras ocasiones simplemente un ramal ciego donde refugiarse la hembra (Patterson, 1982). Los nidales artificiales instalados en las salinas de San Pedro del Pinatar (caja semienterrada con un conducto de acceso), presuntamente utilizados por los tarros blancos, no tenían más de 1 m de profundidad desde la boca. Los nidos ocupados suelen localizarse entre un gran número de sitios similares no ocupados, salvo que exista un número limitado de emplazamientos, en cuyo caso el mismo puede ser usado en sucesivos años. El grado de reutilización de nidos en años sucesivos es en cualquier caso muy variable, existiendo zonas donde más de un 75% de los emplazamientos de cada temporada eran nuevos, y otras donde la mitad de los sitios eran utilizados al menos en dos de cada tres años. Para las aves, puede ser ventajoso utilizar un nuevo nido cada año -siempre que esto sea posible-, para evitar el desarrollo de parásitos y el aprendizaje de los sitios habituales por los depredadores. En zonas con escasez de sitios, las aves se ven obligadas a reutilizarlos, lo cual incluso ha permitido la recolección de sus huevos por la población local (Patterson, 1982).
Los nidos de dos parejas pueden estar separados menos de 1 m (Kear, 2005), y más de una hembra puede poner en el mismo nido (veáse “Puesta”).
Puesta
La fecha precisa de puesta es difícil de determinar, pero puede inferirse de la primera ocasión en que el macho aparece solitario en el territorio, o de la primera observación de pollos en el agua. En las poblaciones británicas la puesta se extiende entre finales de abril y principios de junio (Patterson, 1982), fenología que se adelanta en el sureste de España. Calvo Sendín et al. (1987), basándose en datos del periodo 1976-85, señalan un rango de puestas entre el 11 de abril y el 20 de mayo en la Laguna de la Mata (n= 9, de las cuáles 6 entre el 1 y 20 de mayo), y entre el 1 de abril y el 30 de mayo en San Pedro del Pinatar (n= 12, con 7 entre el 1 y el 30 de abril). Robledano (1986) estima fechas de puesta incluso más tempranas para esta última localidad, desde mediados de marzo (Figura 4).
Ponen 3-12 huevos de color crema (tamaño medio de la puesta 8,85; n= 140), con un intervalo de un día, siendo sus dimensiones medias 65,6 x 47,3 mm (61-71 x 43-50; n= 175) y su peso medio 79,8 g (65,5-92,5; n= 100) (Kear, 2005).
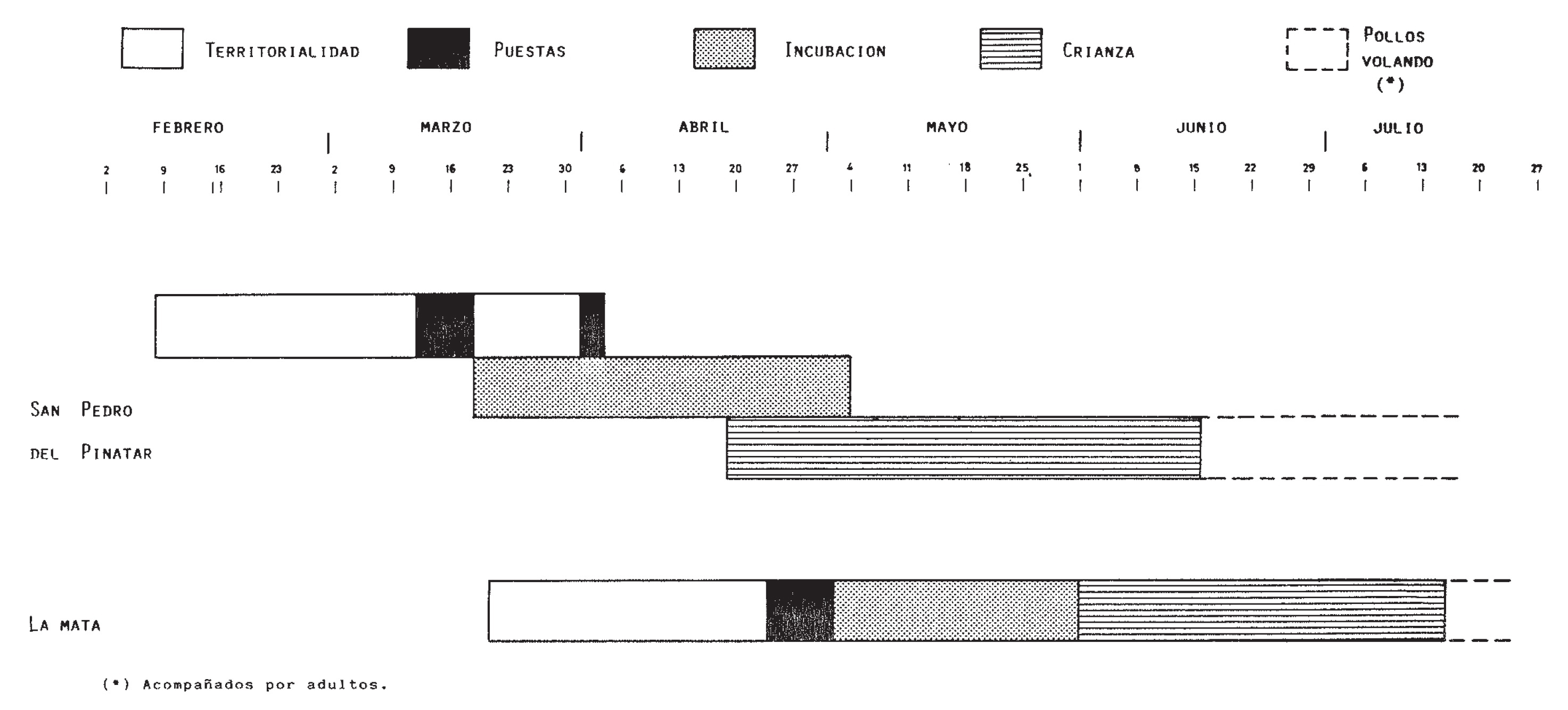
Figura 4. Fenología de la reproducción del Tarro blanco en el sureste de España. Según Robledano (1986).
El parasitismo de puesta intraespecífico no es infrecuente, a juzgar por el número de puestas de más de 12 huevos (Hori, 1969). Aunque algunos autores señalan que no hay indicios de que esto reduzca el éxito de eclosión (Johnsgard, 2010), otros indican que a causa del parasitismo de nidos se pueden perder puestas completas (Kear, 2005). Se trata de una especie que exhibe tasas intermedias de parasitismo intraespecífico, pudiendo éste afectar en algunas zonas al 33% de los nidos aun existiendo abundantes lugares naturales y artificiales de nidificación (Kear, 2005).
Incubación
A veces, dos hembras pueden intentar incubar la misma puesta, y apenas se observa antagonismo dentro de estos nidos “comunales” (Johnsgard, 2010). La presencia de dos hembras en la misma cavidad de nidificación ha sido observada en las Salinas de San Pedro del Pinatar (S. Eguía, comunicación personal). La incubación dura 29-31 días, desarrollando la hembra una placa incubatriz. Durante la incubación, la hembra abandona la puesta 3-4 veces durante las horas de luz para bañarse, arreglarse el plumaje y, sobre todo, alimentarse en el territorio defendido por el macho, siendo escoltada por éste en el vuelo de regreso al nido (Patterson, 1982; Kear, 2005). En el sureste, durante el período de incubación puede observarse a los machos solitarios en actitud vigilante en lugares concretos a los que las hembras realizan cortas visitas. La mayor parte de su permanencia en estos territorios lo dedican las hembras a alimentarse.
Pollos
Los nacimientos y subsiguiente aparición de los pollos en el agua se producen aproximadamente después de un mes de incubación. En el sureste de España se extienden desde mediados de abril hasta finales de mayo (salvo casos excepcionales que se retrasan hasta final de junio), y en las poblaciones británicas desde finales de mayo hasta mediados de julio (Patterson, 1982; Robledano, 1986; Calvo Sendín et al., 1987).
Antes del nacimiento de los pollos, los adultos efectúan vuelos circulares en torno al área de cría si son sorprendidos en ella. En la Laguna de La Mata (Alicante), las aves realizan estos vuelos en torno al nido, antes de posarse en sus inmediaciones (Calvo Sendín et al., 1987). Este tipo de vuelos pueden corresponder con las exhibiciones de distracción que realizan los adultos en presencia de depredadores, vocalizando llamativamente desde el aire (Kear, 2005).
La eclosión es sincrónica, pero se ha observado en un mismo nido a pollos totalmente secos junto a otros que empezaban a romper el cascarón y huevos sin eclosionar, lo cual se atribuye a la realización de puestas por varias hembras (Patterson, 1982). Los pollos son precoces y nidífugos, pesan de media 48,8 g (n= 36) con un día, a los 21 días alcanzan 715 g. Uno o dos días después de la eclosión los pollos son escoltados por los adultos hasta la masa de agua de cría, rica en Artemia y otras fuentes de alimento (Figura 5). Esta puede encontrarse hasta a 3 km del nido o más. Se ha observado transporte de los pollos en el dorso de los adultos (Johnsgard y Kear, 1968). Las nidadas aparecen en estas zonas a lo largo de un período muy amplio, llegando a coexistir pollos recién nacidos con otros ya volantones. Allí se desarrollan y acaban formando “guarderías” (crèches) de hasta de 100 pollos (Calvo Sendín et al., 1987; Kear, 2005; Walmsley, 2015). Estas agregaciones suelen darse en condiciones de alta densidad de nidificantes. Algunos pollos pueden estar consecutivamente hasta en tres guarderías (Williams, 1974). Algunos adultos se quedan a cargo de ellas hasta que los pollos adquieren capacidad de vuelo a los 45-50 días, pero otros adultos abandonan las guarderías a los 20-25 días para iniciar la migración de muda (Kear, 2005). En zonas con muy pocas parejas es frecuente que algunas conserven una total independencia hasta el final de la cría, mientras que en otras parece existir una tendencia a interactuar y terminar cediendo pollos a grupos multifamiliares que a menudo son muy heterogéneos en cuanto a la edad de sus integrantes. Según Patterson (1982) las nidadas mixtas pueden formarse cuando los pollos se mezclan en la búsqueda de alimento, o durante las interacciones agresivas entre parejas.

Figura 5. Pollos de corta edad acompañados por ambos progenitores en las Salinas de San Pedro del Pinatar (Murcia), en zona de reposo en tierra (Robledano, 1986). Arriba izquierda, imagen de fototrampeo que muestra a una hembra acompañando a los pollos en su salida del nido, una madriguera de conejo, en esta misma localidad. (©) S . Eguía Martínez
En los humedales del sureste de España estudiados por Calvo Sendín et al. (1987) el número inicial de de pollos por pareja no fue muy alto, con una media para 17 polladas en San Pedro de 7,52 pollos/pareja, y para 9 polladas en la Laguna de La Mata de 6,44 pollos/pareja, cifras que están por debajo de los valores normales de 8-16 huevos/puesta indicados por la mayoría de autores. Las polladas numerosas fueron escasas mientras abundaban las de menos de 5 pollos, lo cual puede deberse a una alta mortalidad temprana no detectada. La formación de guarderías (crèches) es un fenómeno relativamente reciente en el sureste (Figura 6), aunque parece extenderse a otras regiones españolas, en consonancia con el aumento de la población reproductora.
En el sureste de España, Calvo Sendín et al. (1987) describen una serie de comportamientos de defensa de los pollos que suelen incluir exhibiciones para atraer a los intrusos o depredadores, dejando en ocasiones a los pollos sin atención durante estos displays (ejecutados por uno o por los dos adultos), y que a menudo tienen un cariz más agresivo que de distracción. Normalmente el comportamiento frente a un intruso es alejarse de las orillas a nado, hacia aguas más profundas, movimiento que suele ser promovido por el macho con señales de alerta o simplemente iniciándolo. Si las perturbaciones son más intensas o repentinas, o sorprenden al grupo en ubicaciones desfavorables, los adultos se posarán cerca del intruso, graznando intensamente e intentado atraer su atención hacia la dirección opuesta a donde se encuentran los pollos, dejando a estos solos algunos instantes. Este display lo realizan ambos miembros de la pareja pero siempre es el macho el que más cerca se sitúa del intruso y el que permanece más tiempo intentando distraerle. La hembra mientras tanto se reúne con los pollos que han ganado una posición favorable (a nado o buceando), y finalmente lo hace también el macho. Otro comportamiento con la misma función consiste en que ambos adultos vuelen en círculos alrededor de un intruso, posándose eventualmente cerca de él y con una actitud más intimidatoria que de distracción (a veces incluye ataques y pequeños picados), como demuestra el que estas acciones persistan incluso cuando el intruso se ha alejado.

Figura 6. Pareja independiente con pollos (izquierda) y amalgama (crèche) de pollos de más de una pareja (derecha) en el Embalse de Santomera (Murcia). (©) V . Hernández Gil
En el sureste de España la duración del período de crianza de los pollos se sitúa en torno a las 6-8 semanas. Los jóvenes tarros comienzan a emanciparse y alcanzan su independencia a los 10-12 días de los primeros vuelos. En las Salinas de San Pedro del Pinatar esto sucedíó a principios de agosto, y se prolongó algo más en la Laguna de La Mata. Generalmente, a finales de agosto, los tarros desaparecen de la zona (Calvo Sendín et al., 1987).
Éxito de la reproducción
El éxito de la reproducción, especialmente en lo que se refiere a la proporción de la puesta que eclosiona, es difícil de determinar por la inaccesibilidad de los nidos a la observación (Patterson, 1982). En los nidos con éxito eclosionan casi un 90% de los huevos, aunque cuando la nidificación es comunal es frecuente la pérdida completa de la puesta (Kear, 2005). El éxito considerando puestas completas (porcentaje de puestas que producen al menos un pollo) se sitúa entre el 25 y el 50%. El abandono de la puesta suele producirse al principio de la incubación o durante la propia puesta (lo cual se determina por la duración del periodo en el que el macho es observado solo). El fracaso de la reproducción en esta etapa puede deberse a múltiples causas, pero la depredación o las molestias humanas no son las principales, siendo en cambio relevante la interferencia interespecífica, lo cual resulta en un mayor índice de fracaso en nidos con puesta múltiple. Aunque las evidencias de esto son fragmentarias, sí parece existir una interacción denso-dependiente entre las propias parejas nidificantes, de manera que el número de parejas con pollos disminuye conforme aumenta el número de territorios. Todas las parejas que obtienen un territorio en un año dado parecen intentar la nidificación, no así los individuos no territoriales (Patterson, 1982). Las parejas reproductoras defienden su territorio desde final del invierno, pero cuando crían colonialmente (como diversos autores denominan a la nidificación en situaciones de alta densidad; véase Pienkowski y Evans, 1982), esto no impone un límite invariable al tamaño de las poblaciones, ya que la extensión de los territorios y su grado de solapamiento no están fijados de forma rígida. Existen importantes diferencias en la supervivencia de los pollos dentro de estas colonias, con respecto a las parejas que nidifican de forma dispersa, cuando ambas modalidades coexisten en la misma zona: en las colonias la productividad fue de 0,04 a 0,32 jóvenes emplumados por adulto territorial y año, en comparación con 0,72 a 1,22 en situaciones dispersas. El origen principal de la diferencia fue la mayor supervivencia de los pollos (6 x) en los sitios aislados, asociado a un desarrollo más temprano y a la ausencia de agrupación de nidadas (crèching). Las pérdidas en las situaciones de cría colonial en zonas británicas se debieron principalmente a la depredación por gaviotas argénteas (Larus argentatus) mientras los padres con crías disputaban con otros tarros blancos, lo cual no ocurrió, o fue raro, en sitios aislados (Pienkowski y Evans,1982).
En las Salinas de San Pedro del Pinatar (Murcia) la supervivencia media de los pollos fue del 66% (con respecto al tamaño de las nidadas en su primera observación), y en la Laguna de la Mata del 97,7% (Calvo Sendín et al., 1987, n=4 años y 9 parejas en ambos casos). Aunque en la primera localidad muchas parejas criaban con éxito a todos sus pollos, también era frecuente que otras los perdieran en su totalidad. Esto último sucedió sistemáticamente en las Salinas del Rasall (Murcia), donde una pareja con entre 8-10 pollos entre 1982-84, los perdió todos los años presumiblemente por expolio (lo que ocasionó el cese de la reproducción a partir de 1985, si bien posteriormente se reanudó). En los Embalses del Hondo se registró la supervivencia de 9 de los 12 pollos de una pareja en 1985 (75%)
En el sureste ibérico se ha observado que las nidadas tempranas tenían mayor supervivencia que las tardías (Calvo Sendín et al., 1987).
Estructura y dinámica de poblaciones
Las hembras alcanzan la madurez sexual a los dos años, y los machos a los cuatro o cinco. Con una mortalidad media del 20% en un estudio, la esperanza de vida media es de 4,5 años. El individuo anillado más viejo rondaba los 14,5 años (Kear, 2005). La mayor longevidad que muestran en cautividad las hembras de ésta y otras especies de la tribu Tadornini constituye un hecho único en las aves acuáticas (Hillgart y Kear, 1979). Basándose en recuperaciones de aves anilladas Patterson (1982) estimó una supervivencia media anual en torno al 70% para los adultos y algo superior al 60% para los pollos. La tasa anual de retorno basada en la desaparición de las aves marcadas con anillas de color oscilaba también en torno a ese valor, siendo más constante y mayor en los adultos territoriales (cercana al 90%), y mucho más variable en los no territoriales, lo que podría deberse a su mayor movilidad y emigración.
La mayoría de los jóvenes que mueren lo hacen en los primeros meses después de terminar su desarrollo: cerca de la mitad de los juveniles anillados en Gran Bretaña y recuperados en su primer año de vida fueron hallados muertos en agosto y septiembre. Entre las causas de mortalidad reportadas, sorprendentemente se incluyen disparos (pese a tratarse de una especie protegida), con una mayor proporción de juveniles abatidos en su seis primeros meses de vida (27,3%) frente a aves mayores (14,6%). No existieron diferencias entre la proporción de aves jóvenes muertas por esta causa antes y después de 1967 pero sí en el caso de los adultos, cuya representación disminuyó tras la protección. El resto de causas de mortalidad reportadas fueron minoritarias o genéricas (normalmente una decena de aves o poco más, entre los más de 4.800 tarros blancos anillados hasta 1979): petroleadas, muertas bajo cables eléctricos, envenenadas, enfermas, ahogadas o víctima de diversos accidentes y heridas. Sólo 10 aves habían sido depredadas (por perros, zorros, visones y Halcones peregrinos Falco peregrinus), datos a los que habría que añadir la depredación de pollos por gaviotas y otras aves descrita en el apartado “Depredadores” (Patterson, 1982; Carboneras y Kirwan, 2019). También se han señalado, como causas de mortalidad, las enfermedades y parásitos (Ver “Parásitos y Patógenos”). Los tarros blancos también aparecen fuertemente representados entre las aves muertas durante episodios de frío, que algunos autores atribuyen a la imposibilidad de alimentarse (Walmsley, 2015), si bien puede deberse simplemente a hipotermia, como se ha observado en aves bien alimentadas (Patterson,1982).
Las poblaciones estuarinas británicas parecen mostrar una estabilidad poblacional que no se explica por la supervivencia y reclutamiento de los individuos nacidos localmente, salvo que se considere la inmigración desde otras zonas más productivas (Patterson, 1982; Pienkowski y Evans, 1982). En algunos estuarios, se apunta que un número importante de parejas que crían en pequeños grupos a baja densidad, o incluso aisladas, pueden producir suficientes jóvenes para compensar globalmente la mortalidad adulta. De ello se desprende que la inmigración es posiblemente el principal factor responsable de las fluctuaciones interanuales, al menos en las poblaciones estuarinas más estudiadas, y la que puede asegurar su autosuficiencia demográfica (Patterson, 1982).
Los núcleos reproductores españoles, inicialmente formados por pocas parejas en situaciones de baja densidad, se habrían comportado como las sub-poblaciones británicas dispersas con dinámicas más productivas (aunque en los últimos años algunas podrían estar alcanzando el nivel de las sub-poblaciones más densas). Por otra parte es evidente que gran parte del aumento poblacional español se ha logrado a través de la colonización de nuevas zonas, en ocasiones localidades satélite de los principales núcleos, y más recientemente todo tipo de lugares. Los procesos concretos y los protagonistas de esas colonizaciones recientes son mayoritariamente desconocidos, aunque por norma general el establecimiento de reproductores viene precedido por el uso de esas mismas localidades para invernar (Calvo Sendín et al., 1987; Robledano y Calvo, 1989).
Referencias
Calvo Sendín, J. F., Castanedo García, J. C., García Jiménez, F. J., Ibáñez González, J. M., Mas Hernández, J., Rebollo Castejón, I. D., Robledano Aymerich, F. (1987). El Tarro Blanco Tadorna tadorna (L.) en el sureste español. Anales de Biología,11 (Biología Animal, 3): 3-30.
Carboneras, C., Kirwan, G. M. (2019). Common Shelduck (Tadorna tadorna). En: Del Hoyo, J., Elliott, A., Sargatal, J., Christie, D. A., De Juana, E. (Eds.). Handbook of the Birds of the World Alive. Lynx Edicions, Barcelona. https://www.hbw.com/node/52839
Hillgarth, N., Kear, J. (1979). Diseases of sheldgeese and shelducks in captivity. Wildfowl, 30: 142-146.
Hori, J. (1969). Social and population studies in the Shelduck. Wildfowl, 20: 5-22.
Johnsgard, P. A. (1965). Handbook of Waterfowl Behavior: Tribe Tadornini (Sheldgeese and Shelducks). En: Handbook of Waterfowl Behavior. University of Nebraska, Lincoln. http://digitalcommons.unl.edu/bioscihandwaterfowl/13
Johnsgard, P. A. (2010). Tribe Tadornini (Sheldgeese and Shelducks). Ducks, Geese, and Swans of the World by Paul A. Johnsgard, 8. University of Nebraska, Lincoln. http://digitalcommons.unl.edu/biosciducksgeeseswans/8
Johnsgard, P. A., Kear, J. (1968). A Review of Parental Carrying of Young by Waterfowl. Papers in Ornithology, 32.
Kear, J. (Ed.) (2005). Ducks, Geese and Swans. Oxford University Press, Oxford.
Patterson, I. J. (1982). The Shelduck. A study in behavioural ecology. Cambridge University Press, Cambridge.
Pienkowski, M.W., Evans, P. R. (1982). Breeding behaviour, productivity and survival of colonial and non-colonial shelducks Tadorna tadorna. Ornis Scandinavica, 13: 101-116.
Robledano, F. (1986). La población de Tarro Blanco (Tadorna tadorna) del Sureste de España. Aproximación ecológica y etológica. Tesis de Licenciatura, Universidad de Murcia.
Robledano, F., Calvo, J. F. (1989). La expansión del Tarro Blanco Tadorna tadorna (L.) como reproductor en España. Ardeola, 36 (1): 91-95.
Walmsley, J. G. (2015). The common Shelduck Tadorna tadorna, an important coastal breeding species and bio-indicator of saline environments in the Mediterranean. En: Yésou, P., Sultana, J., Walmsley, J. G., Azafzaf, H. (Eds.). Conservation of Marine and Coastal Birds in the Mediterranean. Proceedings of the UNEP-MAP-RAC/SPA Symposium, Hamamet (Tunisia).
Williams, M. (1974). Creching behaviour of the Shelduck Tadorna tadorna L. Ornis Scandinavica, 5: 131-143.
Francisco Robledano Aymerich
Departamento de Ecología e Hidrología
Universidad de Murcia
Fecha de publicación: 30-03-2020
Robledano, F. (2020). Tarro blanco – Tadorna tadorna. En: Enciclopedia Virtual de los Vertebrados Españoles. López, P., Martín, J. Amat, J. A. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
|