|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Para más información sobre cada apartado hacer click en:
|
Key words: Canary Islands stonechat, reproduction, demography.
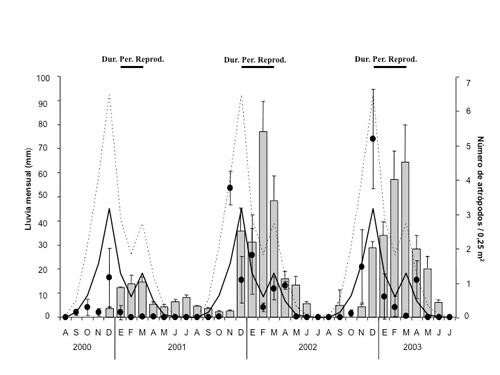
Biología de la reproducción Como ya se ha comentado en otras secciones, la tarabilla canaria vive en los ambientes áridos o semiáridos de Fuerteventura, y esto condiciona en gran medida el desarrollo de sus estrategias vitales. En este entorno de bajo nivel de precipitaciones, las tarabillas son capaces de ajustar su fenología reproductora a la dinámica de las escasas lluvias que acontecen en la isla. Durante tres años (2001-2003) se estudiaron los parámetros reproductores de la especie en todo su rango de distribución (norte, centro y sur de Fuerteventura), que resultaron estar relacionados con la disponibilidad de alimento, que a su vez se correspondió con la cantidad de lluvia caída. Además, el inicio y duración del período reproductor también estuvo relacionado de manera directa con el momento de las precipitaciones y con la cuantía de éstas (Figura 1, Illera y Díaz, 2006).
Figura 1. Relación entre precipitación media anual, disponibilidad de presas y duración del período reproductor. Las líneas gruesas representan la precipitación media anual obtenida durante el período (1989-2003) en cuatro estaciones meteorológicas cercanas a la zona de estudio. Las líneas discontinuas representan el intervalo de confianza (90%) para la lluvia media anual (el intervalo inferior es cero). La disponibilidad de alimento (barras verticales grises) representa el número de invertebrados contados cada mes en 0,25 m2 durante los tres años estudiados. Los puntos negros hacen referencia a los valores medios (± error estándar) de precipitación en cada uno de los meses estudiados. Las barras superiores horizontales indican la duración de la estación reproductora en los tres años estudiados. Según Illera y Díaz (2006).
Una vez empiezan las lluvias otoñales e invernales los machos de tarabilla empiezan a cantar y a defender con mayor agresividad los límites del territorio, actividad de defensa también en la que participan las hembras. Es en este período donde se pueden ver las primeras persecuciones e incluso luchas entre propietarios e intrusos. La construcción del nido recae exclusivamente en la hembra y tiene lugar en pocos días. Los machos entran al interior del nido durante la fase de construcción en contadas ocasiones, pero en ningún caso participan con aporte de material alguno. Los nidos están ubicados, en general, a baja altura bajo rocas y arbustos, o en el interior de oquedades y grietas de muros. La base del nido está construido con palos pequeños de arbustos entrelazados. El interior del nido está tapizado por pelos de cabra u oveja y, en ocasiones, por alguna pluma (J. C. Illera, datos no publicados). Las hembras nunca usan o reutilizan nidos antiguos, e incluso (de manera excepcional) pueden llegar a abandonar un nido a medio construir (por razones desconocidas) para empezar uno nuevo en el territorio (J.C. Illera, datos no publicados). En un trabajo recientemente publicado sobre la selección de lugares de nidificación se muestra que la especie selecciona positivamente laderas con pendiente y suelo con cobertura de vegetación, evitando situar los nidos en lugares próximos a núcleos urbanos o en las cercanías de pistas de tierra o muros de piedra (Illera et al., 2010). La puesta puede comenzar en época tan temprana como diciembre, y la última puesta puede ocurrir como muy tarde a principios de marzo (si es puesta de sustitución). Dependiendo del año pueden tener una o ninguna (año seco), o dos (año con niveles de precipitación por encima de 120 mm anuales). La especie puede hacer puestas de sustitución (tanto durante la primera como en la segunda puesta), en el caso de pérdida por factores meteorológicos (fuerte aguacero en donde se inunde el nido o se enfríen los huevos y/o pollos), o por depredación. La segunda puesta se inicia unos diez días después de haber salido los pollos de la primera (Tabla 1; Illera y Díaz, 2006).
Tabla 1. Datos de puesta de tarabilla canaria durante tres estaciones reproductoras consecutivas (2000-2003). Los números corresponden a los días (1 = 1 de diciembre) que tuvo lugar la puesta (tanto para las primeras como las segundas puestas) del primer huevo (día de puesta) en cada nido estudiado, o el día en que el último pollo abandona el nido (día de salida). ES: error estándar. Según Illera y Díaz (2006).
La incubación se realiza exclusivamente por la hembra, e invierte entre 13 y 18 días (media= 16,3 ± 0,3; n=15). Tras la eclosión de los huevos, los pollos son cebados en el nido por ambos progenitores. Los pollos permanecen en el nido entre 14 y 20 días (media= 17,7 ± 0,2; n= 39), para el período 2000-2003 (Illera, 2004b). Una vez fuera del nido los pollos son cebados de manera continuada por los padres por un período que difiere según si es primera puesta o segunda, o si solo hay una puesta. Cuando solo hay una puesta, la ceba de los pollos volanderos puede alargarse hasta más de un mes después de que la prole abandona el nido, aunque las tasas de ceba disminuyen con el tiempo. Los años donde hay dos puestas, la ceba de los pollos volanderos recae, fundamentalmente, en el macho ya que la hembra inicia la construcción y puesta de los huevos pocos días después de que los volantones abandonan el nido (J.C. Illera, datos no publicados). A pesar de que se ha documentado el fenómeno de cría cooperativa, siendo un macho no emparejado el que ayudaría a la pareja (Phillips, 1986; Bibby y Hill, 1987), durante los tres años de seguimiento del período reproductor de parejas marcadas con anillas de color, incluyendo el estudio de las tasas de cebas en más de 15 nidos invirtiendo más de 25 horas de vigilancia continuada sobre los nidos con prismáticos y telescopio (Illera, 2004b; J.C. Illera, datos no publicados), nunca se registró un caso de cría cooperativa. Este resultado puede llevar a concluir que, o bien la cría cooperativa es un comportamiento extremadamente poco común, o, quizás lo más plausible, que los individuos estudiados por Bibby y Hill (1987) no fueron identificados individualmente con anillas de color, por lo que es muy posible que pudieran confundir individuos y pollos volanderos de territorios vecinos. El número de huevos por puesta oscila entre 2 y 5, con medias superiores a 3 en los años con mayor disponibilidad de alimento durante el período reproductor (Tabla 2). Un aspecto llamativo surge al comparar el número de huevos entre la primera y segunda puesta (excluyendo puestas de sustitución). Así, el tamaño de la primera puesta fue significativamente menor que el de la segunda (p < 0,05), tanto en la estación reproductora de 2002, como en la de 2003 (Illera, 2004b; Illera y Díaz, 2006). Los huevos miden de media 17,8 x 14,1 mm (16,0-18,8 x 13,5-14,7 mm; n= 14) (Cramp, 1988). Como puede apreciarse en la Tabla 2, existió variación temporal en la inversión reproductora de la especie. Durante la estación reproductora de 2000-2001 (año marcado por el bajo nivel de precipitaciones y menor disponibilidad de alimento), las parejas de la especie realizaron una única puesta (aunque hubo también parejas que no llegaron a poner a pesar de tener el nido construido). Además, el número medio de huevos puesto en cada nido fue de media menor que en cualquiera de los otros dos períodos reproductores estudiados (Tabla 2). La variación interanual del éxito reproductor fue determinada por el esfuerzo reproductivo, ya que el número de pollos que salieron del nido en función del número de huevos no varió significativamente entre años. El éxito de eclosión también fue muy alto y no varió significativamente entre las primeras puestas de los tres años estudiados, ni entre las segundas puestas de las estaciones 2001-2002 y 2002-2003. Así, de manera general se puede concluir que la puesta de más huevos significó la consecución de más pollos volanderos (Tabla, 2; Illera y Díaz, 2006).
Tabla 2. Componentes del éxito reproductor en la tarabilla canaria (media ± error estándar) para la primera, segunda y puestas de sustitución durante tres estaciones reproductoras (2000-2003). Puesta: número de huevos por nido. Según Illera y Díaz (2006).
Solo se ha registrado un caso de divorcio en la especie, lo que supondría una tasa de divorcio del 1,4%. Independientemente del motivo de tal comportamiento, lo que si pone de manifiesto esta baja tasa reportada es que los cambios de pareja en esta especie son muy raros (Illera, 2005b).
De los 128 nidos estudiados por Illera y Díaz (2006), el 29% fueron depredados, y solo uno fue abandonado debido a que se inundó después de un fuerte aguacero. Del total de nidos depredados, dos (5%) lo fueron durante la incubación, siendo el resto depredados con pollos en el nido. La mayor parte de los nidos fueron encontrados destrozados (67%), comportamiento fácilmente atribuible a los abundantes gatos asilvestrados presentes por toda la isla, aunque tampoco habría que descartar a otras especies introducidas como perros, ratas o erizos morunos (Illera, 2004b). A pesar de encontrar distintas tasas de depredación entre años éstas no fueron significativas. Tampoco existieron diferencias entre eventos depredatorios de primera y segunda puesta (Illera y Díaz, 2006).
Estructura y dinámica de poblaciones Los únicos datos sobre cambios en el tamaño poblacional de la tarabilla canaria provienen de un estudio realizado entre los años 2000-2002 por Illera y Díaz (2008). En este trabajo se determinó el número de territorios establecidos en tres áreas del norte de Fuerteventura a lo largo de tres años. A pesar que se detectaron leves diferencias en cuanto al número de parejas a lo largo de este período estudiado, éstas no fueron significativas ni entre zonas de estudio, ni entre los años analizados (Illera y Díaz, 2008). Si bien no hay estudios detallados que analicen la mortalidad por sexos, es plausible concluir que esta debe ser mayor en las hembras ya que éstas sufren eventos depredatorios durante el momento crítico de incubación (factor que no afecta a los machos) de los nidos o durante los primeros días de vida de los pollos (Illera, 2004b; Illera y Díaz, 2006). Por otro lado, no hay información sobre la proporción de sexos en la población. La primera reproducción tiene lugar en la siguiente estación reproductora, así las aves pueden empezar a criar solo unos meses después de haber salido del nido, o incluso llegar a pasar un año después de dejar el nido (Illera, 2004b). En base a individuos marcados con anillas de colores podríamos afirmar que la longevidad media en esta especie estaría en los cuatro años de media, con un máximo de cinco (Illera, 2004b; Illera y Díaz, 2008).
Referencias Bibby, C. J., Hill, D. A. (1987). Status of the Fuerteventura Stonechat Saxicola dacotiae. Ibis, 129: 491–498. Cramp, S. (Ed.) (1988). Handbook of the Birds of Europe the Middle East and North Africa. The Birds of the Western Palearctic. Volume V. Tyrant Flycatchers to Thrushes. Oxford University Press, Oxford. Illera, J. C. (2004b). Biogeografía y ecología de la Tarabilla Canaria (Saxicola dacotiae) con implicaciones para su conservación. Tesis Doctoral. Universidad de la Laguna. Illera, J. C. (2005b). Divorce in the Canary Islands Stonechat Saxicola dacotiae. The Wilson Bulletin, 117: 317-319. Illera, J. C., Díaz, M. (2006). Reproduction in an endemic bird of a semiarid island: a food mediated process. Journal of Avian Biology, 37: 447–456. Illera, J. C., Díaz, M. (2008). Site fidelity in the Canary Islands stonechat Saxicola dacotiae in relation to spatial and temporal patterns of habitat suitability. Acta Oecologica, 34: 1–8. Illera, J. C., Von Wehrden, H., Wehner, J. (2010). Nest site selection and the effects of land use in a multi-scale approach on the distribution of a passerine in an island arid environment. Journal of Arid Enviroments, 74: 1408–1412. Phillips, B. N. (Ed.) (1986). The Fuerteventura Stonechat Project. International Council for Bird Preservation, unpublished report. Cambridge.
Juan Carlos Illera Javier Seoane Fecha de publicación: 13-01-2012 Illera, J. C., Seoane, J. (2016). Tarabilla canaria – Saxicola dacotiae. En: Enciclopedia Virtual de los Vertebrados Españoles. Salvador, A., Morales, M. B. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||