|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Para más información sobre cada apartado hacer click en:
|
Key words: European Shag, reproduction, demography.
Biología de la reproducción Cortejo y estrategias reproductivas El cormorán moñudo comienza la reproducción muy temprano, ya que algunos machos empiezan a acotar los sitios de nido en el mes de diciembre (la subespecie mediterránea en noviembre). La estrategia reproductiva más frecuente es la monogamia, con un alto porcentaje de copulas extrapareja (Graves et al., 1992, 1993), aunque también se dan casos de parasitismo de nido (Graves y Ortega-Ruano, 1992) y de poliginia (un 4% en las islas Farne), consistentes en el emparejamiento de un macho viejo con dos hembras (Potts, 1968; Potts et al., 1980) e incluso de un macho con tres hembras (Harris, 1982). Los adultos que no están en buenas condiciones para la cría se toman “años sabáticos” (Røv, 1990; Aebischer y Wanless, 1992). En el cormorán moñudo son los machos los que eligen los sitios de nido e intentan atraer a las hembras mediante una serie de movimientos rítmicos de cabeza, conocidos como “dardos”, seguidos de comportamientos ritualizados que se realizan en el territorio (Graves y Ortega-Ruano, 1994; Fig. 1). La frecuencia de “dardos” de los machos influye en el número de aproximaciones de las hembras y en el de cópulas extra-pareja (Graves y Ortega-Ruano, datos no publicados). La frecuencia de “dardos” cambia según la calidad del sitio de nido; en la isla de May (Escocia) se observó cómo los machos de peor calidad, situados en los nidos peores, aumentaban su frecuencia de “dardos” cuando se adueñaban de sitios de mayor calidad aprovechando que sus propietarios se encontraban fuera pescando (Ortega-Ruano, com. pers.). Una vez producido el emparejamiento, éste se mantiene gracias a diversos comportamientos de vínculo (Snow, 1963; Ortega-Ruano y Graves, 1991; Graves y Ortega-Ruano, 1994) (Figura 1). La paternidad extra-pareja oscila anualmente entre 0 y 18%; de media un 12% de las nidadas incluyen un pollo cuyo padre es un macho distinto del que cuida de los pollos (Graves et al., 1993). En la Isla de May existe una fuerte relación entre la paternidad extra-pareja y el éxito reproductivo anual en las colonias. Las hembras tienen cópulas extra pareja especialmente con los machos con un mayor éxito reproductivo, lo que sugiere que seleccionan a los machos de mayor calidad para sus fecundaciones extramaritales (hipótesis genética; Graves y Ortega-Ruano, 1992; Graves et al., 1993).
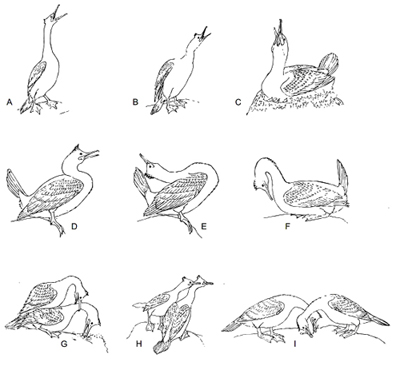
Figura 1. Representación esquemática de los comportamientos sociales estereotipados del cormorán moñudo. (A) conducta post-aterrizaje, (B) amenaza con pico, (C) pico hacia arriba, (D) dardo, (E) cuello hacia atrás, (F) encorvado, (G) monta, (H) baile de cuellos y (I) presentación mutua de material (redibujado de Johnsgard, 1993).
El macho aporta el material de nido (palos, algas, hierbas y otros materiales) y lo presenta a la hembra de forma ritualizada, la cual se encarga de colocarlo (Snow, 1963), construyendo nidos grandes y voluminosos (Figura 2). En otras especies de cormoranes se ha señalado que la construcción del nido debe ser una de las tareas más costosas en la prepuesta (Berry, 1976; Berstein y Maxon, 1984; Cooper, 1986). En las Illas Cíes el tamaño del nido predice el éxito reproductivo (Velando, 1997) y se ha sugerido que las hembras utilizan el volumen de material de nido para la selección de pareja (Velando, 1997).
Figura 2. Cormorán moñudo incubando en su nido. (C) Á. Barros
Cuidado parental Los cormoranes incuban con las membranas interdigitales de las patas; la incubación dura unos 31 días y es realizada por los dos miembros de la pareja. La hembra pone huevos muy pequeños en relación a su tamaño, con un volumen que oscila entre 33,3 y 50,9 cm3 (Asturias: media ± desviación estándar, 44,48 ± 0,44 cm3; n = 151; Galicia: 45,24 ± 0,7 cm3; n = 579, datos propios). La ovoposición provoca un aumento ligero de la tasa metabólica basal, únicamente del 0,06 % (Astheimer y Grau 1990; Grau, 1996). Se ha encontrado una relación fuerte entre el tamaño del huevo y la edad de la hembra: las hembras de mayor edad ponen huevos más grandes (Snow, 1960; Coulson et al., 1969; Amundsen y Stokland, 1990). En la Isla de May, se han documentado casos de segundas puestas en una temporada que culminaron con éxito (Wanless y Harris, 1997). Los pollos permanecen en el nido unos 50 días (Velando et al., 2000), durante los cuales son atendidos por ambos padres (Snow, 1963). Pasado ese tiempo, los jóvenes del año se agrupan en ‘guarderías’ y allí siguen siendo cebados por sus padres durante 40 días más (Velando, 2001), tras lo cual se independizan por completo (Daunt et al., 2007b). En las guarderías existe una jerarquía social que afecta a la situación en el posadero y a las molestias e intentos de cleptoparasitismo por otros juveniles cuando son cebados por los padres, siendo los pollos más tempranos los más dominantes (Velando, 2000, 2001). La función de las denominadas ‘guarderías’ puede que no esté relacionada con su denominación, i.e. protección y vigilancia por los adultos. Las aves del año, especialmente los machos, compiten entre sí por los mejores sitios, poniendo en práctica patrones de comportamiento importantes en su vida como adultos (Carter y Hobson, 1988; Velando, 2001). Otras funciones de las guarderías pueden ser el mantenimiento del calor corporal y la defensa frente al comportamiento agresivo de los adultos y de los depredadores (Davis, 1982; Evans, 1984). Los juveniles entran y salen del posadero, realizan ejercicios de natación (nadan, bucean, y chapotean) y vuelan siguiendo a los adultos, presumiblemente hacia las zonas de alimentación (Velando, 2001). Fecha y tamaño de puesta La fecha de puesta está condicionada por factores climatológicos, como la temperatura, el viento y la luz, aunque el factor más importante es la abundancia de comida a escala local (Aebischer, 1986). Existe una alta variabilidad anual en la fecha de la primera puesta. Tanto en el Reino Unido como en la Bretaña francesa se han encontrado nidos incluso en noviembre (Snow, 1960; Cadiou, 1994). En la Península Ibérica las primeras puestas suelen producirse a mediados o finales de febrero. Rodríguez Silvar (1977) cita una primera puesta en la isla de Ons el 20 enero de 1974, mientras que en la colonia de Mar de Fóra (Fisterra, A Coruña) encontró la primera puesta el 1 de febrero de 1975. Además este autor señala que el 90% de las puestas en Mar de Fóra se producen durante la segunda semana de marzo. En Galicia, las primeras puestas tienen lugar entre finales de febrero y la primera decena de marzo (Tabla 1). En Asturias se ha constatado un adelanto en la fecha de puesta del primer huevo en la última década, que parece relacionarse con el aumento de la temperatura registrado en ese periodo (Álvarez y Pajuelo, 2011). En esta región, la fecha de primera puesta para un período de 12 años osciló entre el 15 de enero y el 7 de marzo (D. Álvarez datos propios).
Tabla 1. Fenología de la puesta en la Illa de O Faro (Illas Cíes). Según Velando (1997).
En el cormorán moñudo, la fecha de puesta es un factor determinante en el éxito reproductivo de los individuos (Velando, 1997). El efecto negativo de la fecha de puesta afecta también a la condición de los pollos (reflejado la longitud de los telómeros) lo que puede conllevar consecuencias a lo largo de su vida (Hall et al., 2004). En la isla de May, Aebischer (1993) tuvo la oportunidad de estudiar el efecto de la fecha de puesta en el éxito reproductor gracias a un experimento natural: una tempestad destruyó varios nidos con puestas tempranas y las parejas afectadas reiniciaron sus puestas. El grupo de parejas con puestas retrasadas por el temporal tuvo un éxito reproductor superior al de las parejas tardías, indicando que el efecto de la fecha de puesta sobre el éxito reproductor se debió a que las aves que criaron temprano eran de mayor calidad. La puesta modal del cormorán moñudo es de tres huevos por nido en todas las localidades estudiadas (Asturias: 70.3%; Galicia: 66%), con un rango que oscila entre 1 y 7 huevos (Asturias: 2,6 ± 0,08; n = 54; Galicia: 3,12 ± 0,1; n = 262; datos propios). En las puestas completas, el segundo huevo es un 3% mayor que el primero y un 2,3% mayor que el tercero (Stokland y Amundsen, 1988). En la Tabla 2 se muestran los tamaños de puesta registrados en otras localidades europeas.
Tabla 2. Tamaño medio de puesta del cormorán moñudo en distintas localidades europeas. Fuentes: 1Barret et al., 1986; 2Potts et al., 1980; 3Potts, 1966; 4Snow, 1960; 5Debout, 1985.
Las puestas de más de tres huevos probablemente son debidas a otro tipo de estrategias de comportamiento como el parasitismo o la poliginia. Graves y Ortega-Ruano (1992) en su estudio molecular de la paternidad señalan el caso de un pollo sin relación con la hembra y concluyen que puede deberse a un caso de poliginia (véase asimismo Potts et al., 1980). En las Illas Cíes no resulta infrecuente encontrar huevos solitarios en puntos de la colonia alejados de los nidos, lo que podría indicar intentos fallidos de parasitismo (Velando, 1997). En las Illas Cíes las puestas de más de tres huevos suponen el 17% del total y en general tienen escaso éxito (Velando, 1997). Éxito de eclosión y éxito reproductor En las Illas Cíes se encontró que la causa más importante de la variación en el número de pollos que produce un nido (pollos que llegan a volar) reside en el éxito de eclosión, puesto que un alto porcentaje de huevos (38%) o bien son infértiles, o son abandonados. En la islas Farne la infertilidad es de un 13% (Potts et al., 1980) y en Lundy algo mayor, en torno al 30 % (Snow, 1960). En cambio, una vez que nacen los pollos la supervivencia es elevada: en 1994 la mortalidad fue del 29%, del 4% en 1995 y del 13% en 1996, dependiendo en todos los casos de las condiciones meteorológicas (Velando et al., 1999b). Tanto en las colonias asturianas como en las gallegas existe una correlación significativa entre la precipitación durante los meses de abril y mayo y el éxito reproductor (Velando et al., 1999b; Frederiksen et al., 2008; Álvarez y Pajuelo, 2011). La mortalidad de los pollos ha sido relacionada especialmente con la dificultad que tienen los cormoranes adultos para alimentarse con malas condiciones meteorológicas (Velando et al. 1999b), aunque tampoco son descartables los efectos directos del frío en los pollos. El éxito reproductor, entendido como el número de pollos por pareja que construye un nido, varía entre años y entre colonias. En algunos años con condiciones meteorológicas especialmente adversas, la productividad es muy baja. Por ejemplo, en las Illas Cíes fue tan sólo 0,125 pollos por nido en 1998, mientras que el mínimo en Asturias se registró en 2008, con 0,37 pollos por nido en As Pantorgas y 0,28 en Castríos-Represas. En la Tabla 3 se presenta el éxito reproductor registrado en diversas localidades del norte de la Península Ibérica y en la Tabla 4 el registrado en distintas localidades europeas. Tabla 3. Éxito reproductor en colonias ibéricas. Se presenta el valor promedio ± desviación estándar, el rango y el número de años con datos por localidad. Fuente: datos propios.
Tabla 4. Éxito reproductor del cormorán moñudo en otras localidades españolas y en distintas regiones de Europa. Fuentes: 1Álvarez y Velando, 2007; 2De Pablo, 2005; 3Barret et al., 1986; 4Walsh y Brindley, 1994; 5Potts et al., 1980; 6Aebischer, 1993; 7Olsthoorn y Nelson, 1990; 8Snow, 1960.
Crecimiento de los pollos Los pollos del cormorán moñudo, como los de todos los pelecaniformes, son nidícolas y nacen completamente desnudos de plumón (Figura 3), motivo por el que son continuamente cubiertos por ambos padres hasta los 13-15 días de vida, cuando empiezan a regular su propia temperatura corporal (Østnes et al., 2001). Ante situaciones de restricción del alimento, priorizan el crecimiento corporal diario; para ello reducen sus tasas metabólicas, la temperatura corporal y el tamaño de ciertas vísceras y músculos, mientras que aumentan el consumo de las reservas de grasa (Møe et al., 2004).
Figura 3. Pollo de cormorán moñudo recién eclosionado. © D. Álvarez
En las Illas Cíes, sobre una muestra de 130 pollos, el peso corporal y la longitud del tarso fueron los parámetros con una tasa de crecimiento más rápida (Tabla 5). La longitud del culmen y del ala tuvo un crecimiento muy similar, mientras que la cabeza fue la medida que creció con mayor lentitud. El máximo aumento de peso se produjo en machos y hembras hacia el día 20 de vida, si bien a partir de ese mismo día los machos ganaron peso más rápidamente que las hembras, un 18% frente a un 17%. De esta forma, a los 35 días los machos fueron claramente más pesados que las hembras (machos 1614 ± 12.8 g; hembras 1406 ± 13.0 g (Velando, 1997). Los machos son el sexo más costoso de criar, lo que puede influir en las estrategias individuales de proporción de sexos. Así, las hembras más tempranas, que se encuentran en mejor condición, tienen puestas sesgadas hacia los machos (Velando et al., 2002).
Tabla 5. Picos de máximo incremento diario en las variables morfométricas (mm/día) y peso corporal (g/día) en machos y hembras de cormorán moñudo. Según Velando (1997).
Vínculo de pareja Potts et al. (1980), en su estudio de las colonias de las islas Farne, señalan una asociación entre el vínculo de pareja y la fidelidad al sitio de cría: los machos que tuvieron éxito en las temporadas previas conservaban la pareja y el sitio de cría. Por su parte, Aebischer et al. (1995), al estudiar la fidelidad a la pareja y al sitio de cría en la isla de May y en las islas Farne, encontraron que el 75 % de los sitios ocupados el año anterior volvían a ocuparse al año siguiente, mientras que las aves que se mudaban escogían sitios que habían sido ocupados durante la estación reproductora anterior. En el 31% de los casos se produjeron divorcios, los cuales fueron más frecuentes entre los machos que se habían movido y estuvieron en función de la distancia a la que se habían trasladado. Un 83% de las hembras permanecieron fieles a los machos que repitieron sitio de cría, frente a un 6% de los machos que se mudaron de sitio. Estos autores proponen que, al comenzar la temporada de cría, las hembras regresan al emplazamiento que ocuparon el año anterior, asociándose con su pareja si ésta se encuentra en las inmediaciones; en caso contrario, buscarían otro macho.
Coloniabilidad En las Illas Cíes, un estudio sobre la estructura espacial de los nidos (Velando y Freire, 1999b, 2001), reveló una agregación de parejas de baja calidad alrededor de parejas de alta calidad. En estas islas, el 75 % de los nidos se construyen en un sitio que fue ocupado en la estación anterior y el resto en un sitio nuevo; la calidad de los sitios nuevos y el éxito reproductor de las parejas que los ocupan son significativamente inferiores a los reocupados (Velando, 1997). En esta especie, los machos van adquiriendo los mejores sitios para criar con la edad y la experiencia (Aebischer et al., 1995; Daunt et al., 1999). Fundamentalmente son los reclutas los que ocupan los sitios nuevos (Velando y Freire, 1999b). Además, los machos con mayor experiencia y en mejores condiciones llegan antes a las colonias, se hacen con los mejores sitios y tienen hijos de mayor calidad, mientras que los jóvenes, al llegar más tarde, quedan relegados a los peores sitios (Potts et al., 1980; Aebischer, 1985, 1993; Aebischer y Wanless, 1992; Daunt et al., 2001a). Pueden existir dos presiones selectivas para que aves de baja condición y jóvenes críen cerca de individuos de mayor calidad o edad. Una sería la posibilidad de obtener cópulas extramaritales por parte de la hembra (Graves et al., 1993) y otra las posibilidades de cambiar de pareja o de sitio de cría en la siguiente estación. En el cormorán moñudo existe una estrecha relación entre el divorcio y la fidelidad al sitio del nido, pues los cambios de pareja se producen con aves que habían criado en las inmediaciones del nido el año anterior (Aebischer et al., 1995).
Estructura y dinámica de poblaciones Supervivencia y longevidad La mortalidad de los pollos parece afectada por el orden de nacimiento en la nidada pero sólo en algunas localidades. Así en las Islas Británicas se ha reportado que el último en nacer crece menos y sufre mayor mortalidad en las nidadas de dos y de tres pollos (Snow, 1960; Nelson, 1964; Amundsen y Stokland, 1988). Sin embargo, un estudio realizado en las Illas Cíes durante los años 1994 y 1995 no encontró efectos negativos en el crecimiento o supervivencia del tercer pollo, el cual creció de igual forma que el resto (Velando, 1997). Así, los efectos del orden de nacimiento en la supervivencia de los pollos podrían ser significativos sólo en localidades o años con estrés alimentario. Las condiciones tempranas que experimentan los cormoranes afectan a su posterior supervivencia; en concreto, los niveles altos de estrés oxidativo en volantones afectan negativamente a la probabilidad de reclutamiento (Noguera et al., 2012). Una vez que abandonan el nido, la supervivencia es menor durante el primer año y aumenta durante los tres primeros años de vida en todas las localidades estudiadas (Tabla 6). Los cormoranes juveniles son menos eficaces que los adultos a la hora de alimentarse (Carss, 1993; Daunt et al., 2007a); compensan esta deficiencia dedicando más horas del día a pescar, lo que explica el hecho de que la mayor tasa de mortalidad de las aves jóvenes se dé en los meses de enero y febrero, cuando los días son más cortos (Daunt et al., 2007b). Una vez que llegan a la edad adulta no se han encontrado diferencias en la supervivencia con la edad (Harris et al., 1994a, 1994b). En Europa la longevidad máxima registrada para el cormorán moñudo corresponde a un ave encontrada muerta en un arte de pesca en Noruega a la edad de 17 años (Staav, 1998). La longevidad máxima registrada en la Península Ibérica corresponde a un ave anillada en junio de 1994 en la Illa de O Faro, en el Parque Nacional de las Illas Atlánticas de Galicia, que fue observada en una colonia de la misma isla en mayo de 2012, es decir, con 18 años de vida (datos propios).
Tabla 6. Parámetros poblacionales de diferentes colonias de cormorán moñudo. Los datos están tomados de: 1Aebischer (1986, 1995), 2Potts (1968) y Potts et al. (1980), 3Velando y Freire (2002) y 4Álvarez (datos no publicados).
Las condiciones climáticas pueden afectar a la dinámica de poblaciones. En años en los que la oscilación del Atlántico Norte (NAO) fue positiva, la sex-ratio de volanderos estuvo desviada hacia las hembras y en años en que fue negativa, estuvo desviada hacia los machos. Las hembras se dispersaron a mayores distancias en años en los que la oscilación del Atlántico Norte fue positiva y hubo una mayor producción de hembras, mientras que los machos se dispersaron más en años en los que la oscilación del Atlántico Norte (NAO) fue negativa (Barros et al., 2013)1.
Referencias Aebischer, N. J. (1985). Aspects of the biology of the shag (Phalacrocorax aristotelis). Tesis doctoral no publicada. Universidad de Durham. Aebischer, N. J. (1986). Retrospective investigation of an ecological disaster in the Shag Phalacrocorax aristotelis: a general method based on long term marking. Journal of Animal Ecology, 55: 613-619. Aebischer, N. J., Wanless, S. (1992). Relationships between colony size and enviromental conditions for Shags Phalacrocorax aristotelis on the Isle of May, Scotland. Bird Study, 39: 43- 52. Aebischer, N. J. (1993). Inmediate and delayed effects of a gale in late spring on the breeding of the Shag Phalacrocorax aristotelis. Ibis, 135: 225-232. Aebischer, N. J. (1995). Philopatry and colony fidelity of Shag Phalacrocorax aristotelis on the east coast of Britain. Ibis, 137: 11-28. Aebischer, N. J., Potts, G. R., Coulson, J. C. (1995). Site and mate fidelity of Shags Phalacrocorax aristotelis at two British colonies. Ibis, 137: 19-28. Álvarez, D., Pajuelo, M. A. (2011). Southern populations of European shag Phalacrocorax aristotelis advance their laying date in response to local weather conditions but no to large-scale climate. Ardeola, 58: 239-250. Álvarez, D., Velando, A. (2007). El Cormorán moñudo en España y Gibraltar. Población en 2006-2007 y método de censo. SEO/Birdlife. Madrid Amundsen, T., Stokland, J.G. (1988). Adaptive significance of asynchronous hatching in the shag: a test of the brood reduction hypothesis. Journal of Animal Ecology, 57: 329-344. Amundsen, T., Stokland, J. G. (1990). Egg size and parental quality influence nestling growth in the shag. Auk, 107: 410-413. Astheimer, L. B., Grau, C. R. (1990). A comparison of yolk growth rates in seabird eggs. Ibis, 132: 380-394. Barrett, R. T., Strann, K.-B., Vader, W. (1986). Notes on the eggs and chicks of North Norway Shags Phalacrocorax aristotelis. Seabird, 9: 73-83. Barros, A., Alvarez, D., Velando, A. (2013). Climate Influences Fledgling Sex Ratio and Sex-Specific Dispersal in a Seabird. Plos One, 8 (8): e71358. Bernstein, N. P., Maxon, S. J. (1984). Sexual distinct daily activity patterns of blue-eyed shags in Antartica. The Condor, 86: 151-156. Berry, H.H. (1976). Physiological and behavioural ecology of the Cape Cormorant Phalacrocorax capensis. Madoqua 8, 59-62. Cadiou, B. (1994). Un évènement rarissime: L'Élevage de deux nichées avec succès par un couple de cormorans huppés Phalacrocorax aristotelis. Alauda,62: 134-135. Carss, D. N. (1993). Shags Phalacrocorax aristotelis at cage fish farms in Argyll, Western Scotland. Bird Study, 40: 203-211. Carter, H. R., Hobson, K. A. (1988). Creching behavior of brand's cormorant chicks. Condor,90: 395-400. Cooper, J. (1986). Biology of the Bank Cormorant, Part 4: Nest construction and characteristics. Ostrich, 57: 170-179. Coulson, J. C., Potts, G. R., Horobin, J. (1969). Variation in the eggs of the shag Phalacrocorax aristotelis. Auk,86: 232-245. Daunt, F., Wanless, S., Harris, M. P., Monaghan, P. (1999). Experimental evidence that age-specific reproductive success is independent of environmental effects. Proceedings of the Royal Society, 266: 1489-1493. Daunt, F., Monaghan, P., Wanless, S., Harris, M.P., Griffiths, R. (2001a). Sons and daughters: age-specific differences in parental rearing capacities. Functional Ecology 15, 211-216. Daunt, F., Wanless, S., Harris, M. P., Money, L., Monaghan, P. (2007a). Older and wiser: improvements in breeding success are linked to better foraging performance in European shags. Functional Ecology, 21: 561-567. Daunt, F., Afanasyev, V., Adam, A., Croxall, J. P., Wanless, S. (2007b). From cradle to early grave: juvenile mortality in European shags Phalacrocorax aristotelis results from inadequate development of foraging proficiency. Biology Letters, 3: 371-374. Davis, L. S. (1982). Creeching behaviour of Adelie Penguin chicks (Pygoscelis adeliae). New Zealand Journal of Zoology, 9 : 279-286. Debout, G. (1985). Quelques donnés sur la nidification du Cormoran huppé (Phalacrocorax aristotelis) á Chausey, Manche. Alauda, 53: 161-166. De Pablo, F. (2005). Contribución a la situación del cormorán moñudo en Menorca (Islas Baleares). Anuari Ornitologic de les Balears, 20: 99-107. Evans, P. G. H. (1984). Status and conservation of seabirds in Northwest Europe (excluding Norway and the USSR). ICBP Technical Publication, 2: 293-321. Frederiksen, M., Daunt, F., Harris, M. P., Wanless, S. (2008). Stochastic weather drives survival and population dynamics in a long-lived seabird. Journal of Animal Ecology, 77: 1020-1029. Grau, C. R. (1996). Nutritional needs for egg formation in the Shag Phalacrocorax aristotelis. Ibis, 138: 756-764. Graves, J., Hay, R. T., Scallan, M., Rowe, S. (1992). Extra-pair paternity in the shag, Phalacrocorax aristotelis as determined by DNA. Journal of Zoology, 226: 399-408. Graves, J., Ortega-Ruano, J. E. (1992). Shags on the Isle of May: who mates with whom? Scottish Birds, 16: 236-239. Graves, J., Ortega-Ruano, J., Slater, J. B. (1993). Extra-pair copulations and paternity in shags: do females choose better males? Proceedings Royal Society of London, 253: 3-7. Graves, J., Ortega-Ruano, J.E. (1994). Patterns of interaction in the courtship behaviour of shags (Phalacrocorax aristotelis). Etología, 4: 1-9. Hall, M. E., Nasir, L., Daunt, F., Gault, E.A., Croxall, J. P., Wanless, S., Monaghan, P. (2004). Telomere loss in relation to age and early environment in long-lived birds. Proceedings of the Royal Society, 271: 1571-1576. Harris, M. P. (1982). Promiscuity in the Shag as shown by time-lapse photography. Bird Study, 29: 149-154. Harris, M. P., Buckland, S. T., Russell, S. M., Wanless, S. (1994a). Year-and age-related variation in the survival of adult European Shags over a 24-year period. The Condor, 96: 600- 605. Harris, M. P., Russell, S. M., Wanless, S. (1994b). Post fledging survival to breeding age of Shags Phalacrocorax aristotelis in relation to year, date of fledging and brood size. Journal of Avian Biology, 25: 268-274. Johnsgard, P. A. (1993). Cormorants, Darters, and Pelicans of the World. Smithsonian Institution Press. Washington. Moe, B., Brunvoll, S., Mork, D., Brobakk, T. E., Bech, C. (2004). Developmental plasticity of physiology and morphology in diet-restricted European shag nestlings (Phalacrocorax aristotelis). Journal of Experimental Biology, 207: 4067-4076. Nelson, B. (1964). Factors influencing clutch size and chick growth in the North Atlantic Gannet Sula bassana. Ibis, 106: 63-77. Noguera, J. C., Kim, S-Y., Velando, A. (2012). Pre-fledgling oxidative damage predicts recruitment in a long-lived bird. Biology Letters, 8: 61-63. Olsthoorn, J. C. M., Nelson, J. B. (1990). The availability of breeding sites for some British seabirds. Bird Study, 37: 145-164. Ortega-Ruano, J., Graves, J. (1991). Reverse mounting during the courtship of the european Shag (Phalacrocorax aristotelis). Condor, 93: 859-863. Østnes, J.E., BjØrn, M.J., Bech, C. (2001). Growth and development of homeothermy in nestling European Shag (Phalacrocorax aristotelis). The Auk, 118 : 983-995. Potts, G. R. (1966). Studies on a marked population of the shag with special reference to the breeding biology of birds of known age. Tesis doctoral. Universidad de Durham. Potts, G. R. (1968). Success of eggs of the shag on the Farne islands, Nothumberland, in relation to their content of Dieldrin and DDE. Nature, 217: 1282-1284. Potts, G. R., Coulson, J. C., Deans, I. R. (1980). Population dynamics and breeding success of the Shag, Phalacrocorax aristotelis, on the Farne islands, Northumberland. Journal of Animal Ecology, 49: 465-484. Rodríguez Silvar, J. (1977). Distribución y cría del cormorán moñudo, Phalacrocorax aristotelis (L.) en las costas gallegas. Tesina de Licenciatura. Facultad de Biología. Universidad de Santiago. 78 pp. RØv, N. (1990). Bestandsforhold hos toppskarv i Norge. NINA Forskningsrapport, 7: 1-28. Snow, B. (1960). The breeding biology of the shag Phalacrocorax aristotelis on the island of Lundy, Bristol Channel. Ibis, 102: 554-575. Snow, B. (1963). The behaviour of the shag. British Birds, 56: 77-103, 164-186. Staav, R. (1998). Longevity list of birds ringed in Europe. Euring Newsletter, 2: 9-18. Stokland, J. N., Amundsen, T. (1988). Initial size hierarchy in broods of the shag: telative significance of egg size and hatching asynchrony. The Auk, 105: 308-315. Velando, A. (1997). Ecología y comportamiento del cormorán moñudo (Phalacrocorax aristotelis) en las islas Cíes y Ons. Tesis Doctoral, Universidad de Vigo. Velando, A. (2000). The importance of the hatching date on dominance of young shags. Animal Behaviour, 60: 181-185. Velando, A. (2001). Postfledging crèche behaviour in European shag. Journal of Ethology, 19: 116-122. Velando, A., Freire, J. (1999b). Coloniabilidad y conservación de aves marinas: El caso del cormorán moñudo. Etología, 7: 55-62. Velando, A., Freire, J. (2001). How general is the central-periphery distribution among seabird colonies? Nest spatial pattern in the European shag. The Condor, 103: 544-554. Velando, A., Freire, J. (2002). Population modelling of European shag at their southern limit: conservation implications. Biological Conservation, 107: 59-69. Velando, A., Graves, J., Freire, J. (2000). Sex-specific growth in the European Shag Stictocarbo aristotelis, a seabird with size dimorphism. Ardea, 88: 127-136. Velando, A., Graves, J., Ortega-Ruano, J.E. (2002). Sex ratio in relation to timing of breeding, and laying sequence in a dimorphic seabird. Ibis, 144: 9-16. Velando, A., Ortega-Ruano, J. E., Freire, J. (1999b). Chick mortality in European shag Stictocarbo aristotelis related to food limitations during adverse weather events. Ardea, 87: 51-59. Walsh, P., Brindley, E. (1994). Great Britain and Ireland seabird breeding success in 1993. The Seabird Group, Newsletter, 68: 3-6. Wanless, S., Harris, M. P. (1997). Successful double-brooding in European Shags. Colonial Waterbirds, 20: 291-294.
Álvaro Barros, David Álvarez y Alberto Velando Fecha de publicación: 16-07-2013 Otras contribuciones: 1. Alfredo Salvador. 11-05-2016 Barros, A., Álvarez, D., Velando, V. (2016). Cormorán moñudo – Phalacrocorax aristotelis. En: Enciclopedia Virtual de los Vertebrados Españoles. Salvador, A., Morales, M. B. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||