|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Para más información sobre cada apartado hacer click en:
|
Key words: Great Tit, reproduction, nest quality, egg size, breeding success, senescence.
Biología de la reproducción Generalidades El Carbonero común es una especie territorial (García, 1983; Andreu y Barba, 2006). Los límites de los territorios se definen y se defienden, por parte del macho, cuando comienza la construcción del nido (Hinde, 1952; Cramp y Perrins, 1993; Gosler, 1993). La defensa del territorio se relaja tras la puesta de los huevos (Kluijver, 1951). Las hembras, en cambio, son las encargadas de construir el nido, incubar los huevos y empollar, sobre todo cuando los pollos tienen pocos días. Ambos sexos empiezan a criar con un año de edad. Es una especie típicamente monógama (Perrins, 1979), manteniéndose la pareja al menos durante la estación reproductora, y muchas veces de un año a otro si los dos individuos siguen vivos (Andreu y Barba, 2006). A veces realiza cópulas extraparentales, es decir, hay hembras que ponen huevos fecundados por machos distintos a su pareja (Perrins, 1979). Donde y cuando tener paternidad extra-pareja en el carbonero común parece más importante que el con quién. Un estudio no encontró beneficios genéticos ni feonotípicos de la paternidad extra-pareja tanto en machos como en hembras. Se observó una correlación negativa entre sincronía de reproducción y tasas de paternidad extra-pareja. A pesar de tener que recorrer grandes distancias, los machos obtienen paternidad extra-pareja una vez que ha finalizado el periodo fértil de su pareja (García-Navas et al., 2015)1. En ocasiones se encuentran puestas mixtas de Carbonero común con otras especies de páridos, como el Herrerillo común Cyanistes caeruleus (Baucells, 1990), o el Carbonero garrapinos Periparus ater (Figura 1 Belda et al., en preparación). Las parejas del Carbonero común se forman entre enero y marzo (Gosler, 1993; Cramp y Perrins, 1993), y raramente la rompen durante la estación reproductora, que suele durar alrededor de tres meses (Barba, 1991). Excepcionalmente se cita un caso de nidificación en noviembre (Hiraldo, 1973).
Figura 1. Puesta mixta (n = 8 pollos) de Carbonero común y Carbonero garrapinos. Las flechas señalan los dos pollos de Carbonero común. © F. Atiénzar.
La influencia de la coloración del plumaje en la elección de pareja ha sido objeto de investigación. En este contexto, Galván y Sanz (2008) han mostrado que el tamaño de la mancha blanca de las mejillas actúa como un “amplificador” de la calidad de los machos, ya que las hembras emparejadas con los machos de mejor calidad (mejor relación peso/tarso) comenzaron antes la puesta cuanto mayor era la mancha blanca del macho, mientras que las emparejadas con los de peor calidad comenzaron la puesta más tarde cuanto mayor era la mancha blanca del macho. Es decir, cuanto mayor la mancha, más perceptible es para las hembras la calidad del macho (buena o mala) y esto tiene consecuencias en la formación de parejas y, como consecuencia, en la reproducción. Quesada (2007) muestra que hay un emparejamiento concordante en relación a la saturación y el tono del amarillo del pecho y el área de la corbata negra, aunque Atiénzar (2009) no encuentra esta relación en cuanto al amarillo del pecho. El tamaño de la corbata negra de los machos, basado en melanina, se relaciona con la capacidad de defensa del nido (agresividad o dominancia; Quesada, 2007). El nido está formado básicamente por musgo (Álvarez et al., 2012). En general, tardan sobre una semana en construir su nido, ponen un huevo diario hasta terminar la puesta, y tienen la costumbre de enterrar los huevos entre el material del nido hasta que empiezan a incubar (Barba 1991). En la mayor parte de las poblaciones estudiadas, lo más frecuente es que los individuos sólo realicen una puesta por temporada, aunque en todas ellas se registran parejas que hacen dos puestas, variando su porcentaje entre lugares y años, y llegando a ser muy abundantes en alguna población (Pascual, 1985; Barba et al., 1988; Pimentel y Nilsson, 2009a, y se han llegado a citar incluso tres puestas por temporada en Cataluña, aunque lo normal son dos por año (García, 1983). Las hembras comienzan a incubar un día antes de que la puesta esté completa, y están incubando alrededor de 13 días (Gibb, 1950; Perrins, 1979; Cramp y Perrins, 1993; Gosler, 1993), aunque el macho aporta alimento a la hembra mientras está incubando. El periodo de incubación puede prolongarse en condiciones ambientales desfavorables (Monrós et al., 1998). Los pollos permanecen en el nido entre 18 y 20 días después de la eclosión, de ahí que se le considere como especie altricial o nidícola. La reproducción de la especie se ha estudiado en varias poblaciones ibéricas (ver Tabla 1).
Tabla 1. Poblaciones ibéricas donde se ha centrado el estudio sobre distintos aspectos de la reproducción del Carbonero común.
Nota: cuando en el texto se indique Monte Poblet (Tarragona) se refiere a los encinares de Riudabella y El Titllar conjuntamente (ver Gil-Delgado et al., 1992). En posteriores estudios se amplió la zona de estudio con el pinar de La Pena, y se trataron las tres áreas que están ubicadas en Monte Poblet de forma independiente. Fenología de la reproducción La estación de nidificación comprende el periodo entre la puesta del primer huevo y el día en que el último nido deja de estar activo, bien sea por fracaso o por volar los pollos con éxito (Barba, 1991). El inicio del periodo reproductor en Sagunto está comprendido entre el 31 de marzo y el 15 de abril, finalizando entre el 29 de junio y el 21 de julio (n = 144 nidos desde 1986 hasta 1991; Barba 1991). Por lo tanto, la estación de nidificación dura alrededor de tres meses (entre 80 y 106 días, media ± error típico; 92,8 ± 3,39 días). Teniendo en cuenta todas las puestas, el 73% han comenzado en abril, el 20% en mayo, y el 7% en junio. En distintas localidades de la costa mediterránea ibérica, la estación de nidificación comienza en abril, siendo este mes cuando se detecta un mayor número de puestas, y finaliza en julio (Barba et al., 1988). En muy pocos casos, han aparecido nidos a finales de marzo (Barba, 1991; datos recientes no publicados). En Riudabella y El Titllar, durante los años 1993 al 1995, el inicio de la puesta tuvo lugar a finales del mes de abril y durante los primeros días de mayo (Iglesias, 1996). En Cataluña la reproducción empieza antes, observándose los primeros nidos en marzo, y finaliza en julio, aunque existen datos hasta el mes de agosto (García, 1983). En Mata de Quiaios en 2003 el primer huevo se puso el 29 de marzo y el último el 8 de junio, siendo las fechas para Mata do Urso el 16 de marzo y el 2 de junio (Costa et al., 2005). En Leiria y Apostiça la estación reproductora dura alrededor de cuatro meses (Pimentel y Nilsson, 2007a). Algunos trabajos distinguen “segundas puestas” (realizadas tras volar con éxito los pollos de una primera puesta), y “puestas de reposición” (realizadas tras fracasar un primer intento reproductor). En el caso de Sagunto, el 19% de las parejas que tienen éxito en la primera puesta comenzaron una segunda puesta (rango: 6-27% en 6 años; Barba, 1992). En Monte Poblet (Tarragona), Iglesias (1996) indica un 5% de segundas puestas pero algún año no se ha encontrado ninguna (Barba et al., 1988). Sanz et al. (2010) encuentran un 17% de segundas puestas en Valdeyerno, y entre el 11 y el 20% en varios pinares de Toledo. El porcentaje de segundas puestas en los robledales de Salamanca es de 1,3 (Pascual, 1985). Además, el intervalo entre el inicio de la primera y la segunda puesta es, de media, cuatro días mayor por cada huevo que aumente la primera puesta (Barba, 1992). En Leiria la proporción de segundas puestas varió entre 52 y 100% y en Apostiça entre 53 y 64% (Pimentel y Nilsson, 2007a). En Mata de Quiaios el 36% de los carboneros realizan una segunda puesta y en Mata do Urso el 41% (Costa et al., 2011). En una población portuguesa los machos que atendían segundas puestas tuvieron menor prevalencia de Haemoproteus y Leucocytozoon (Norte et al., 2009b) y mayor concentración de proteínas plasmáticas (Norte et al., 2010a). Y en la misma población, las hembras tienen peor índice de condición corporal y hematocrito cuando están atendiendo las segundas puestas que cuando atendían las primeras (Norte et al., 2010a). En la población de Leiria, la densidad de parejas afectó negativamente a la proporción de segundas puestas (Pimentel y Nilsson, 2009). Y en cuanto a las puestas de reposición, el 13% de las parejas que fracasan en el primer intento en Sagunto comienzan una puesta de reposición (rango: 0-33% en varios años de estudio; Barba, 1992), siendo los valores del 11% en Pitarque (Belda, 1996), y entre el 50 y 100% en Leiria y Apostiça (Pimentel y Nilsson, 2007a). Ubicación del nido Los nidos naturales del Carbonero común se encuentran en agujeros de árboles, huecos de muros y taludes, grietas de rocas, etc. (Gil-Delgado y Barba, 1987). Es, por tanto, una especie típica que requiere de huecos ya existentes para criar (Sanz, 2000), ya que no es capaz de excavarlos. También aceptan frecuentemente nidales artificiales, como cajas-nido (ver Figura 1) instaladas en parques urbanos, plazas, jardines y bosques (González y de Eulate, 1974; García, 1983; Fernández-Juricic, 2000; Sanz, 2000; Atiénzar et al., 2010). No tienen preferencias de tamaño, color, y material de fabricación (Lambrechts et al., 2010). Parece ser, no obstante, que esta especie prefiere nidificar en cajas-nido del “modelo C” de ICONA (tipo Párido) frente al modelo “corcho” (Moreno-Rueda, 2002-2003), aunque el pequeño tamaño de muestra de este estudio impidió que el resultado fuera estadísticamente significativo. No obstante, si no hay cajas del “modelo C” disponibles, puede emplear otros tipos, como por ejemplo el modelo “corcho” (Pérez de Ana, 2001). En un estudio en el naranjal de Sagunto, tuvieron preferencia por cajas-nido situadas a mayor altura (Barba y López, 1990). En España, los únicos datos de nidos naturales los ofrecen Gil-Delgado y Barba (1987) en el naranjal de Sagunto. En este hábitat, los nidos se disponen sobre el tronco principal de los naranjos y, en general, a escasa altura (14-40 cm, n = 10 nidos) con la abertura situada en la parte superior (n = 4 nidos) o lateralmente (n = 6 nidos). El diámetro de la abertura de entrada del agujero en el árbol oscila entre 3 y 13 cm, y la profundidad de la cavidad entre 0 y 39 cm. El diámetro mínimo de un tronco ocupado es de 26 cm, por lo que huecos situados en árboles más jóvenes parecen ser insuficientes para las necesidades de la especie. Todos los huecos procedieron de la putrefacción del tronco, por lo que las condiciones que presentan para la nidificación no deben ser las adecuadas. Ocasionalmente pueden criar en nidos abiertos. Monrós et al. (1999) describen la primera reproducción exitosa confirmada ocupando un nido de Mirlo común Turdus merula localizado en naranjos. Características del nido El nido está compuesto en su mayoría por musgo, mezclado a menudo con paja o hierba seca, y un forro hecho de hierba fina seca, pelo, lana y/o algunas plumas, variando la composición con la población y el hábitat (Álvarez, 2007; Álvarez y Barba, 2009; Álvarez et al., 2013). Así, en un estudio comparativo en cuatro áreas mediterráneas Álvarez et al. (2013) mostraron que los nidos en Sagunto y Sierra Mariola eran más pesados y en Font Roja más ligeros, mientras que los de Santa Bárbara de Pina (Pina en adelante) no difirieron en peso del resto de lugares. Respecto a la composición de los nidos, en el naranjal de Sagunto destaca la baja proporción de musgo (16%) respecto a los otros tres lugares (63-73%), habiendo también diferencias en la cantidad y proporción de otros materiales entre Sagunto y el resto de ambientes. Se ha encontrado un nido construido casi en su totalidad por helechos (Figura 1), y algunas veces lo pueden hacer sobre nidos de lirones caretos Elyomis quercinus antiguos construidos en cajas- nido (Figura 3, datos propios no publicados). La composición y dimensiones del nido fueron estudiadas con más detalle para la población de Sagunto (Tabla 2, 3).
Figura 2. Nido de Carbonero común hecho con helechos. © E. Álvarez
Figura 3. Nido de Carbonero común sobre nido de Lirón careto. © E. Álvarez
Tabla 2. Media, desviación típica y valores máximo y mínimo de cada una de las variables tomadas en los nidos en la población de Sagunto (n = 16 en todos los casos). Dimensiones lineales en mm; peso en g. El valor “0,00” de espesor del fondo significa que el nido no tenía base, es decir, los huevos estaban sobre la madera de la caja-nido. Según Álvarez (2007).
Tabla 3. Media y desviación típica de cada uno de los pesos secos (g) de los distintos materiales del nido en la población de Sagunto, así como sus porcentajes totales en los nidos estudiados, junto con sus valores máximo y mínimo. Tamaño muestral entre paréntesis. Dentro de “otros”, en ambos casos, se han incluido los siguientes materiales: lana, pelusa, plástico y cuerda, por encontrarse en muy pequeña cantidad (<0,01 g). Según Álvarez (2007).
Construcción del nido El nido lo construyen sólo las hembras (Cramp y Perrins, 1993). El tiempo de construcción varía mucho según el tipo de puesta, pero tomando como ejemplo una primera puesta, suele ser de entre unos 7 y 10 días (datos propios no publicados). Las características de los padres pueden afectar la calidad del nido. Por ejemplo, Broggi y Senar (2009) demostraron que los padres de coloración más brillante, es decir, de mayor calidad, construyeron nidos más grandes o de mejor calidad. Álvarez y Barba (2008) no encontraron relación entre variables biométricas o de edad de los padres y las características del nido, pero Álvarez y Barba (2011) encontraron que las hembras jóvenes construyeron nidos relativamente más profundos que las adultas. Fecha media de puesta La fecha media de puesta se calcula como la media de las fechas de puesta del primer huevo de las primeras puestas en la población, y habitualmente para estandarizar con otros estudios, se considera el día 1 como el 1 de abril (así, el día 31 es el 1 de Mayo). La Tabla 4 resume los datos disponibles sobre fechas medias de puesta en diferentes poblaciones ibéricas. En Leiria está disponible la mediana de la fecha de inicio de puesta para tres poblaciones, siendo el 24 de marzo para las primeras puestas y el 14 de mayo para las segundas (Pimentel y Nilsson, 2009). La mediana de la fecha de inicio de puesta de segundas puestas en Apostiça está entre el 7 y 15 de mayo y en Leiria está entre el 13 y 23 de mayo entre los años 2001 a 2004 (Pimentel y Nilsson, 2007a).
Tabla 4. Resumen de las fechas y tamaños medios de puesta ± error típico/desviación típica en diferentes poblaciones ibéricas. El tamaño muestral en algunos estudios son los años, estando disponibles los valores medios anuales, mientras que en otros es el número de nidos. Los datos de Leiria y Apostiça están estimados a partir de la Figura 2 en Pimentel y Nilsson (2007a), y los datos de fecha de puesta de Mata de Quiaios y Mata do Urso a partir de la Figura 1 en Costa et al. (2011). Fecha media de puesta (1:1 abril).
Varios factores pueden afectar a la fecha media de puesta: -Variación interanual: algunos trabajos han mostrado una variación interanual en la fecha media de puesta. Así, la fecha de puesta difirió entre años, aunque los cambios fueron relativamente pequeños y bastante sincrónicos en Riudabella, El Titllar, La Pena y Pitarque, mientras los de Sagunto fueron independientes de los otros sitios (Belda et al., 1998). La variabilidad entre años en la fecha de puesta fue similar entre hábitats. En el naranjal de Sagunto, la fecha media de puesta ha variado entre el 11 y el 28 de abril entre 1986 y 1991 habiendo diferencias significativas entre algunos años (Barba, 1991). También se encuentran diferencias entre las fechas de puesta de varios años en Mata de Quiaios y Mata do Urso, entre los años 2003 y 2009 (Costa et al., 2011). Existen diferencias interanuales en la fecha media de puesta tanto en el pinar de Sierra Mariola como en el encinar de Font Roja (Atiénzar, 2009). -Variación altitudinal: Belda et al. (1998) encuentran que, dentro del mismo tipo de hábitat (encinar), la fecha de puesta fue más temprana a baja altitud (ver también, Atiénzar, 2009). -Tipo de hábitat: Varios estudios muestran que la fecha de inicio de puesta difiere entre hábitats (ver Tabla 4). Por ejemplo, Belda et al. (1998) muestran que la población que cría en los naranjales tiene una fecha de puesta más temprana (21 de Abril) que las otras estudiadas en los tres principales hábitats naturales (quejigal, encinar y pinar) de la parte Mediterránea de España. Sanz et al. (2010) muestran que la puesta es más temprana en un robledal que en unos pinares del centro de España (Los Quintos de Mora, Toledo). Y otros trabajos muestran un comienzo anterior en pinares que en encinares (Maícas y Fernández, 1996; Atiénzar et al., 2010). En cambio otros estudios no han detectado efecto alguno. Por ejemplo, en una revisión de diversas poblaciones europeas, que incluye algunas de las citadas arriba, Sanz (1998) mostró que el efecto del tipo de bosque sobre las fechas de puesta desaparecía después de controlar las diferencias en altitud y latitud. Estos resultados concuerdan con los de Belda et al. (1998) que no encuentran diferencias en las fechas medias de puesta entre hábitats naturales localizados a una latitud y altitud similar (Pitarque, El Titllar y La Pena). Y, ni el grado de madurez de la vegetación ni las diferencias en la composición arbórea entre cajas-nido dentro de alguno de los bosques fueron claves para el comienzo de la reproducción (Atiénzar et al., 2010). -Temperatura: En las zonas más cálidas de Cataluña la puesta se inicia antes que en las zonas más interiores donde la temperatura es menor (García, 1983). La fecha de puesta es más temprana en años más cálidos (Álvarez et al., 2006; Atiénzar, 2009). Utilizando datos de 18 años (1986-2003) se ha observado un adelanto de 12 días en la fecha media de puesta en Sagunto, relacionado con un aumento de la temperatura media en el mes de marzo de unos 3ºC en los años de estudio (Álvarez et al., 2005). -Características del nido: Los nidos con mayor diámetro de cuenco del nido presentan fechas medias de inicio de puesta más tempranas (Álvarez y Barba, 2011). -Características de los padres: -1) Edad. Individuos de entre 3 y 4 años inician la puesta antes que aquellos más longevos (n = 2200 individuos entre 1992-2009, Betancourt et al., 2010). En estudios menos precisos, donde se han distinguido sólo entre individuos de un año y de más de un año, no se encuentran diferencias en la fecha de puesta entre estas clases de edad (Belda, 1996). -2) Biometría y condición corporal. Hembras en peor condición corporal y de tarso más largo comienzan antes la puesta (Álvarez y Barba, 2011). Hembras con mayor hematocrito y menor actividad de la glutatión peroxidasa empiezan la puesta antes (Norte et al., 2010a). Tamaño de puesta Los datos disponibles sobre tamaños de las primeras puestas en diferentes poblaciones ibéricas se resumen en la Tabla 4. Se observa que el tamaño medio de puesta oscila entre los 5 y los 9 huevos. De la Puente y Yanes (1995) revisaron 50 nidos encontrados en 14 provincias durante 13 años, y han calculado un tamaño medio de puesta de 5,9 huevos, aunque es probable que se hayan incluido todo tipo de puestas, primeras, segundas y reposiciones. En cuanto a las segundas puestas, el tamaño medio oscila en torno a 6,9 huevos (ET = 0,32, n = 15 nidos) en naranjales, siendo más frecuentes las de 6 huevos (40%, n = 15 nidos; Barba, 1991). En esta última población, las segundas puestas son menores que las primeras puestas de las parejas que las realizaron. El tamaño de la segunda puesta es tanto menor que la primera cuanto mayor es la primera. En una de las tres áreas de estudio de Leiria, hay una fase de irrupción de larvas de procesionaria del pino (Thaumetopoea pityocampa) durante el verano que favorece el incremento del tamaño en segundas puestas (Pimentel y Nilsson, 2009). El tamaño medio de las segundas puestas en Leiria es de 6,3 huevos (DT = 0,22, n = 4 años) y en Apostiça de 6,6 huevos (DT = 0,23, n = 4 años) desde 2001 hasta 2004 (datos estimados a partir de la Figura 5 en Pimentel y Nilsson, 2007a). El tamaño de la segunda puesta es menor que el de la primera en Leiria y Apostiça (Pimentel y Nilsson, 2007a). En Mata de Quiaios es de 5,34 huevos (DT = 1,05) y en Mata do Urso de 6,28 huevos (DT = 1,05) (Costa et al., 2011). Las segundas puestas fueron un 14% más pequeñas que las primeras puestas en Mata do Urso, pero no en Mata de Quiaios (Costa et al., 2011). Diversos son los factores que pueden afectar al tamaño de puesta: -Variación interanual: Barba (1991) no encontró diferencias interanuales (n = 6 años) en el tamaño medio de puesta en Sagunto, pero entre 2006 y 2007 sí que se encontraron (Álvarez y Barba, 2011). Atiénzar et al. (2010) encontraron diferencias en un encinar y en un pinar durante 3 años de estudio, a la par que encontraron variación anual en la abundancia de alimento (ver Atiénzar, 2009). -Variación estacional: En algunos ambientes naturales en los que se ha estudiado, no parece haber una variación estacional en el tamaño de puesta (Iglesias, 1996; Atiénzar et al., 2010). Sin embargo, Maícas y Fernández (1996) muestran que, tanto en un pinar (7,5 vs 6,7 huevos de media) como en un encinar adehesado (7,3 vs 6,0 huevos), los tamaños de puesta son mayores en puestas tempranas que en tardías, aunque en estas últimas hay una fracción de puestas de reposición y de segundas puestas. Y en el naranjal de Sagunto, el tamaño medio de puesta también decrece al avanzar la estación en tres de los seis años de estudio (1986-91; Barba, 1991). El tamaño de puesta de las primeras puestas decrece con la fecha de puesta en Leiria y Apostiça (Pimentel y Nilsson, 2007a), y en Mata de Quiaios y Mata do Urso (Costa et al., 2011). -Variación altitudinal: En general, se ha mostrado que el tamaño de puesta en el Carbonero común decrece con el aumento de la altitud (Sanz, 1998). Sin embargo, en otros estudios en los que se tenía la misma latitud pero diferente altitud, el tamaño de puesta aumentaba con la altitud (Belda et al., 1998; Atiénzar et al., 2010). Esto sugiere una mayor influencia del tipo de bosque, y por tanto, de la disponibilidad de alimento, que de la altitud en la determinación del tamaño de puesta en este caso. -Tipo de hábitat: Entre los hábitats naturales a la misma altitud, el tamaño de puesta disminuye desde el quejigal de Pitarque (media de las medias anuales 7,3 huevos) hacia los encinares de Riudabella y El Titllar (7,0 huevos) y hasta el pinar de La Pena (6,4 huevos), aunque sólo la diferencia entre el quejigal y el pinar es significativa (Belda et al., 1998). El tamaño de puesta en los naranjales (7,7 huevos) no difiere significativamente del quejigal, pero es mayor que en los dos encinares y el pinar (Belda et al., 1998; ver también Atiénzar et al., 2010). Maícas y Fernández (1996) no encuentran diferencias significativas en el tamaño medio de puesta entre un pinar y un encinar adehesado, pero el rango de tamaños de puesta es ligeramente mayor en el encinar (2-11) que en el pinar (3-10). Además, el tamaño de puesta más frecuente en el pinar es de 7 huevos, mientras que en el encinar es de 8 huevos. El tamaño de puesta es mayor en un robledal que en unos pinares del centro de España (Los Quintos de Mora, Toledo; Sanz et al., 2010). -Estructura y composición vegetal: A escala local, los carboneros que crían en territorios con una capa arbustiva más desarrollada y mayor densidad de robles realizan puestas mayores (Sanz et al., 2010), pero Atiénzar et al. (2010) no encuentran una relación entre la madurez de la vegetación alrededor del nido y el tamaño de puesta en un pinar y un encinar. -Características del nido: El tamaño de puesta aumenta con el diámetro transversal de los nidos (Álvarez y Barba, 2008). El tamaño de puesta disminuye cuando el peso del musgo de los nidos aumenta en cuatro hábitats mediterráneos (Álvarez et al., 2012). -Características de los padres: El tamaño de puesta aumenta con la edad de machos y hembras hasta los 3-4 años, disminuyendo progresivamente a edades más avanzadas (Betancourt et al., 2010). Las hembras que ponen puestas de mayor tamaño tienen mayor probabilidad de estar infectadas por Leucocytozoon y Haemoproteus (Norte et al., 2009b). -Densidad de parejas: El tamaño de puesta, tanto en las primeras como en las segundas puestas, decrece cuando aumenta la densidad de parejas en Leiria (Pimentel y Nilsson, 2007a). Huevos
Figura 4. Huevos de Carbonero común. (C) E. Álvarez
Los huevos de Carbonero común, al igual que los del resto de páridos que nidifican en la Península Ibérica, son de color blanquecino con manchas o puntitos de color pardo rojizo, a menudo concentradas en el polo más ancho del huevo (ver Figura 2); raramente completamente blancos o casi sin marcas (Cramp y Perrins, 1993; Cantó, 2008). Son sub-elípticos, lisos, y mate (Makatsch, 1976). Son los de mayor tamaño de todos los páridos (Cramp y Perrins, 1993). Los valores medios de los diferentes parámetros medidos de los huevos del Carbonero común a nivel nacional se muestran en la Tabla 5.
Tabla 5. Características de los huevos en varias poblaciones ibéricas.
Factores que pueden afectar al tamaño del huevo: -Variación interanual: El volumen del huevo de las primeras puestas en Sagunto durante los años de estudio no varía (Barba, 1991). -Variación estacional: No existe una variación estacional en el tamaño de los huevos (Barba, 1991; Maícas y Fernández, 1996). -Temperatura: Se encuentra una relación positiva entre el volumen del huevo y las temperaturas 7-10 días antes de su puesta (Barba, 1991). -Características de los padres: Las hembras con mayor probabilidad de infección de Plasmodium pusieron huevos más pesados (Norte et al., 2009b). -Tipo de puesta: El volumen del huevo en las primeras puestas no difiere del de las segundas ni de las de reposición (Barba, 1991). -Parámetros reproductores: El volumen medio anual está positivamente relacionado con el tamaño medio de puesta (Encabo et al., 2001a). En cambio, la forma media del huevo no varía con el tamaño de puesta (Encabo et al., 2001b). Los huevos depositados en el mismo orden en la secuencia de puesta no difieren de tamaño independientemente del tamaño de la puesta a la que pertenecen (Barba, 1991). Entre las puestas del mismo tamaño, hay diferencias entre los volúmenes de los huevos depositados en distinto orden. La tendencia de los primeros huevos a ser los de menor tamaño es común en todos los tamaños de puesta. Los huevos centrales de cada puesta son los que tienen mayor probabilidad de ser los más grandes (Barba 1991). Incubación y eclosión
Figura 5. Hembra de Carbonero común incubando (C) E. Álvarez
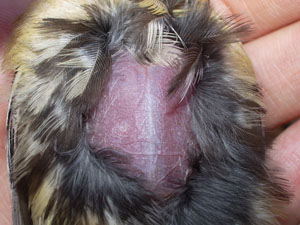
Figura 6. Placa incubatriz de una hembra de Carbonero común (C) E. Álvarez
El Carbonero común se caracteriza porque sólo la hembra incuba los huevos (ver Figura 3; Perrins, 1979; datos propios no publicados), desarrollando una placa incubatriz (ver Figura 4), y el macho aporta comida a la hembra durante el periodo de incubación (Royama, 1966). El Carbonero común tiene la costumbre de ocultar los huevos entre el material del nido hasta que empieza a incubar. Sin embargo, en la población de Sagunto se ha observado que los huevos pueden aparecer descubiertos algún día antes de empezar la incubación (Barba, 1991). Periodo de incubación El periodo de incubación, definido como el intervalo de días desde el comienzo de la incubación (huevos descubiertos y calientes o hembra incubando en el momento de la visita) hasta que nace el primer pollo, dura una media de 13,1 días (rango 10-15, ET = 0,18, n = 35 nidos) en la población de Sagunto (Barba, 1991). La incubación puede empezar en cualquier momento entre dos días antes de concluir la puesta y dos días después. Lo más frecuente en la población estudiada es que la incubación comience el día en que se pone el último huevo. Factores que afectan al periodo de incubación: -Fecha de puesta: El periodo de incubación muestra una débil tendencia a disminuir conforme avanza la estación (Barba, 1991). Las parejas que comienzan la incubación antes de poner el último huevo inician antes la puesta que aquéllas que lo hacen tras concluir la puesta, y éstas antes que las que comienzan la incubación uno o dos días después de poner el último huevo. El periodo de incubación es más corto en aquellas parejas que empiezan a incubar más tarde. Las parejas que empiezan la incubación antes de la puesta del último huevo presentan un periodo de incubación más largo que aquellas que esperan al menos hasta la puesta del último huevo para empezar a incubar. -Tamaño de puesta: Agrupando las puestas en “pequeñas” (5-7 huevos), “medianas” (8 huevos), y “grandes” (9-10 huevos), los periodos de incubación y el día de comienzo de la incubación no difieren entre los tres grupos (Barba, 1991). -Características de los huevos: No existe ninguna relación entre el volumen medio de los huevos que componen la puesta, la elongación media o el volumen total (volumen medio de los huevos por tamaño de puesta) de los huevos y la duración del periodo de incubación (Barba, 1991). -Temperatura: La duración del periodo de incubación disminuye al aumentar las temperaturas mínimas después de controlar otros factores (Barba, 1991). En nidos en los que se elevó experimentalmente la temperatura, las hembras tuvieron más periodos de descanso de la incubación y estos tendieron a ser más largos. En nidos enfriados experimentalmente, el éxito reproductivo fue similar a nidos control, lo que sugiere que las hembras compensaron el tratamiento (Alvarez y Barba, 2014)1. Periodo de eclosión Como norma general, en las puestas estudiadas por Barba (1991), los huevos eclosionan de forma asincrónica, extendiéndose el periodo de eclosión (definido aquí como el intervalo en días desde el nacimiento del primer pollo hasta el nacimiento del último, ambos inclusive) por dos (63% de las puestas, n = 32) o tres días (31%). En los casos en los que el último día del periodo de eclosión nacieron solamente uno o dos pollos, estos correspondieron invariablemente a los últimos huevos depositados. Sólo se encontró un par de casos en los que todos los huevos eclosionaron a la vez. El periodo medio de eclosión fue de 2,3 días (ET = 0,10, n = 32 nidos). El periodo de eclosión no se ha visto afectado por el tamaño de la puesta, ni varía a lo largo de la estación. Sin embargo, la temperatura media durante los últimos días del periodo de puesta fue la más relacionada con el grado de asincronía. Las puestas retrasadas experimentalmente (n = 40) tienen un periodo de eclosión más largo que las puestas control (n = 56; Barba et al., 1995), El comienzo de la incubación antes de completarse la puesta puede avanzar la fecha de nacimiento pero con el coste de incrementar la asincronía de nacimiento. La incubación comienza antes de completarse la puesta con el aumento de las temperaturas y del tamaño de puesta. El periodo de incubación es más corto si la incubación comienza más tarde durante el periodo de puesta. La asincronía de nacimientos aumenta si la incubación comienza antes de completarse la puesta (Alvarez y Barba, 2014a)1. Fase de huevo La fase de huevo (periodo comprendido entre la puesta del primer huevo y el nacimiento del último pollo) es de 1,04 días más largo por cada huevo adicional y disminuye al avanzar la estación (Barba, 1991). Dicha fase varía en función del tamaño de puesta así como del día de comienzo de la incubación. Crecimiento y desarrollo de los pollos
Figura 7. Pollo de 5 días de edad. (C) E. Álvarez
Figura 8. Pollo de 10 días de edad. (C) E. Álvarez
Figura 9. Pollo de 15 días de edad. (C) E. Álvarez
Tasa de crecimiento El crecimiento de los pollos de Carbonero común (ver Figuras 5a-5b-5c) se ajusta a una ecuación logística de la forma W1 = A/{1 + exp [- k (t – t1)], donde W es el peso en un momento dado, A es el valor asintótico al que tiende el peso de los pollos, k es la tasa de crecimiento, y t1 el punto de inflexión de la curva (ver Barba et al., 1993). Para la población de Sagunto (Barba et al., 1993), se encontró que A = 17,86 g, y k = 0,39 g·d-1. En dos poblaciones tarraconenses los valores de k son0,35 y 0,45 g d-1 (Iglesias, 1996). El peso asintótico medio está positivamente relacionado con el volumen medio de los huevos. La tasa media de crecimiento está negativamente relacionada con el tamaño de puesta. Aquellos pollos que, naciendo tarde, llegan a sobrevivir, crecen más despacio que sus hermanos, pero el peso asintótico alcanzado no varía (Barba, 1991). Y los pollos que tienen mayor reflectancia en el UV en la mancha amarilla de la nuca crecen más deprisa, debido probablemente a que los padres los ceban a ellos preferentemente (Galván et al., 2008).
Peso: Los pollos normalmente son pesados el día 15 de vida (considerando el día de nacimiento como día 0), que es el último día que se pueden manipular sin demasiado riesgo de abandono del nido. Monrós et al. (2002a) estudian el peso de los pollos de Carbonero común en el nido el día 15 de vida, siendo éste de 17,20 g (DT = 1,24, rango = 13,9-19,8, n = 111 pollos). En esta población, el peso medio de los pollos fue de 15,77 g (DT = 1,49, n = 21) en 2006 y de 16,65 g (DT = 0,49, n = 10) en 2007, existiendo una variación interanual (Álvarez y Barba, 2011). Barba et al. (1995) muestran que los pollos de puestas retrasadas experimentalmente son más ligeros en el día 15 (media 16,41 g, DT = 1,40, n = 22) que los controles (media 16,89 g, DT = 1,29, n = 40), y alcanzan un peso asintótico más bajo. El calentamiento o enfriamiento experimental de los nidos no provoca efectos detectables sobre el peso de los pollos a los 5, 9 y 15 días de vida (Rodríguez et al., 2013). Los pollos más pesados el día 15 de vida tienden a perder peso al abandonar el nido, mientras que los más ligeros tienden a ganarlo Monrós et al., 2002a). En Sierra Morena (sur de España) durante los años 1989 a 1991 los pollos son más pesados en el pinar (16,53 g; n = 156 puestas) que en el encinar (15,62 g; n = 61 puestas; Maícas y Fernández, 1996). En el pinar, los pollos de las puestas tempranas (17,33 g, DT = 2,42; n = 86) son más pesados que los de las puestas tardías (15,55 g, DT = 1,68; n = 70), no habiendo diferencias en el encinar (15,60 g, DT = 1,71; n = 53 vs, 15,10 ± 2,60 g; n = 8). En cambio, durante tres estaciones reproductoras (2005 a 2007) los pollos son más pesados (16,76 g, DT = 0,24 vs, 15,47 g, DT = 0,55) en el encinar de Font Roja que en el pinar de Sierra Mariola (Atiénzar et al.,2010). Y dentro del bosque, los pollos criados en cajas-nido localizadas en parcelas con vegetación inmadura difieren poco en peso de aquellos criados en parcelas de vegetación madura (Atiénzar et al., 2010). En Mata do Urso el peso de los pollos está correlacionado negativamente con el tamaño de puesta en 2009 (Costa et al., 2012). En dos encinares tarraconenses el peso medio de los pollos es de 16,02 g (Iglesias, 1996). En Mata de Quiaios el peso medio de los pollos de las primeras puestas es de 15,06 g (DT = 1,95) y en Mata do Urso de 14,79 g (DT = 1,89) entre los años 2003 y 2010 (Costa et al., 2012). Los de las segundas puestas es de 17,62 g (DT = 1,37, n = 26 nidos) en Mata de Quiaios y de 17,89 g (DT = 1,06, n = 31 nidos) en Mata do Urso desde 2003 hasta 2009, siendo los pollos de las segundas puestas más pesados que los de las primeras en ambas áreas (Costa et al., 2011).Tarso: La longitud media del tarso en los pollos es aproximadamente 19 mm en las poblaciones españolas analizadas. Existen datos en los siguientes hábitats: carrascal (19,24 mm, DT = 0,11; Atiénzar et al., 2010), pinar (18,99 mm, DT = 0,26; Atiénzar et al., 2010), y naranjal (19,17 mm, DT = 0,63, n =21 en 2006, y de 19,30 mm, DT = 0,37, n = 10 en 2007; Álvarez y Barba, 2011). El enfriamiento experimental de los nidos entre la eclosión y el día 14 de vida de los pollos provoca que el tarso alcance una menor longitud que en nidos controles; el calentamiento experimental de los nidos no provoca ningún efecto en el tamaño del tarso (Rodríguez et al., 2013). Condición: La condición (peso/longitud tarso) media de los pollos en Sagunto en 2006 es de 0,82 g·mm-1 (DT = 0,07, n = 21) y en 2007 de 0,86 (DT = 0,03, n = 10; Álvarez y Barba, 2011). Los pollos tienen mejor condición (0,87, DT = 0,01 vs, 0,81, DT = 0,02) en un encinar que en un pinar (Atiénzar et al., 2010), en cajas-nido rodeadas por vegetación madura (Sánchez et al., 2007), y si son atendidos por machos mayores de un año (Álvarez y Barba, 2011). Los pollos de tres hábitats distintos (Sagunto, Sierra Mariola y Font Roja) están en peor condición cuando la cantidad de palitos y plumas, y la proporción de plumas, de los nidos aumenta (Álvarez et al., 2012). Otra medida de condición está basada en la respuesta inmune. Ésta es dependiente del sexo, mostrando las hembras mayores niveles de respuesta, debido al efecto inmunosupresivo de la testosterona en machos (Barbosa y Moreno, 2002). La evaluación de dicha respuesta inmune se puede realizar midiendo la reacción ante una inyección de fitohemaglutinina (PHA), la cual se utiliza como indicador de la salud de los individuos (Tella et al., 2008). El valor medio de la respuesta inmune en los pollos que obtuvieron en Sagunto en 2006 es de 0,61 (DT = 0,16, n = 18) y en 2007 de 0,48 (DT = 0,16, n = 9; Álvarez y Barba, 2011), siendo datos similares a los encontrados en otras poblaciones (Tschirren et al., 2003;Nilsson et al., 2007), y no se encuentra además una variación interanual entre ellos. En un estudio de Norte et al. (2009b) donde sólo el 5,7% de pollos de primeras puestas estaban infectados, los de las cajas-nido infectadas tuvieron una proporción heterofilo/linfocito más bajo. En Mata de Quiaios los pollos tenían al volar un índice de grasa (Kaiser, 1993) de 1,49 (DT = 0,91, n = 87 pollos) y en Mata do Urso de 1,72 (DT = 1,02, n = 47 pollos), y un índice de músculo pectoral (Bairlein, 1995) en Mata de Quiaios de 1,88 (DT = 0,67, n = 87 pollos) y en Mata do Urso de 1,98 (DT = 0,46, n = 44 pollos; Costa et al., 2005).
Estructura y dinámica de poblaciones Desempeño reproductor Éxito del nido En este apartado consideramos que el nido tiene éxito si al menos un pollo lo abandona con vida. De acuerdo con Barba (1991) de las 122 primeras puestas consideradas en Sagunto, fracasan 31, es decir, el 25% de las puestas. En Sierra Morena durante los años 1989-91 y considerando todos los nidos, 62 (36 %) parejas sufrieron fracaso total, 37 de ellas (56 %) localizadas en el pinar y 25 (47 %) en el encinar (Maícas y Fernández, 1996). La mayoría de fracasos totales aparecieron durante la fase de huevo en el pinar (35 %), y durante la fase de pollo los fracasos reproductivos fueron más frecuentes en el encinar (23 %) que en el pinar (17 %). Según Belda (1996), el porcentaje de nidos que fracasan es de 43,2 % (n = 127) en el quejigal de Pitarque entre los años 1991 y 1995, de 65,4 % (n = 52) en el encinar de Monte Poblet entre 1989 y 1992, y de 30,6 % (n = 40) en el pinar de La Pena entre 1992 y 1995. En Leiria la proporción media de primeras puestas fracasadas desde 2001 a 2004 es de 10% y en Apostiça del 20% (datos estimados de la Figura 2 en Pimentel y Nilsson, 2007a). El fracaso del segundo intento reproductor fue significativamente menor en Leiria (0-25%) que en Apostiça (18-42%; Pimentel y Nilsson, 2007a). Las principales causas de fracaso del nido suelen ser la depredación (Atiénzar et al., 2010) y el abandono (Maícas y Fernández, 1996; Atiénzar et al., 2010). La probabilidad de pérdida de nidos por inanición no muestra ningún tipo de tendencia estacional (Iglesias, 1996). En un experimento donde se manipuló la calidad del nido, en Sagunto, se encontró que la proporción de nidos donde vuela al menos un pollo es más baja en los nidos de peor calidad (Álvarez y Barba, 2007). Número de huevos eclosionados: En Mata de Quiaios, el número medio de huevos eclosionados es de 5,2 (DT = 1,14, n = 20) y en Mata do Urso es de 6,13 (DT = 1,51, n = 15; Costa et al., 2005). En el carrascal eclosionan más huevos (6,28, ET = 0,23) que en el pinar (5,82, ET = 0,52); Atiénzar et al., 2010). En Sagunto (desde 1992 hasta 2009) el número de eclosiones mejora con la edad de los padres hasta los 3-4 años y disminuye progresivamente a edades más avanzadas (Betancourt et al., 2010). Las hembras con mayor número de huevos eclosionados tienen mayor actividad de la glutatión peroxidasa (Norte et al., 2010a). Éxito de eclosión Definido como el porcentaje de huevos eclosionados respecto al número de huevos puestos (Álvarez y Barba, 2008). El éxito en la eclosión ronda entre el 83 y el 93% para la población de Sagunto (Barba et al., 1994; Monrós et al., 1998; Álvarez y Barba, 2009). El éxito medio de eclosión en puestas donde más de un huevo eclosionó en esa localidad en el año 1994 fue del 88% (DT = 12, n = 8; Monrós et al., 1998), y fue elevado tanto en 1988 (90%, n = 19), en 1989 (93%, n = 11), como en 1990 (90%, n = 9; Barba et al., 1994). El éxito de eclosión medio encontrado por Álvarez y Barba (2011) en 2006 fue de 85,74% (DT = 9,03, n = 26) y en 2007 fue de 75,05% (DT = 14,41, n = 16), pero estas medias se calcularon sobre valores transformados (arcoseno de la raíz cuadrada; Zar, 1996). En Mata de Quiaios el éxito de eclosión fue de 88,25% en 2003 y 95% en 2005, y en Mata do Urso fue del 91,31% en 2003 y de 86% en 2005 (Costa et al., 2005; Norte et al., 2010b). El éxito de eclosión puede verse afectado por diversos factores: -1) Variación interanual: Álvarez y Barba (2011) encuentran variación interanual en el éxito de eclosión en Sagunto, siendo mayor en 2006 que en 2007. En cambio, Barba et al. (1994) no la encuentran para la misma población en los años 1988, 1989 y 1990. -2) Composición vegetal: Dentro de un bosque heterogéneo, el éxito de eclosión es mayor en cajas-nido rodeadas por Pino carrasco (89,93 %, ET = 2,41) que las rodeadas por Pino piñonero (82,78 %, ET = 3,87; Atiénzar et al., 2010). -3) Madurez y estructura de la vegetación: Conforme el hábitat es más maduro y menos denso, la probabilidad de que el nido sea depredado durante la incubación aumenta y el éxito de eclosión disminuye (Atiénzar et al., 2010). -4) Temperatura: En la población de Sagunto, el éxito de eclosión se ve afectado negativamente por las temperaturas durante el periodo de puesta de los huevos (Barba et al., 2007). -5) Características del nido: Los nidos de mayor calidad manipulados experimentalmente (mayor proporción de material en el nido capaz de mantener una temperatura adecuada) tienen mayor éxito de eclosión (Álvarez y Barba, 2009). El éxito de eclosión aumenta con el peso de musgo de los nidos en Sagunto (Álvarez et al., 2012). -6) Relación genética parental: La heterocigosidad en un solo locus (Ase 18) explica una gran proporción de la variación de caracteres asociados con la eficacia biológica. Se ha encontrado una relación negativa entre relación genética parental y éxito de nacimientos y la heterocigosidad maternal estaba asociada con el tamaño de los pollos (García-Navas et al., 2014)1. Número de pollos que vuela por nido (volanderos) En Sagunto, el número medio de pollos que vuela por nido en 2006 es de 6,73 (DT = 1,49, n = 22 nidos) y en 2007 de 6,60 (DT = 1,65, n = 10 nidos; Álvarez y Barba, 2011). En este lugar, desde 1992 hasta 2009, se observa que el número de volanderos mejora con la edad de los padres hasta los 3-4 años y disminuye progresivamente a edades más avanzadas (Betancourt et al., 2010, ver excepción en Belda, 1996). En Mata de Quiaios el número medio de pollos que vuelan por nido en primeras puestas es de 3,70 (DT = 1,58) y en Mata do Urso es de 5,12 (DT = 1,86) entre los años 2003 y 2010. (Costa et al., 2012). En Leiria el número medio de volanderos de primeras puestas desde 2001 hasta 2004 es de 5,4 (DT = 0,1, n = 4 años) y en Apostiça de 6,0 (DT = 0,5, n = 4 años; datos estimados de la Figura 2 en Pimentel y Nilsson, 2007a). En un rebollar, el número medio de volanderos de primeras puestas fue de 7,4 (DT = 0,69, n = 32 nidos, años 1984 y 1985; Pascual, 1985). El número medio de volanderos producidos en las segundas puestas es de 5,8 (DT = 1,71; Sanz, 1998). En Leiria desde 2001 hasta 2004 es de 4,7 (DT = 0,59, n = 4 años) y en Apostiça de 2,7 (DT = 0,51, n = 4 años) siendo significativamente mayor en la primera (datos estimados a partir de la Figura 5 en Pimentel y Nilsson, 2007a). En Mata de Quiaios es de 4,17 (DT = 1,31) y en Mata do Urso de 4,95 (DT = 1,49) desde 2003 hasta 2009 (Costa et al., 2011). El número de volanderos producidos en segundas puestas es menor que en primeras puestas en Leiria y en Apostiça (Pimentel y Nilsson, 2007a). En una de las tres áreas de estudio de Leiria, hay una fase de irrupción de larvas de procesionaria del pino Thaumetopoea pityocampa durante el verano que favorece el incremento del número de volanderos en segundas puestas (Pimentel y Nilsson, 2009). Analizando las primeras y segundas puestas juntas, el número de volanderos producidos por puesta disminuye significativamente con la fecha de eclosión en Apostiça, pero no en Leiria (Pimentel y Nilsson, 2007a). El número medio de volanderos producidos a lo largo de toda la estación reproductora por una pareja reproductora exitosa en Leiria es de 8,32 (ET = 0,39, n = 81 nidos) y en Apostiça de 7,66 (ET = 0,24, n = 142 nidos), siendo significativamente mayor en la primera (Pimentel y Nilsson, 2007a). En Mata do Urso el número de pollos decrece con la fecha de puesta considerando los años desde 2003 hasta 2009 (costa et al., 2011), y aumenta con el tamaño de puesta en 2009 (Costa et al., 2012). Considerando todos los nidos, Iglesias (1996; ver Tabla 6) muestra que existieron variaciones interanuales del número de pollos supervivientes por nido, siendo mayor en 1993 respecto al resto de años, y no encontrando diferencias entre áreas de estudio. Excluyendo los nidos depredados, el análisis de los datos correspondientes a 1993 no mostró variaciones de este parámetro entre áreas de estudio (ver Tabla 6). El número medio de pollos que vuelan por nido para cada hábitat no presenta variaciones entre años. En ninguno de los hábitats estudiados encuentra diferencias respecto al número medio de pollos que vuelan por nido, ni que la proporción de pollos que vuelan por nido decrezca significativamente a medida que avanza la estación (Tabla 6).
Tabla 6. Valores medios del número de pollos supervivientes por nido considerando y excluyendo la depredación para distintas localidades españolas.
Tanto considerando todas las puestas, como sólo las puestas exitosas (en las que vuela al menos un pollo), en Sierra Morena durante tres años consecutivos, en el pinar se producen más pollos por puesta que en el encinar (Tabla 7; Maícas y Fernández, 1996). En el pinar, los nidos tempranos producen más pollos que los tardíos (Tabla 7), no encontrándose estas diferencias en el encinar. En cambio, en el encinar de Font Roja vuelan más pollos (media = 5,71, ET = 0,32) que en el pinar de Sierra Mariola (media = 5,09, ET = 0,73; Atiénzar et al., 2010).
Tabla 7. Efecto del tipo de hábitat y de la estacionalidad sobre los parámetros reproductivos del Carbonero común.
Éxito de vuelo Definido como el porcentaje de pollos que vuelan respecto a los pollos que han nacido (Álvarez y Barba, 2008; Atiénzar et al., 2010). El éxito de vuelo medio para la población de Sagunto fue de 68,51% (DT = 14,57, n = 22) en 2006 y de 71,11% (DT = 13,78, n = 10) en 2007 (Álvarez y Barba, 2011). En Mata de Quiaios el éxito de vuelo fue de 80,62% (DT = 0,25, n = 20) y en Mata do Urso de 83,84% (DT = 0,9, n = 15; Costa et al., 2005). Los factores que pueden afectar a este parámetro son: -Variación estacional: No se observa ningún patrón en la variación estacional de la fracción de pollos supervivientes sobre el tamaño de puesta (Iglesias, 1996). -Características del nido: El éxito de vuelo es mayor en las cajas situadas experimentalmente a mayor altura que en las de menor altura (Gil-Delgado y Barba, 1987). Además, el éxito de vuelo aumenta con el tamaño global del nido (Álvarez y Barba, 2011). -Características de los padres: El éxito de vuelo es mayor en nidos atendidos por machos con menor longitud de tarso en 2006 y 2007 (Álvarez y Barba, 2011), y con una mayor probabilidad de infección por Haemoproteus (Norte et al., 2009b). -Fecha de vuelo: Las parejas que criaron en nidos retrasados experimentalmente tuvieron un éxito de vuelo más bajo que los que lo hicieron tempranamente (Barba et al., 1995). Éxito reproductor Definido como el porcentaje de pollos que vuelan respecto a los huevos puestos (Álvarez y Barba, 2008; Atiénzar et al., 2010). En la Tabla 8 se muestran los diferentes valores medios del éxito reproductor en distintas poblaciones ibéricas.
Tabla 8. Resumen de los diferentes hábitats donde se han calculado los valores medios del éxito reproductor a nivel nacional. *medias calculadas sobre los valores transformados (arcoseno de la raíz cuadrada; Zar, 1996).
Varios factores pueden afectar al éxito reproductor: -1) Variación interanual: En Sagunto hubo variación interanual en tres años de estudio: 81% (1988, n = 19 nidos), 56% (1989, n = 11 nidos) y 77% (1990, n = 9 nidos; Barba et al., 1994). En cambio, no se encontraron variaciones interanuales entre los tres hábitats estudiados (quejigal, encinar y pinar) por Belda (1996). -2) Variación entre hábitats: No se conoce efecto alguno del hábitat sobre el éxito reproductor (Belda, 1996; Sanz et al., 2010). -3) Disponibilidad de alimento: El éxito reproductor de las aves está relacionado con la abundancia de alimento (polillas y orugas; Barba et al., 2004; Atiénzar, 2009), y pese a que la dieta de los pollos en Sagunto es relativamente “rara” (ver apartado de Dieta), el éxito reproductor es elevado. En Sagunto los pollos de las primeras puestas más tempranas se alimentan de orugas y alcanzan un éxito reproductor elevado. Los pollos de primeras puestas más tardías se alimentan principalmente de polillas del Gusano gris Peridroma saucia, y también alcanzan un éxito reproductor elevado. Sin embargo, los pollos de segundas puestas son alimentados con polillas de varias especies, pero el éxito reproductor es bajo (Barba et al., 2004). Por otra parte, es importante que el periodo de máxima demanda de alimento por parte de los pollos coincida aproximadamente con la máxima abundancia de alimento en el hábitat (p. ej. Perrins, 1991). Hay varios trabajos en España en los que se ha estudiado esta posible sincronización (Barba, 1991; Belda, 1996; Iglesias, 1996; Atiénzar, 2009), pero no se han analizado sus posibles consecuencias en el éxito reproductor tal y como lo definimos en ese apartado. -4) Características y ubicación del nido: La tasa de éxito, que es una combinación de los éxitos de eclosión, de vuelo y de reproducción, aumenta al aumentar el tamaño del nido (Álvarez y Barba, 2008). La altura a la que está situada la entrada del hueco de un nido natural afecta positivamente al éxito reproductor (Gil-Delgado y Barba, 1987). -5) Características del individuo: Hembras grandes muestran un éxito reproductor mayor (Álvarez y Barba, 2008). Supervivencia juvenil La probabilidad de reclutamiento (supervivencia de un individuo desde que sale del nido hasta su primer año de vida) aumenta con el peso adquirido al abandonar el nido. Otro de los factores que parece afectar a dicha probabilidad es la fecha de eclosión (Monrós et al., 2002b). Sin embargo, estudios posteriores muestran que la variable importante, además del peso de los pollos, es la temperatura ambiental durante el periodo de estancia en el nido: la supervivencia aumenta si la temperatura es menor (Greño et al., 2008). El tamaño de puesta parece también influir en dicha supervivencia, disminuyendo para puestas aumentadas de manera experimental (Atiénzar, 2009). Senescencia La senescencia es un declive de las capacidades fisiológicas de los individuos con la edad, afectando a su capacidad reproductora y/o a su probabilidad de supervivencia, y limitando, por tanto, su eficacia biológica (Nussey et al., 2008; Ricklefs, 2008). Este proceso, en una población mediterránea (Sagunto), parece iniciarse a partir de los 4-5 años de edad (n = 2200 individuos; Betancourt et al., 2010).
Referencias Álvarez, E. (2007). Calidad del nido, ¿buen seguro de vida? Informe de la ayuda a la investigación concedida por SEO/BirdLife (Madrid). Álvarez, E., Barba, E. (2008). Nest quality in relation to adult bird condition and its impact on reproduction in Great tits. Acta Ornithologica, 43: 3-9. Álvarez, E., Barba, E. (2009). ¿Cómo afecta la calidad del nido per se al proceso de incubación?: una aproximación experimental. Revista Catalana d'Ornitologia, 25: 11-18. Álvarez, E., Barba, E. (2011). Nest characteristics and reproductive performance in Great tits Parus major. Ardeola, 58: 125-136. Alvarez, E., Barba, E. (2014a). Incubation and hatching periods in a Mediterranean Great Tit Parus major population. Bird Study, 61 (2): 152-161. Alvarez, E., Barba, E. (2014b). Behavioural responses of great tits to experimental manipulation of nest temperature during incubation. Ornis Fennica, 91 (4): 220-230. Alvarez, E., Belda, E. J., Verdejo, J., Barba, E. (2013). Variation in Great Tit nest mass and composition and its breeding consequences: a comparative study in four Mediterranean habitats. Avian Biology Research, 6 (1): 39-46. Álvarez, E., Encabo, S. I., Barba, E. (2005). Keeping pace with global warming: long-term changes in laying dates of Great tits in eastern Spain. Póster presentado en el 5th Meeting of the European Ornithologists’ Union. Estrasburgo (Francia). Álvarez, E., Encabo, S. I., Barba, E. (2006). Climate change moves Mediterranean Great tit breeding season two weeks forward in 18 years. Póster presentado en el 24th International Ornithological Congress. Hamburgo (Alemania). Andreu, J., Barba, E. (2006). Breeding dispersal of Great tits Parus major in a homogeneous habitat: effects of sex, age, and mating status. Ardea, 94: 45-58. Atiénzar, F. (2009). Feeding and breeding ecology of three insectivorous birds in Mediterranean ecosystems. Tesis doctoral. Universitat de València. València. Atiénzar, F., Visser, M. E., Greño, J. L., Holleman, J. M., Belda, E. J., Barba, E. (2010). Across and within-forest effects on breeding success in Mediterranean Great tits Parus major. Ardea, 98: 77-89. Bairlein, F. (1995). Manual of field methods. European-African songbird migration network. Institut für Vogelforschung, Wilhelmshaven. Barba, E. (1991). Ecología de reproducción del Carbonero común Parus major en el naranjal valenciano. Tesis Doctoral, Universidad de Valencia. Valencia. Barba, E., Encabo, S. I., Álvarez, E. (2007). Temperature-related changes in Mediterranean Great tit breeding season and (lack of) consequences in breeding performance.Póster presentado en la Hole-breeding Passerines Conference. Bialowieza (Polonia). Barba, E., García, D. M., Gil-Delgado, J. A., López, G. M. (1994). Moth abundance and breeding success in a Great tit population where moths are the main nestling food. Ardea, 82: 329-334. Barba, E., Gil-Delgado, J. A., López, G. (1988). El tamaño de la puesta del Carbonero común (Parus major) en los naranjales valencianos y en el encinar de Monte Poblet (Tarragona). Mediterránea Serie Biológica, 10: 5-11. Barba, E., Gil-Delgado, J. A., Monrós, J. S. (1993). Factors affecting nestling growth in the Great tit Parus major. Ardeola, 40: 121-131. Barba, E., Gil-Delgado, J. A., Monrós, J. S. (1995). The costs of being late: consequences of delaying Great tit Parus major first clutches. Journal of Animal Ecology, 64: 642-651. Barba, E., Gil-Delgado, J. A., Monrós, J. S. (2004). Relationship between chick diet and breeding performance of Great tits in a caterpillar-poor environment. pp. 233-238. En: Van Emden, H. F. y Rothschild, M. (eds.) Insect and bird interactions. Intercept, Cambridge. Barba, E., López, J. A. (1990). Altura de nidificación del Carbonero común Parus major en el naranjal: preferencias, limitaciones del medio, y relaciones interespecíficas. Doñana, Acta Vertebrata, 17: 49-55. Barbosa, A., Moreno, E. (2002). Sex differences in T-cell-mediated immune response in Great tits Parus major. Avian Science, 2: 99-102. Baucells, J. (1990). Freqüència de postes mixtes en el gènere Parus. Butlletí del Grup Català d’Anellament, 7: 13-17. Belda, E. J. (1996). Estrategias de vida del Carbonero común Parus major y del Herrerillo común P. caeruleus en el área Mediterránea. Tesis Doctoral, Universidad de Valencia. Valencia. Belda, E. J., Barba, E., Gil-Delgado, J. A., Iglesias, D. J., López, G. M., Monrós, J. S. (1998). Laying date and clutch size of Great tits Parus major in the Mediterranean region: a comparison of four habitat types. Journal of Ornithology,139: 269-276. Betancourt, Z., Álvarez, E., Andreu, J., Monrós, J.S., Barba, E. (2010). Envejeciendo...pero tarde. Póster presentado en el XIII Congreso Nacional y X Iberoamericano de Etología. Instituto de Investigación en Recursos Cinegéticos (IREC). Ciudad Real. Broggi, J., Senar, J. C. (2009). Brighter Great tit parents build bigger nests. Ibis, 151: 588-591. Cantó, J. L. (2008). Rastros, huellas y señales de la fauna mediterránea. Editado por J. L. Cantó y Caja Mediterráneo. Alcoy. Costa, R. A., Eeva, T., Eira, C., Vaqueiro, J., Vingada, J. V. (2011). Effects of air pollution from pulp and paper industry on breeding success of Great tit in maritime pine forests. Écoscience, 18: 115-123. Costa, R. A., Eeva, T., Eira, C., Vaqueiro, J., Vingada, J. V. (2012). Trace elements in faeces of Great tit nestlings in relation to breeding performance in Coastal areas in Central Portugal. Archives of Environmental Contamination and Toxicology, 63: 594-600. Costa, R. A., Petronilho, J. M. S., Vingada, J. V. (2005). Breeding biology of the Great tit in two maritime pine forests in the region of Figueira da Foz (Beira Litoral, Portugal). Wildlife Biology in Practice, 1: 33-40. Cramp, S., Perrins, C. M. (Eds.) (1993) Handbook of the Birds of Europe the Middle East and North Africa. The Birds of the western Palearctic. Volume VII. Flycatchers to Shrikes. Oxford University Press, Oxford. De la Puente, J., Yanes, M. (1995). Tasas de depredación en nido de paseriformes ibéricos nidificantes por encima del suelo. Ardeola, 42: 139-146. Encabo, S. I., Barba, E., Gil-Delgado, J. A., Monrós, J. S. (2001b). Fitness consequences of egg shape variation: a study on two passerines and comments on the optimal egg shape model. Ornis Fennica, 78: 83-92. Encabo, S. I., Monrós, J. S., Barba, E. (2001a). Egg size variation in a Mediterranean Great tit Parus major population. Ardeola, 48: 63-70. Fernández-Juricic, E. (2000). Efectos de la fragmentación forestal sobre poblaciones y comunidades de aves en un ambiente urbano. Tesis Doctoral, Universidad Complutense de Madrid. Madrid. Galván, I., Barba, E., Piculo, R., Cantó, J. L., Cortés, V., Monrós, J. S., Atiénzar, F., Proctor, H. (2008). Feather mites and birds: an interaction mediated by uropygial gland size? Journal of Evolutionary Biology, 21: 133-144. Galván, I., Sanz, J. J. (2008). The cheek plumage patch is an amplifier of dominance in Great tits. Biology Letters, 4: 12-15. García, J. (1983). Mallerenga carbonera. Pp 239-240. En: Muntaner, J., Ferrer, X., Martínez-Vilalta, A. (Eds.) Atlas dels ocells nidificants de Catalunya i Andorra. Ketres, Barcelona. García-Navas, V., Cáliz-Campal, C., Ferrer, E. S., Sanz, J. J., Ortego, J. (2014). Heterozygosity at a single locus explains a large proportion of variation in two fitness-related traits in great tits: a general or a local effect? Journal of Evolutionary Biology, 27 (12): 2807-2819. García-Navas, V., Ferrer, E. S., Cáliz-Campal, C., Bueno-Enciso, J., Barrientos, R., Sanz, J. J., Ortego, J. (2015). Spatiotemporal and genetic contingency of extrapair behaviour in a songbird. Animal Behaviour, 106: 157-169. Gibb, J. A. (1950). The breeding biology of Great and Blue Titmice. Ibis, 92: 507-539. Gil-Delgado, J. A., Barba, E. (1987). Aves nidificantes en huecos de los naranjos. Mediterránea Serie Biológica, 9: 29-40. Gil-Delgado, J. A., López, G., Barba, E. (1992). Breeding ecology of the Blue tit Parus caeruleus in eastern Spain: a comparison with other localities with special reference to Corsica. Ornis Scandinavica, 23: 444-450. González, E., de Eulate, J. A. (1974). Avance sobre resultados obtenidos en nidales artificiales en el Valle de Jaizubia. Munibe, 26: 79-92. Gosler, A. G. (1993). The Great tit. Hamlym, London. Greño, J. L., Belda, E., Barba, E. (2008). Influence of temperatures during the nestling period on post-fledging survival of Great tit Parus major in a Mediterranean habitat. Journal of Avian Biology, 39: 41-49. Hinde, R. A. (1952). The behaviour of the Great tit (Parus major) and some other related species. Behaviour, Supplement 2. Hiraldo, F. (1973). Parus major nidificando en noviembre. Ardeola, 19: 35-36. Iglesias, D. J. (1996). Efecto de la abundancia de alimento sobre los parámetros reproductores de los páridos en un encinar valenciano. Tesis Doctoral, Universidad de Valencia. Valencia. Kaiser, A. (1993). A new multi-category classification of subcutaneous fat deposits of songbirds. Journal of Field Ornithology, 62:246-255. Kluijver, H. N. (1951). The population ecology of the Great tit, Parus m. major L. Ardea, 39: 1-135. Lambrechts, M. M., Adriaensen, F., Ardia, D. R., Artemyev, A. V., Atiénzar, F., Bańbura, J., Barba, E., Bouvier, J.-C., Camprodon, J., Cooper, C. B., Dawson, R. D., Eens, M., Eeva, T. Faivre, B., Garamszegi, L. Z., Goodenough, A. E., Gosler, A. G., Grégoire, A., Griffith, S. C., Gustafsson, L., Johnson, L. S., Kania, W., Keišs, O., Llambias, P. E., Mainwaring, M. C., Mänd, R., Massa, B., Mazgajski, T. D., Møller, A. P., Moreno, J., Naef-Daenzer, B., Nilsson, J.-Å., Norte, A. C., Orell, M., Otter, K. A., Park, C. R., Perrins, C. M., Pinowski, J., Porkert, J., Potti, J., Remes, V., Richner, H., Rytkönen, S., Shiao, M.-T., Silverin, B., Slagsvold, T., Smith, H. G., Sorace, A., Stenning, M. J., Stewart, I., Thompson, C. F., Tryjanowski, P., Török, J., Van Noordwijk, A. J., Winkler, D. W., Ziane, N. (2010). The design of artificial nestboxes for the study of secondary hole-nesting birds: a review of methodological inconsistencies and potential biases. Acta Ornithologica, 45: 1-26. Maicas, R., Fernández, J. (1996). Breeding patterns of the Great tits Parus major in a pine plantation and a Holm oak forest in a Mediterranean region (southern Spain). Revue d'Ecologie (Terre et Vie), 51: 341-357. Makatsch, W. (1976). Die Eier der Vögel Europas, vol. 2. Neuman Verlag, Leipzig. Monrós, J. S., Belda, E. J., Barba, E. (1998). Delays of the hatching dates in Great tits Parus major: Effects on breeding performance. Ardea, 86: 213-220. Monrós, J. S., Belda, E. J., Barba, E. (2002b). Post-fledging survival of individual Great tits: the effect of hatching date and fledging mass. Oikos, 99: 481-488. Monrós, J. S., Encabo, S. I., Barba, E. (2002a). Variación del peso de los pollos de Carbonero común Parus major tras abandonar el nido. Revista de Anillamiento,9-10: 53-55. Monrós, J. S., Gómez, J., Encabo, S. I., Bradt, S., Barba, E., Gil-Delgado, J. A. (1999). Open nesting in Great tits Parus major. Ardeola, 46: 89-91. Moreno-Rueda, G. (2002-2003). Selección de cajas-nido por aves insectívoras en Sierra Nevada. Zoología baetica, 13/14: 131-138. Nilsson, J-Ǻ., Granbom, M., Råberg, L. (2007). Does the strength of an immune response reflect its energetic cost? Journal of Avian Biology, 38: 488-494. Norte, A. C., Araújo, P. M., Sampaio, H. L., Sousa, J. P., Ramos, J. A. (2009b). Haematozoa infections in a Great tit Parus major population in Central Portugal: relationships with breeding effort and health. Ibis, 151: 677-688. Norte, A. C., Ramos, J. A., Sampaio, H. L., Sousa, J. P., Sheldon, B. C. (2010a). Physiological conditionand breeding performance of the Great tit. The Condor, 112: 79-86. Norte, A. C., Sheldon, B. C., Sousa, J. P., Tavares, P. C., Pereira, M. E., Duarte, A. C., Ramos, J. A. (2010b). Are Great tits (Parus major) inhabiting the vicinity of a pulp mill healthy? Impacts on physiology and breeding performance. Archives of Environmental Contamination and Toxicology, 59: 502-512. Nussey, D. H., Coulson, T., Festa-Bianchet, M., Gaillard, J.-M. (2008). Measuring senescence in wild animal populations: towards a longitudinal approach. Functional Ecolology, 22: 393-406. Pascual, J. A. (1985). Ocupación de cajas anideras en montes de rebollo (Quercus pyrenaica, Willd) de la provincia de Salamanca. Boletín Estación Central de Ecología, 14: 35-46. Pérez de Ana, J. M. (2001). Estudio comparativo de siete modelos de cajas anidaderas. Quercus, 181: 16-120. Perrins, C. M. (1979). British Tits. Collins, London. Perrins, C. M. (1991). Tits and their caterpillar food supply. Ibis, 133 (Suppl.): 49-54. Pimentel, C., Nilsson, J. A. (2007a). Breeding patterns of Great tits (Parus major) in pine forests along the Portuguese west coast. Journal of Ornithology, 148: 59-68. Pimentel, C., Nilsson, J. A. (2009). Response of Great tits Parus major to an irruption of a pine processionary moth Thaumetopoea pityocampa population with a shifted phenology. Ardea, 95: 191-199. Quesada, J. (2007). Evolución de la coloración del plumaje basada en señales múltiples. Tesis Doctoral, Museu de Ciències Natural de Barcelona i Universitat de Barcelona. Barcelona. Ricklefs, R. E. (2008). The evolutionary ecology of senescence. Functional Ecology, 22: 379-392. Rodríguez, S., Álvarez, E., Barba, E. (2012). Temperaturas bajas en el nido limitan el crecimiento de los pollos: Un estudio experimental con el Carbonero común. Revista de Anillamiento, 31-32: 39-48. Royama, T. (1966). A reinterpretation of courtship feeding. Bird Study, 13: 116-129. Sánchez, S., Cuervo, J. J., Moreno, E. (2007). Does habitat structure affect body condition of nestlings? A case study with woodland Great tits Parus major. Acta Ornithologica, 42: 200-204. Sanz, J. J. (1998). Effects of geographic location and habitat on breeding parameters of Great tits. Auk, 115: 1034-1051. Sanz, J. J. (2000). Cajas-nido para aves insectívoras forestales. Colección Naturaleza y Medio Ambiente. Caja Segovia, Segovia. Sanz, J. J. (2001). Experimentally increased insectivorous bird density results in a reduction of caterpillar density and leaf damage to Pyrenean oak. Ecological Research, 16: 387-394. Sanz, J. J., García-Navas, V., Ruiz-Peinado, J. V. (2010). Effect of habitat type and nest-site characteristics on the breeding performance of Great and Blue tits (Parus major and P. caeruleus) in a Mediterranean landscape. Ornis Fennica, 87: 41-51. Tella, J. L., Lemus, J. A., Carrete, M., Blanco, G. (2008). The PHA test reflects acquired T-cell mediated immunocompetence in birds. Ecological Immunology, 3: 1-9. Tschirren, B., Fitze, P. S., Richner, H. (2003). Sexual dimorphism in susceptibility to parasites and cell-mediated immunity in Great tit nestlings. Journal of Animal Ecology, 72: 839-845. Zar, J. H. (1996). Biostatistical analysis. Third edition. Pretince Hall, New Jersey.
Francisco Atiénzar, Elena Álvarez y Emilio Barba Instituto “Cavanilles” de Biodiversidad y Biología Evolutiva (ICBiBE) Departamento de Vertebrados Terrestres, Universidad de Valencia C/ Catedrático José Beltrán nº 2, 46980 Paterna (Valencia) Fecha de publicación: 5-12-2012 Atiénzar, F., Álvarez, E., Barba, E. (2016). Carbonero común – Parus major. En: Enciclopedia Virtual de los Vertebrados Españoles. Salvador, A., Morales, M. B. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||