|
|
||||||||||||||||
|
||||||||||||||||
|
Para más información sobre cada apartado hacer click en:
|
Key words: Northern Goshawk, description, size, sexual dimorphism, variation, molt.
Nombres vernáculos Castellano: azor; catalán: astor; euskera: aztore arrunta; gallego: azor; (Clavell et al., 2005). Alemán: habicht; francés: autour des palombes; inglés: northern goshawk; italiano: astore comune; portugués: açor (Lepage, 2009).
Descripción Adulto marrón pizarra oscuro por encima, con la cabeza marrón negruzca, cejas blancas, finas y menos definidas hacia el sur del área de distribución, crema por debajo, con barras oscuras horizontales, más anchas y densas en el sur. Esta es la descripción de Ferguson-Lees y Christie (2001) para la subespecie nominal, A.g. gentilis. No obstante, existen grandes variaciones de color y tamaño entre regiones que permiten diferenciar sub-razas. De esta forma, en el mundo de la cetrería se suele hablar de azores finlandeses (entendiéndose por los fenoescandinavos, Fig. 1), con patentes plumas blancas en la espalda que contrastan con el dorso grisáceo y vientre blanco, de talla grande; azores alemanes (antiguamente clasificados como subespecie aparte A.g. gallinarum), con patrón de color y tamaño intermedio; azores ibéricos, oscuros y de talla modesta. Aunque las variaciones son también considerables dentro de los ibéricos. Los azores europeos incrementan un 4% su tamaño por cada 10° de latitud hacia el norte, de tal forma que los azores finlandeses son un 10% mayores que los de la islas mediterráneas (Kenward, 2006). Las diferencias de tamaño y color siguen un gradiente relacionado con la Regla de Bergman, siendo de volúmenes mayores y más claros en el norte y reduciéndose y oscureciéndose a medida que se avanza hacia el Mediterráneo. Como en otras especies de distribución geográfica parecida, las diferencias entre poblaciones no son sino un reflejo de la variación clinal de la especie, que da lugar a fenotipos muy diferenciados en los extremos del rango de distribución y fenotipos intermedios en las zonas de transición (Zuberogoitia et al., 2009a). Estas variaciones geográficas graduales han motivado la diferenciación de la especie en numerosas formas raciales (Kenward, 2006). Juvenil de apariencia parda, marrón oscuro por encima con márgenes pálidos, de color ante, en las coberteras y vientre crema-rojizo con barras verticales gruesas. Al igual que ocurre con los adultos, existe un gradiente de color del norte al sur de Europa, de forma que los azores juveniles son de vientre crema claro y espalda marrón grisácea en Fenoescandinavia (Fig. 2 y 3), oscureciéndose a medida que se desciende de latitud hasta llegar a los ibéricos, con vientre rojizo, barras verticales anchas y muy marcadas y espalda pardo grisácea oscura (Fig. 4 y 5). Estas variaciones de color, al igual que en el caso de los adultos, están relacionadas con los días/año de cobertura de nieve, los días de sol y la intensidad lumínica y probablemente tienen un significado adaptativo (Kenward, 2006).
Figura 1. Accipiter gentilis gentilis, hembra de segundo año de origen finlandés. © I. Zuberogoitia/E.M. Icarus.
Figura 2. Ejemplar hembra joven capturada en Álava, norte de España, en enero de 2008. El patrón de coloración del vientre, así como la cabeza y el dorso (Fig. 3) y su peso de 1.300 gr, sugieren que se trata de un ejemplar nórdico invernante. © I. Zuberogoitia/E.M. Icarus.
Figura 3. Vista dorsal del ejemplar hembra joven capturada en Álava, norte de España, en enero de 2008. El patrón dorsal claro, con abundantes manchas blancas y nuca blanquecina sugieren que se trata de un ejemplar nórdico invernante. © I. Zuberogoitia/E.M. Icarus.
Figura 4. Patrón juvenil de un macho de azor ibérico. El fondo del vientre es pardo-rojizo, con barras verticales. Las rémiges son, en general, más estrechas y puntiagudas que las adultas. Se observa un plumaje uniforme. © I. Zuberogoitia/E.M. Icarus.
Figura 5. Cola juvenil de azor ibérico macho. Se observa un plumaje uniforme. © I. Zuberogoitia/E.M. Icarus.
Tamaño y masa corporal Las medidas de la subespecie nominal según Ferguson-Lees y Christie (2001) son: ala ♂ 300-342 mm ♀ 336-385 mm; cola ♂ 205-235 mm ♀ 243-270 mm; tarso ♂ 68-78 mm ♀ 78-88 mm; masa corporal ♂ 517-1100 g ♀ 820-2200 g. En una muestra de 9 machos y 13 hembras adultos capturados en Bizkaia, norte de España (datos propios no publicados), las medidas fueron: ala ♂ 303-330 mm ♀ 335-366 mm; cola ♂ 213-263 mm ♀ 264-300 mm; tarso ♂ 69,5-80,6 mm ♀ 78-88,1 mm; masa corporal ♂ 650-756 g ♀ 815-1300 g. En otra muestra de 19 machos y 20 hembras adultos capturados en Pontevedra (García-Salgado, G., datos propios no publicados), las medidas fueron: ala ♂ 294-311 mm ♀ 329-353 mm; cola ♂ 215-227 mm ♀ 240-398 mm; tarso ♂ 68,0-78,4 mm ♀ 80,1-88,0 mm; masa corporal ♂ 616-726 g ♀ 888-1211 g. Los valores mínimos de cada medida se corresponden exactamente con los mínimos dados por Ferguson-Lees y Christie (2001), salvo la cola que es más larga, mientras que los valores máximos están notablemente por debajo de los generales, salvo la cola y el tarso. Por lo tanto, los azores ibéricos del norte de la península están en la parte inferior del rango de tamaño de la subespecie nominal, pero presentan cola y tarsos alargados, al igual que ocurre en el caso del halcón peregrino (Zuberogoitia et al., 2002).
Dimorfismo sexual El azor, como la gran mayoría de las especies del género Accipiter, muestra un gran dimorfismo sexual inverso. Esto quiere decir que las hembras son notablemente más grandes que los machos, hasta un 13% mayores en longitud del ala y un 61% en peso corporal (Kenward, 2006). Existen más de 20 hipótesis que tratan de explicar las razones de estas diferencias (Krüger, 2005). No obstante, en el caso del azor, la diferenciación de las tareas entre machos y hembras durante la reproducción (siendo el macho el principal proveedor de presas para la hembra y los pollos), el tamaño y la agilidad de las presas principales y el desarrollo de la actividad cinegética en entornos forestales de difícil maniobrabilidad, parecen ser algunas de las claves evolutivas del dimorfismo y podrían favorecer la selección de machos pequeños (Storer, 1966; Krüger, 2005; Sonerud et al., 2014; Martínez-Hesterkamp, 2015). En un trabajo realizado en Pontevedra, noroeste de la península Ibérica, Pérez-Camacho et al. (2015) vieron que los machos reproductores más pequeños tenían mejor condición corporal y producían más pollos que los grandes. Los machos más pequeños y más ágiles deberían ser más eficientes capturando presas pequeñas, que resultan las más abundantes (Storer, 1966). De acuerdo con esto, Tornberg et al. (1999) relacionaron la reducción del tamaño de los machos de azor en Finlandia desde los años 60, con una disminución de la abundancia de la presa principal (grandes lagópodos), y su reemplazo en la dieta por otras presas menores. Esto sugiere que la relación entre el tamaño de los machos y el éxito reproductor podría variar con la disponibilidad de presas de gran tamaño como lagomorfos o lagópodos. En las islas del Báltico, Penteriani et al. (2013) compararon el tamaño y la productividad de los azores en dos áreas próximas que diferían marcadamente en la abundancia de conejo, comprobando que precisamente, en ausencia de presas grandes es cuando los machos pequeños tenían más éxito reproductor, mientras que en condiciones de abundancia de conejo eran los machos grandes los que mostraban mayor productividad. Pérez-Camacho et al. (2015) no observaron diferencias en la tasa de aporte de presas de los machos según el tamaño, pero sí encontraron diferencias con respecto al tipo de presas que capturaban. Los machos pequeños tendían a capturar menos presas no forestales (palomas domésticas, tórtolas turcas y urracas) que los machos grandes que probablemente presentan una mayor potencia de vuelo en espacios abiertos (Alerstam et al., 2007). Basándose en estas diferencias, los autores del estudio sugieren que los machos pequeños tendrían ventajas en estadios tempranos del periodo reproductor, cuando las presas están en sus mínimos anuales y la posibilidad de capturar las presas más pequeñas y abundantes puede marcar la diferencia. En el caso de las hembras, un mayor tamaño sería ventajoso en la competencia con otras hembras por los machos y los territorios que estos poseen (Olsen y Olsen, 1987), y en la protección de los pollos durante la crianza (Mueller y Meyer, 1985), lo que favorecería la selección de hembras grandes. En consonancia con esto, Penteriani et al. (2013) detectaron una cierta correlación positiva entre el tamaño de las hembras y el tamaño de la pollada. Pérez-Camacho et al. (2015) no encontraron esta relación y tampoco que los machos más ventajosos (más pequeños) se emparejasen con hembras más grandes. Sin embargo, observaron que el tamaño corporal medio de las hembras reproductoras era probablemente mayor que el tamaño corporal medio de la población de hembras, sugiriendo también ventajas reproductivas (ventajas en la adquisición de territorio) para las hembras grandes.
Variación geográfica Variación clinal norte-sur y este-oeste, con aves más grande y claras en el norte y este y más pequeñas y oscuras en el sur y oeste (Glutz von Blotzheim et al., 1971; Cramp y Simmons, 1980). Ferguson-Lees y Christie (2001) sugieren la división en nueve subespecies o variaciones geográficas: A.g. gentilis- raza nominal, distribuido por Europa continental salvo el Norte de Fenoescandinavia y Rusia; A.g. arrigonii- endémico de Córcega y Cerdeña, de menor tamaño y más oscuro, con un barreado ventral más marcado; A. g. buteoides- distribuido por el borde septentrional de Escandinavia y Siberia, de tonos muy claros y barreado fino, siendo un 10% totalmente blancos, más grande que gentilis; A. g. albidus- propio del NE de Siberia y la península de Kamchatka, de tonos grises claros por el dorso, vientre blanco con rayado fino, cabeza con tonos blanquecinos, y el de mayores dimensiones; A .g. schvedowi- distribuido por las estepas asiáticas, de espalda gris pizarra, cabeza negruzca y barras ventrales finas y dispersas, más pequeño que el nominal; A. g. fujiyamae- originario del Japón, con tonos más oscuros, barreado más denso y más pequeño que el schvedowi. A. g. atricapillus- distribuido por la mayor parte de Norteamérica, gris azulado por el dorso, cabeza negra con ceja blanca muy marcada, grisáceo por el vientre, con finas barras ondulantes y de tamaño ligeramente por encima del A. g. gentilis. A. g. laingi- Concentrado en las islas de la costa del Pacífico canadiense, parecido al atricapillus pero más oscuro y con barras más densas; A.g. apache- distribuido por México y Arizona, más oscuro y de mayor tamaño que sus parientes americanos. El taxon A. g. kleinschmidti Von Jordans, 1950, descrito de Salamanca, cuya distribución se extendería por la P. Ibérica y el norte de África, no tiene validez (Cramp y Simmons, 1980). Antiguamente se alcanzaba a clasificar hasta 17 subespecies, añadiendo a las anteriormente citadas otras razas intermedias, como son A.g. marginatus en el este de Europa, A. g. gallinarum en Alemania, A. g. balcanicus en los Balcanes, A. g. moscovidae en Rusia, A. g. caucasicus en el Caucaso y Crimea, A. g. khamensis en Siberia, Tibet y Kazakhstan y A. g. peocilopterus en Siberia (Madrid-Millán, 2013). No obstante, Kenward (2006) sugiere que estas razas no muestran suficientes diferencias como para separarlas de las anteriores.
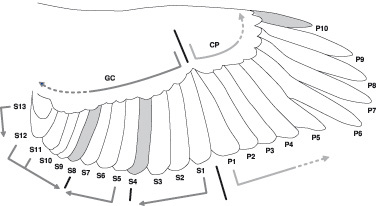
Muda La muda del azor sigue el mismo patrón descrito en España para el caso del gavilán común (Accipiter nisus, Fig. 6. Zuberogoitia et al., 2009b, Edelstam, 1984; Clark, 2004). Realizan una muda completa anual que comienza con la P1 y avanza hacia afuera (Fig. 7), siendo la P10 la última en cambiarse. En secundarias se observan dos/tres focos de inicio de muda, primero comienzan en S5, seguido de las secundarias más internas (S10-S11) y un tercer foco en S1, siguiendo un proceso de muda centrífugo a partir de esos centros. En los azores capturados en el norte de España, las secundarias más frecuentemente retenidas fueron las SS8 (Datos propios no publicados). La muda de la cola sigue un proceso menos claro, comenzando con el par central y siguiendo con las RR5 o las RR6, más externas. Pero existe una gran variabilidad individual (Fig. 8). El comienzo anual de la muda, al igual que en la mayoría de las aves rapaces (Zuberogoitia et al., 2009b, 2013, 2015), se activa con la reproducción y los procesos hormonales relacionados (Deeming, 2004). Las hembras comienzan a tirar plumón antes de poner los huevos, por lo que los nidos activos suelen estar cubiertos por abundante restos de plumón. Durante la incubación van tirando plumas del cuerpo, iniciando la muda de las primarias hacia el final de este periodo o durante los primeros días de vida de los pollos. Existen notables diferencia entre regiones, de forma que en las áreas forestales mediterráneas del SE de España (Murcia), con clima semiárido, ya se localizan primarias de las hembras mientras incuban los huevos (observ. pers.), retrasándose la muda hasta el nacimiento de los pollos en Bizkaia, con clima oceánico (datos propios no publicados). La muda de los machos se retrasa varias semanas con respecto a la de las hembras, debido al desgaste energético que supone cazar para alimentar a la hembra y a los pollos (Fig. 9). Así, por lo general, los machos suelen comenzar a mudar las primarias cuando los pollos son grandes, de 25-30 días de edad, y las hembras colaboran con ellos en la caza y aporte de alimento. Para finales de octubre ya se han mudado todas las plumas de vuelo y aquellas que no se han mudado quedan retenidas (Fig. 10).
Figura 6. Patrón de muda de los Accipiter en España. Las barras y las flechas grises indican el foco de inicio y avance de la muda. Las plumas coloreadas de gris son las plumas más frecuentemente retenidas de la muda anterior. © L. Palomares.
Figura 7. Hembra capturada el 11 de junio de 2011 en Bizkaia con dos pollos de 27 días de edad. Las cuatro primeras primarias están nuevas, la P5 tirada y el resto de una generación anterior. Además, ya ha comenzado la muda de las secundarias, que va con retraso con respecto a las primarias. Así se ve cambiada la S5 y, aunque no se ve, la S6 estaba creciendo. El resto de secundarias son de la generación anterior, con desgaste diferencial en el que se observa cuáles fueron las últimas plumas mudadas la temporada anterior, las más nuevas de la generación anterior (S1, 2, 4 y 8) pero que muestran un desgaste mayor y son más pálidas que la primera pluma mudada el año en curso (P1). Con estos datos sería un 3+ ac (ver Tabla 1). © I. Zuberogoitia/E.M. Icarus.
Figura 8. Cola de hembra adulta (3+ ac) capturada en Bizkaia el 22 de mayo de 2004 con tres pollos de 20 días. Se observa cómo están creciendo las dos RR3, mientras que el resto de plumas son de la generación anterior, con desgaste diferencial debido al tiempo que pasó desde que mudó la primera (R4) hasta la última (R1 o R5). © I. Zuberogoitia/E.M. Icarus.
Figura 9. Macho de 4+ ac capturado el 25 de junio de 2008 con dos pollos de 25 días en nido. Se observa que ya ha mudado la P1 y la P2, el resto de las plumas son de patrón adulto, mudadas el año anterior (2007) y tiene retenida la S8 de una generación anterior (2006). © I. Zuberogoitia/E.M. Icarus.
Figura 10. Hembra de 4+ ac (CRES de Martioda, Álava, 24 de febrero de 2008) en donde se observan dos generaciones de plumas de adulto. Este ejemplar dejó sin mudar un gran número de rémiges: la P9 y la P10 así como las S5, 6, 9, 10 y 12. También se aprecian las dos generaciones de plumas en el manto. © I. Zuberogoitia/E.M. Icarus.
Edad Mañosa (1994b) describe un método para determinar el sexo y la edad de los pollos de azor antes de abandonar el nido. Este estudio muestra que los pollos pueden ser sexados a partir de los 15-20 días en base al peso, la longitud del tarso y la longitud del culmen en relación a la longitud de la séptima primaria. Los pollos nacen con un plumón blanco corto y ojos de color gris azulado (Fig. 11). Al cabo de 7-10 días cambian el plumón por uno más largo, blanco también, y las patas y cera se van pigmentando de amarillo. A los 14-16 días comienzan a aparecer las plumas de la cola, seguidas por algunas coberteras dorsales (Kenward, 2006). Hasta los 20-22 días se mantienen sentados sobre los tarsos, comenzando a ponerse de pie, y van creciendo rápidamente las rémiges en las alas. Sobre esta edad comienzan a termorregular. Las plumas de vuelo crecen con rapidez en los siguientes 10 días, cubriéndose el cuerpo paulatinamente de plumas que van reemplazando el plumón. Hacia los 35-42 días las principales plumas de vuelo ya han superado los 2/3 de desarrollo, y ya sólo les queda plumón en los hombros, algo en el pecho y el de la cabeza que será el último en desaparecer. Los machos se desarrollan unos días antes que las hembras. A esta edad comienzan a darse paseos en las inmediaciones del nido (rameros). En torno a los 40-45 días de edad (depende de la alimentación) comienzan a moverse y volar por las inmediaciones del nido, mientras concluye el crecimiento de las plumas, que aún les llevará dos semanas más. En este periodo regresan al nido para alimentarse (los adultos les dejan presas en el nido) y para dormir, separándose paulatinamente de él. Desde que abandonan el nido (1ac) hasta que inician su primera muda (2ac) mantienen el plumaje juvenil, pardusco y con barras verticales en las zonas ventrales. El iris gris se aclara rápidamente hacia un amarillo pálido que se irá transformando en amarillo. Al final de su 2ac, a finales de octubre o noviembre, acaban su primera muda, mostrando un plumaje adulto que mantendrá hasta el final de su vida. No obstante, no es raro que los ejemplares de 2/3ac tengan retenidas algunas plumas coberteras en los hombros, alguna pluma ventral e incluso algunas primarias y secundarias, todas ellas con patrón juvenil (Fig. 12, Tabla 1). El iris va tomando una coloración más anaranjada. A partir de su segunda muda cualquier rastro juvenil desaparece y aunque puedan retener plumas de la muda anterior, estas son ya de patrón adulto (Tabla 1, Fig. 7 y 10). A partir de este momento no se puede determinar la edad de un azor con precisión. Aunque en algunos casos (muy raros) hay ejemplares que pueden mostrar hasta tres generaciones de plumas (Fig. 9). Dependiendo de si la más vieja es juvenil o no, el ejemplar será de 3/4ac o 4+/5+ ac. Por otro lado, siempre se ha creído que el iris de los azores se vuelve rojo con la edad. Esto es parcialmente cierto, ya que la calidad del individuo, su dieta (contenido en carotenoides) y el sexo hacen que la aparición de los pigmentos rojos en el iris se adelante o atrase. Así, los machos alcanzan el color rojo antes que las hembras (Fig. 13 y 14). Un ejemplar macho anillado en nido y posteriormente recuperado, mostraba el iris rojo en su 3ac (Raúl Alonso com. pers.). El iris de los azores más viejos se va oscureciendo a tonos granates y en algunos se vuelven casi negros. En cautividad se sabe de azores que han superado los 27 años (Kenward, 2006). Según el autor, a partir de los 17 años de edad, sobre todo en hembras, se observan más cambios de plumaje, en donde las barras del vientre se van desvaneciendo, dándole al ave un aspecto más blanco. En libertad los azores no alcanzan tantos años. En Finlandia, con más de 57000 azores anillados vieron que el ejemplar más longevo murió con 17 años, 10 meses y 11 días de edad (Saurola et al., 2013). Por su parte, Kenward (2006) documenta la edad máxima de 18 años.
Tabla 1. Clave resumen para determinar la edad del azor (Accipiter gentilis) durante sus primeros años de vida en base al patrón de muda. Ac = Año calendario.
Figura 11. Iris de un pollo hembra de 23 días de edad. © I. Zuberogoitia/E.M. Icarus.
Figura 12. Ejemplar macho adulto anillado en el nido en 2009 y recapturado como reproductor el 21 de junio de 2011 (edad 3ac). Presenta todo el plumaje de adulto, salvo media docena de infracoberteras que están retenidas y de patrón juvenil. © S. Rebollo.
Figura 13. Detalle de la cabeza e iris de un macho de 4+ ac (Bizkaia, 24 de junio de 2008), aún de tonos naranjas. © I. Zuberogoitia/E.M. Icarus.
Figura 14. Detalle de la cabeza e iris todavía amarillo de una hembra de 4+ ac (CRES de Martioda, Alava, 24 de febrero de 2008). © I. Zuberogoitia/E.M. Icarus.
Referencias Alerstam, T., Rosén, M., Bäckman, J., Ericson, P. G. P., Hellgren, O. (2007). Flight speeds among bird species: allometric and phylogenetic effects. PLoS Biol, 5: 1656–1662. Clark, W. S. (2004). Wave moult of the primaries of Accipitrid raptors, and its use in ageing immatures. Pp. 795-804. En: Chancellor, R. D., Meyburg, B.-U. (Eds.). Raptors Worldwide. World Working Group on Birds of Prey, Berlin. Clavell, J., Copete, J. L., Gutiérrez, R., de Juana, E., Lorenzo, J. A. (2005). Lista de las aves de España. Sociedad Española de Ornitología / BirdLife, Madrid. Cramp, S., Simmons, K. E. L. (Eds.) (1980). Handbook of the Birds of Europe the Middle East and North Africa. The Birds of the Western Palearctic. Volume II. Hawks to Bustards. Oxford University Press, Oxford. Deeming, D. C. (2004). Avian Incubation. Oxford Ornithology Series. Oxford University Press, Oxford. Edelstam, C. (1984). Patterns of moult in large birds of prey. Annales Zoologici Fennici, 21: 271-276. Ferguson-Lees, J., Christie, D.A. (2001). Raptors of the world. Christopher Helm, London. Glutz, U. N., Bauer, K. M., Bezzel, E. (1971). Handbuch der Vögel Mitteleuropas. Band 4. Falconiformes. Aula Verlag, Wiesbaden. Kenward, R. (2006). The Goshawk. T & AD Poyser, London. Krüger, O. (2005). The evolution of reversed sexual size dimorphism in hawks, falcons and owls: a comparative study. Evolution & Ecology, 19: 467–486. Lepage, D. (2009). AviBase: the world bird database. BirdLife International. Madrid-Millán, J. (2013). El embrujo de los Accipiters. Cetrería con azores y gavilanes: su manejo, adiestramiento y reproducción. Cairel Ediciones, Madrid. Mañosa, S. (1994b). Sex and age determination in nestling Goshawks Accipiter gentilis. Butll. GCA, 11: 1-6. Martínez-Hesterkamp, S. (2015). Territorialidad y relaciones espaciales en rapaces diurnas. Patrones y procesos a escala global y local. Tesis Doctoral. Universidad de Alcalá. Alcalá de Henares. Mueller, H. C., Meyer, K. (1985). The evolution of reversed sexual dimorphism in size: a comparative analysis of the Falconiformes in the western Palearctic. Current Ornithology, 2: 65-101. Olsen, P. D., Olsen, J. (1987). Sexual size dimorphism in raptors: intrasexual competition in the larger sex for a scarce breeding resource, the smaller sex. Emu, 87: 59-62. Penteriani, V., Rutz, C., Kenward, R. (2013). Hunting behavior and breeding performance of northern goshawk Accipiter gentilis, in relation to resource availability, sex, age and morphology. Naturwissenschaften, 100: 935-942. Pérez-Camacho, L., García-Salgado, G., Rebollo, S., Martínez-Hesterkamp, S., Fernández-Pereira, J. M. (2015). Higher reproductive success of small males and greater recruitment of large females may explain strong reversed sexual dimorphism (RSD) in the northern goshawk. Oecologia, 177: 379-387. Sonerud, G. A., Steen, R., Selås, V., Aanonsen, O. M., Aasen, G. H., Fagerland, K. L., Fosså, A., Kristiansen, L., Løw, L. M., Rønning, M. E., Skouen, S. K., Asakskogen, E., Johansen, H. M., Johnsen, J. T., Karlsen, L. I., Nyhus, G. C., Røed, L. T., Skar, K., Sveen, B. A., Tveiten, R., Slagsvold, T. (2014). Evolution of parental roles in provisioning birds: diet determines role asymmetry in raptors. Behavioral Ecology, 25: 762-772. Storer, R. W. (1966). Sexual dimorphism and food habits in three North American accipiters. Auk, 83: 423–436. Tornberg, R., Mönkkönen, M., Pahkala, M. (1999). Changes in diet and morphology of Finnish goshawks from 1960s to 1990s. Oecologia, 121:369–376. Zuberogoitia, I., Azkona, A., Zabala, J., Astorkia, L., Castillo, I., Iraeta, A., Martínez, J. A., Martínez, J. E. (2009a). Phenotypic variations of Peregrine Falcon in subspecies distribution border. Pp. 295-308. En: Sielicki, J., Mizera, T. (Eds.). Peregrine Falcon Populations. Status and perspectives in the 21st Century. Turul Publishers and Poznan University of Life Sciences Press, Warsaw – Poznan. Zuberogoitia, I., Alonso, R., Elorriaga, J., Palomares, L.E., Martínez, J. A. (2009b). Moult and age determination of Eurasian sparrowhawk Accipiter nisus in Spain. Ardeola, 56 (2): 241-251. Zuberogoitia, I., De la Puente, J., Elorriaga, J., Alonso, R., Palomares, L. E., Martínez, J. E. (2013). The flight feathers molt of Griffon Vultures Gyps fulvus and associated biological consequences. Journal of Raptor Research, 47 (3): 292-303. Zuberogoitia, I., Gil, J. A., Martínez, J. E., Erni, B., Aniz, B., López-López, P. (2015). The flight feather moult pattern of the bearded vulture (Gypaetus barbatus). Journal of Ornithology. DOI 10.1007/s10336-015-1269-3 Zuberogoitia, I., Ruiz Moneo, F., Torres, J. J. (Eds). (2002). El Halcón Peregrino. Servicio Publicaciones de la Diputación Foral de Bizkaia.
Iñigo Zuberogoitia1 y José Enrique Martínez2 Fecha de publicación: 23-12-2015 Zuberogoitia, I., Martínez, J. E. (2015). Azor común – Accipiter gentilis. En: Enciclopedia Virtual de los Vertebrados Españoles. Salvador, A., Morales, M. B. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
|
|||||||||||||||
|
|
||||||||||||||||
|
|
||||||||||||||||