|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Para más información sobre cada apartado hacer click en:
|
Key words: European Shag, habitat, abundance, status, threats.
Hábitat Especie marina litoral, se encuentra especialmente en costas rocosas e islas (Cramp y Simmons, 1977). El hábitat de nidificación del cormorán moñudo comprende un amplio rango de sitios inaccesibles en la costa, como cavidades, fisuras, cuevas (furnas) y repisas en acantilados. Son coloniales y la primera vez que crían seleccionan sitios cercanos a otros nidos ya establecidos (Snow, 1963). Los cormoranes son fieles a la zona donde criaron por primera vez, ocupando mejores sitios de cría con la edad (Aebischer et al., 1995).
Figura 1. Dos tipos de nidos de cormorán moñudo: hipogeo (Illas Cíes) y en repisa vertical (Illa de Ons). (C) A. Velando
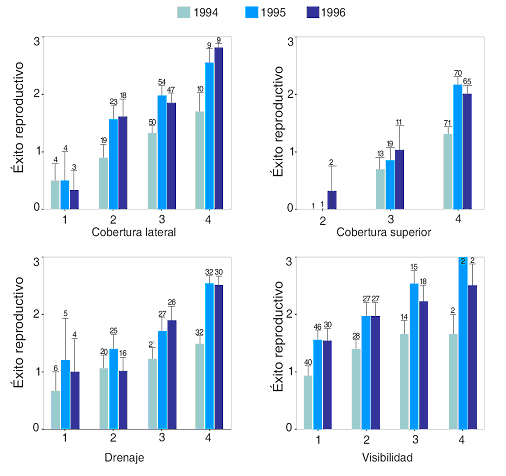
Los resultados obtenidos en diferentes estudios muestran la existencia de un modelo general de selección de hábitat de nidificación para esta especie, según el cual los cormoranes buscan, principalmente, sitios que protejan los nidos de los agentes atmosféricos, de los depredadores y que, además, permitan la visión del entorno físico y social (Velando y Freire, 2003). La selección de hábitat de nidificación ha sido estudiada en varias colonias británicas con los nidos situados sobre repisas en acantilados (Potts et al., 1980; Aebischer, 1985; Olsthrorn y Nelson, 1990). En las islas Farne, el éxito reproductor se relacionó con la protección frente al mar y la lluvia, con la accesibilidad desde el mar y con el tamaño del sitio de nido (Potts et al., 1980). En la zona acantilada de Aberdeen el éxito reproductivo se relacionó negativamente con el grado de encharcamiento de los sitios en los que se ubicaron los nidos (Olsthoorn y Nelson, 1990). En Galicia, la selección de hábitat de nidificación muestra grandes diferencias entre islas incluso cercanas, como entre las Illas Cíes y la Illa de Ons (Velando, 1997), aunque también puntos en común. A grandes rasgos, los sitios de los nidos en la Illa de Ons son repisas en acantilados verticales, mientras que en las Illas Cíes predominan los nidos hipogeos, en cavidades entre derrubios de bloques rocosos (Figura 1). En la Illa de Ons el principal factor que afecta al éxito reproductor es la protección superior del nido frente a la lluvia, otros agentes atmosféricos y, quizás también, frente a los depredadores aéreos. En las Illas Cíes, el drenaje, la cobertura (superior y lateral) y la visibilidad afectan al éxito reproductor (Figura 2) y a la ocupación (Velando y Freire, 2003). Los nidos de mejor calidad se ocupan más temprano, indicando una preferencia por sitios de alta calidad en las aves con puestas tempranas.
Figura 2. Media (± desviación estándar) del éxito reproductivo (número de pollos volados por pareja) en las Illas Cíes para tres años de estudio en relación a la calidad de los sitios de nido. Para cada variable analizada (coberturas lateral y superior, drenaje y visibilidad) se presenta un valor de puntuación de 1 (poca calidad) a 4 (calidad máxima). Según Velando y Freire (2003).
Población y tendencia La población global de cormorán moñudo supera las 75.000 parejas (Tabla 1). Gran Bretaña, Noruega, Islandia y Francia reúnen las poblaciones más importantes.
Tabla 1. Desglose de la población reproductora global de cormorán moñudo. Los datos son referidos al período 1998-2002. Según Mitchell et al. (2004).
La población española de cormorán moñudo en 2006 y 2007 se estimó en 3.764 parejas, de las que 2.087 corresponderían a la subespecie mediterránea y 1.667 a la subespecie nominal (Tabla 3). El 87% de la población se encuentra en dos comunidades autónomas: Galicia (34% del total) y las Islas Baleares (53% del total).
Tabla 2. Población reproductora en número de parejas de cormorán moñudo en España en 2006-2007. Entre paréntesis se indica el número de parejas probables. Fuente: Álvarez y Velando (2007) y datos propios.
La fracción más importante de la subespecie nominal se concentra en el Parque Nacional de las Illas Atlánticas de Galicia, donde se encuentran las únicas colonias ibéricas de más de 100 parejas. Las colonias cantábricas oscilan en su mayoría entre las 5 y las 20 parejas. Al contrario que en el Cantábrico y Atlántico peninsular, donde la población presenta una distribución prácticamente continua a lo largo de toda la costa, en el litoral mediterráneo la presencia de nidificantes es muy escasa. El cormorán moñudo mantiene poblaciones numerosas en el norte de Europa, aunque con tendencia a la baja en las últimas dos décadas. De hecho, en las Islas Británicas, donde nidifica cerca de la mitad población mundial, se ha constatado un descenso próximo al 40% en muchas de sus poblaciones (Mitchell et al., 2004). En España, los cormoranes moñudos fueron cazados con armas de fuego y sus pollos capturados para consumo humano hasta finales de los años setenta del siglo pasado. Existe constancia de estas actividades en numerosos lugares de Asturias y Galicia (Velando et al., 1999a). A partir de su inclusión en el catálogo nacional de especies protegidas y la consiguiente prohibición de darle caza o de recolectar sus huevos, la especie respondió con un fuerte incremento poblacional desde las estimas iniciales (Rodríguez Silvar y Bermejo Díaz De Rábago, 1976; Bárcena et al., 1987), hasta alcanzar los máximos conocidos a finales del siglo XX. Las colonias del Parque Nacional de las Illas Atlánticas de Galicia se situaron incluso entre las mayores de Europa, llegando a representar el 2% del total de la población mundial de la especie (Velando et al., 1999a). En la actualidad, la subespecie nominal se encuentra en un marcado proceso de declive, especialmente patente en las colonias situadas en las Illas Cíes y en la Illa de Ons, las cuales sumaron aproximadamente el 90% de los efectivos ibéricos y que ahora apenas alcanzan el 50%. En A Costa da Morte (A Coruña), otro importante núcleo reproductor, el cormorán moñudo también ha sufrido una importante regresión en la última década. Por ejemplo, la población de las Illas Sisargas ha sufrido un descenso del 50% en los últimos 5 años (A. Barros datos propios). Por el contrario, en otras zonas de Galicia y en el Cantábrico la tendencia poblacional del cormorán moñudo es más variable. En el norte de A Coruña algunas colonias han experimentado incrementos de población muy notables en los últimos años, mientras que en Asturias parece encontrarse en un periodo de estabilidad o de moderado descenso (Álvarez y Velando, 2007). En el País Vasco ha aumentado sensiblemente en los últimos años (Jon Hidalgo com. pers.). Las poblaciones del Mediterráneo se habían considerado que estaban en una situación de conservación delicada, aunque los censos eran incompletos (De Juana, 1984). En Cabrera la población reproductora se redujo desde las 295 parejas censadas en 1974 (Araújo et al., 1976) a las más de 93 parejas en 1999. Sin embargo, las poblaciones españolas han experimentado un notable incremento en las últimas décadas, especialmente notable en el archipiélago balear (Álvarez y Velando, 2007). Sin embargo, hay indicios que apuntan a que los datos de los últimos censos pueden estar sobreestimados, por lo que deben ser tomados con precaución y es necesario actualizar la información para asegurarse de cuál es la tendencia real de la población (Álvarez y Velando 2007).
Estado de conservación Situación a nivel global Categoría global IUCN (2012): Preocupación Menor (LC) (BirdLife International, (2012). Es importante señalar que, en vista del ya comentado descenso experimentado por la especie en las Islas Británicas, esta calificación probablemente deba ser revisada. Según los propios criterios de la UICN, este descenso sería suficiente para que el cormorán moñudo se incluyera en la categoría de “en peligro”. A pesar de que la población reproductora ha sufrido un moderado declive entre 1990 y 2000, BirdLife International (2004) considera que la especie presenta en Europa un estado de conservación favorable. Las poblaciones del Mediterráneo están incluidas en el Anexo II de la Convención de Berna y en el Anexo I de la Directiva Aves 79/409. Situación en España Incluida en el Catálogo Nacional de Especies Amenazadas, regulado por el Real Decreto 439/1990 en la categoría de “interés especial” y en la de “vulnerable” por el vigente Real Decreto 139/2011. Aplicando los criterios de la UICN a España, las poblaciones del Atlántico se consideran como “En Peligro” (Velando y Álvarez, 2004) en base a una disminución drástica del tamaño poblacional (superior al 50% en las tres últimas generaciones) por factores que siguen actuando: merma de la calidad del hábitat, fragmentación severa de las poblaciones y fluctuaciones extremas de las mismas. Ese declive ha sido especialmente patente en el Parque Nacional de las Illas Atlánticas de Galicia, sobre todo en las Illas Cíes, donde se ha confirmado una reducción del 70% del número de parejas reproductoras entre 1992 y 1999. En concreto, en la Illa de O Faro la población reproductora se redujo un 85,3% en el periodo comprendido entre 1997 y 2007 (Velando y Munilla, 2008). Las poblaciones del Mediterráneo están consideradas como “Vulnerable” (Muntaner, 2004) en base a un declive esperado de la población adulta superior al 10% en los próximos 10 años (Álvarez y Velando, 2007). Los datos recientes obtenidos en las Islas Baleares podrían hacer replantearse esta categoría.
Factores de amenaza A continuación se comentan los principales factores a los que se enfrenta la especie de manera generalizada en su área de distribución española. Mortalidad por enmalle Debido a sus hábitos alimentarios, los cormoranes corren un grave riesgo de quedar atrapados en las redes de pesca y morir ahogados. De hecho, junto con los álcidos, son las especies más afectadas por la captura accidental en artes de enmalle (Tasker et al., 2000; Sewell et al., 2007). Las redes de materiales sintéticos son muy peligrosas para las aves marinas porque son prácticamente invisibles bajo el agua. Un análisis acerca del estado de conservación de las poblaciones de cormorán moñudo de las Illas Cíes aporta evidencias que indican que la baja tasa de supervivencia de adultos observada puede ser debida a una gran mortalidad en artes de este tipo (Velando y Freire, 2002). De las 35 recuperaciones de cormoranes anillados en las colonias del Parque Nacional de las Illas Atlánticas de Galicia en las que se informa acerca de la posible causa de muerte, 30 figuran como enmallados en artes de pesca (Velando y Munilla, 2008). En Galicia, en los últimos años, debido sobre todo a la reducción en las capturas de especies más comerciales, se ha intensificado el uso de trasmallos (un tipo de arte de enmalle) en muchas cofradías, lo que ha producido un aumento de la mortalidad por esta causa. En este sentido, el número de barcos dedicados a la pesca de enmalle pasó de 1.091 a 2.461 entre 1989 y 2004, lo que corresponde a una tasa de aumento anual del 5.6% (Velando y Munilla, 2008). En la costa asturiana, la mayor parte de la mortalidad accidental en aparejos de pesca ocurre también en trasmallos y otras artes de pesca (D. Álvarez datos propios). En el Mediterráneo la principal causa de muerte (55% de las aves anilladas recuperadas) se debe también a la captura accidental en artes de enmalle (Muntaner, 2004). De Pablo (2004) ha estimado la mortalidad por enmalle en Menorca en 18 cormoranes/año en una población de unos 746 individuos. Contaminación Los accidentes de buques petroleros suelen llevar asociados episodios de mortandad masiva de aves marinas. No obstante, los efectos de las mareas negras no tienen únicamente consecuencias directas a corto plazo, sino que pueden mantenerse muchos años después del vertido. En noviembre de 2002 el petrolero Prestige se fue a pique a unas 200 millas de la costa de Galicia provocando el derrame de unas 70.000 toneladas de fuel que afectó principalmente a las costas gallegas en una sucesión de mareas negras. Con ocasión de este desastre ambiental se documentaron tres tipos de efectos sobre las poblaciones de cormorán moñudo: (i) mortalidad directa, que tiene efectos a corto plazo en la población, (ii) efectos subletales y (iii) efectos sobre la disponibilidad de alimento. El Prestige produjo en la población de cormorán moñudo de las Rías Baixas una mortandad relativamente baja, muriendo 340 aves, apenas el 2% de la población estimada (Velando et al., 2005a). Los cormoranes muertos durante el Prestige por la toxicidad del fuel presentaron además estrés nutricional, según reflejaron los altos niveles de isótopos de nitrógeno detectados en los tejidos blandos (Sanpera et al., 2008). La contaminación del Prestige fue persistente, como indican las concentraciones de cobre y plomo en plumas de pollos de esta especie tres años después del derrame, que fueron entre 3 y 5 veces superiores a las registradas antes del derrame (Moreno et al., 2011a). El derrame del Prestige probablemente tuvo efectos complejos en las poblaciones de cormorán moñudo. Así, por ejemplo la mortalidad directa durante el derrame estuvo muy sesgada hacia las hembras, lo que pudo provocar una disminución en el número de parejas nidificantes debida a un desbalance en la proporción de sexos. Ambos efectos (descenso poblacional, mortalidad sesgada por sexo) explican la disminución del 11% en la población de cormorán moñudo del Parque Nacional tras el citado derrame(Martínez-Abraín et al., 2006b). Los hidrocarburos se incorporan a las redes tróficas y pueden acabar afectando a la salud de los animales (efectos subletales). Dos años después del Prestige los cormoranes moñudos de las áreas afectadas seguían mostrando niveles muy altos de hidrocarburos en sangre (Velando y Munilla, 2008). En cuanto al efecto del petróleo sobre la disponibilidad de alimento, en las Illas Cíes, así como en otras muchas colonias europeas, el principal alimento del cormorán es el lanzón (Ammodytidae) (ver Ecología trófica), un pez bentónico que captura en fondos arenosos y rocosos, ambos medios afectados por el derrame del Prestige. Durante los tres años siguientes al Prestige la presencia de lanzones en la dieta de los cormoranes disminuyó un promedio del 50%, lo que provocó un descenso paralelo en el éxito reproductivo (Velando et al., 2005a, 2005b; Velando y Munilla, 2008). En conjunto, los datos apuntan hacia un efecto indirecto y persistente del Prestige sobre la reproducción del cormorán moñudo, mediado por la disminución de las poblaciones de los peces que constituyen su alimento preferido. Los cormoranes moñudos del delta del Ebro presentan elevados niveles de mercurio (Arcos et al., 2002). Depredación Los carnívoros introducidos (gatos asilvestrados, visones americanos) representan una causa importante de mortalidad sobre las poblaciones de cormoranes en la Península Ibérica (ver apartado de Depredadores). Molestias derivadas de actividades humanas Una vez que la caza desde embarcación y el expolio de los pollos en los nidos puede darse ya como una actividad erradicada, el principal problema derivado de la actividades humanas son las molestias ocasionadas a los cormoranes bien sea en las colonias de reproducción o bien en sus áreas de alimentación. Cuando se produce el acceso a las colonias de nidificación las molestias pueden ocasionar el abandono temporal de los nidos, lo que puede acarrear la muerte por frío de los pollos o los huevos. Además, los cormoranes incuban con las patas (Cramp y Simmons, 1977), por lo que si son sorprendidos por una amenaza pueden arrojar en su huida los huevos o pollos pequeños fuera del nido. En Asturias, en 2012 se ha confirmado el abandono de una colonia probablemente debido a las continuas molestias producidas por las actividades de tiro al plato que se realizan periódicamente en sus proximidades (D. Álvarez datos propios). En Vizcaya se han detectado perturbaciones importantes debidas a la pesca deportiva desde tierra en las cercanías de los nidos (Jon Hidalgo, com. pers.). Otro tipo de impacto son las molestias provocadas por el turismo náutico, especialmente graves cuando se producen en las áreas de alimentación. Así, en las Illas Cíes, se ha comprobado cómo la presión del turismo náutico fuerza a los cormoranes a abandonar sus mejores áreas de alimentación, afectando negativamente además al tiempo que diariamente emplean en alimentarse (Velando y Munilla, 2011). Cambio climático Existen evidencias que indican que el mal tiempo, concretamente los temporales de componente sur que suelen azotar las costas de Galicia durante el invierno, pueden afectar negativamente a la reproducción y la supervivencia invernal de jóvenes y adultos (Velando et al., 1999b; Velando y Freire, 2002). Si las condiciones ambientales son adversas, la supervivencia de los cormoranes moñudos puede verse muy comprometida durante el invierno. Por ejemplo, un incremento de la frecuencia de chubascos fuertes puede provocar una alta mortalidad, tanto en pollos como en adultos (Harris y Wanless, 1996). En el caso de las Illas Cíes, se ha observado una fuerte asociación negativa entre el éxito reproductor anual y el número de días con vientos fuertes y lluvias abundantes durante el periodo de cría. Si las condiciones adversas son persistentes, puede llegar a producirse un colapso reproductor (prácticamente todos los adultos reproductores renuncian a nidificar) como ocurrió en 1998 (Velando y Freire, 2002). Las evidencias sugieren que en los días de mal tiempo los cormoranes pueden tener dificultades para conseguir alimento debido a la elevada turbidez del agua y porque, bajo tales condiciones, los lanzones tienden a permanecer enterrados en el fondo (Velando et al., 1999b; Frederiksen et al., 2005). Los modelos climáticos prevén una mayor inestabilidad atmosférica en nuestras latitudes en los próximos años, como consecuencia del aumento de la temperatura global del planeta; esta inestabilidad podría provocar, entre otras cosas, un aumento de los episodios caracterizados por intensas precipitaciones (Visbeck et al., 2001), lo que podría acabar teniendo efectos notables en la dinámica poblacional de la especie (Frederiksen et al., 2004, 2008). Sobreexplotación pesquera En algunas localidades el cormorán moñudo consume especies de peces que son objeto de pesquerías comerciales, por lo que la sobrepesca puede afectar a la disponibilidad de presas y tener efectos en la dinámica sus poblaciones (Furness, 2001; Daunt et al., 2008; Frederiksen et al., 2008). En la Península Ibérica las especies de las que se alimenta el cormorán no tienen gran valor comercial. Sin embargo, en Galicia existe una pequeña pesquería de lanzón, la cual es una especie muy importante en la dieta del cormorán (ver Ecología trófica). En la Ría de Vigo, las capturas de lanzón han disminuido considerablemente en los últimos años (Velando y Munilla, 2008), desconociéndose sin embargo si este descenso es debido un colapso de la pesquería o a un menor interés comercial por esta especie.
Medidas de conservación Se han propuesto diversas acciones prioritarias de conservación encaminadas principalmente a la reducción de la mortalidad. Están recogidas en Velando y Álvarez (2004) y Velando y Munilla (2008) y se pueden resumir en los siguientes puntos: -Regulación, incluyendo la prohibición expresa cuando se considerase necesaria, de la pesca con artes de enmalle en las proximidades de las localidades de cría más importantes. -Estudio de los efectos de la posible sobreexplotación pesquera de especies importantes en la alimentación del cormorán moñudo y, en su caso, planteamiento de limitaciones a la misma. -Erradicación de los carnívoros depredadores (gato y visón americano) presentes en las colonias de cría. -Aumento de la efectividad en la lucha contra los derrames accidentales de petróleo (mareas negras) y del lavado en alta mar de tanques con restos de hidrocarburos. -Protección efectiva de los enclaves de cría más importantes, evitando posibles molestias derivadas del uso público, especialmente en la época de reproducción. -Aumento del control de las molestias producidas por el turismo náutico en las áreas de alimentación. -Investigación encaminada a conocer el grado real de aislamiento de la población ibérica, así como los posibles efectos a largo plazo del cambio climático. La aversión condicionada del gusto puede ayudar a proteger las colonias reproductoras de aves marinas. Un experimento realizado en la isla Sa Dragonera (Mallorca) ha comprobado que un repelente químico (cloruro de litio) atenúa la tasa de depredación de huevos por ratas (Rattus rattus) (Latorre et al., 2013)1.
Referencias Aebischer, N. J. (1995). Philopatry and colony fidelity of Shag Phalacrocorax aristotelis on the east coast of Britain. Ibis, 137: 11-28. Aebischer, N. J., Potts, G. R., Coulson, J. C. (1995). Site and mate fidelity of Shags Phalacrocorax aristotelis at two British colonies. Ibis, 137: 19-28. Álvarez, D., Velando, A. (2007). El Cormorán moñudo en España y Gibraltar. Población en 2006-2007 y método de censo. SEO/Birdlife. Madrid Araújo, J., Muñoz-Cobo, J., Purroy, F. J. (1976). Notes on sea-birds 54. Populations of sea birds in the Cabrera archipelago (Balearic Islands). Ardea, 64 (1-2): 83-84. Arcos, J.M., Ruiz, X., Bearhop, S., Furness, R.W. (2002). Mercury levels in seabirds and their fish prey at the Ebro Delta (NW Mediterranean): the role of trawler discards as a source of contamination. Marine Ecology Progress Series, 232: 281-290. Bárcena, F., de Souza, J. A., Fernández de la Cigoña, E., Domínguez, J. (1987). Las colonias de aves marinas de la costa occidental de Galicia. Características, censo y evolución de sus poblaciones. Ecología, 1: 187-209. BirdLife International (2004). Birds in Europe: their conservation status. BirdLife International. Cramp, S., Simmons, K. E. L. (1977). Handbook of the Birds of Europe the Middle East and North Africa. The Birds of the Western Palearctic. Vol I. Ostrich to Ducks. Oxford University Press, Oxford. Daunt, F., Wanless, S., Greenstreet, S. P. R., Jensen, H., Hamer, K. C., Harris, M. P. (2008). The impact of the sandeel fishery closure in the northwestern North Sea on seabird food consumption, distribution and productivity. Canadian Journal of Fisheries and Aquatic Sciences, 65: 362-381. De Juana, E. (1984). The status and conservation of seabirds in the Spanish Mediterranean. International Council for Bird Preservation Technical Publication, Supplement No. 2: 347-361. De Pablo, F. (2004). Incidencia de la pesca profesional en la mortalidad del cormorán moñudo, Phalacrocorax aristotelis desmarestii, en Menorca (Islas Baleares). Bolleti de la Societat d'Historia Natural de les Balears, 47: 25-30. Frederiksen, M., Harris, M. P., Daunt, F., Rothery, P., Wanless, S. (2004). Scale-dependent climate signals drive breeding phenology of three seabird species. Global Change Biology, 10: 1214-1221. Frederiksen, M., Wright, P. J., Harris, M. P., Roderick M. A., Heubeck, M., Wanless, S. (2005). Regional patterns of kittiwake Rissa tridactyla breeding success are related to variability in sandeel recruitment. Marine Ecology Progress Series, 300: 201-211. Frederiksen, M., Daunt, F., Harris, M. P., Wanless, S. (2008). Stochastic weather drives survival and population dynamics in a long-lived seabird. Journal of Animal Ecology, 77: 1020-1029. Furness, R. W. (2001). Management implications of interactions between fisheries and sandeel-dependent seabirds and seals in the North Sea. ICES Journal of Marine Science, 59: 261-269. Harris, M. P., Wanless, S. (1996). Differential responses of Guillemot Uria aalge and Shag Phalacrocorax aritotelis to a late winter wreck. Bird Study, 43: 220-230. Latorre, L., Larrinaga, A. R., Santamaria, L. (2013). Rats and Seabirds: Effects of Egg Size on Predation Risk and the Potential of Conditioned Taste Aversion as a Mitigation Method. Plos One, 8 (9): e76138. Martínez-Abraín, A., Velando, A., Genovart, M., Gerique, C., Bartolomé, M. A., Villuendas, E., Sarzo, B., Oro, D. (2006b). Sex-specific mortality of European shags during an oil spill: demographic implications for the recovery of colonies. Marine Ecology Progress Series, 318: 271-276. Mitchell, P. I., Newton, S. F., Ratcliffe, N., Dunn, T. E. (2004). Seabird Populations of Britain & Ireland: Results of the Seabird 2000 census (1998-2002). T. & A.D. Poyser, London. Moreno, R., Jover, L., Díez, C., Sapera, C. (2011a). Seabird feathers as monitors of the levels and persistence of heavy metal pollution after the Prestige oil spill. Environmental Pollution, 159: 2454-2460. Muntaner J. (2004). Cormorán moñudo del Mediterráneo. Phalacrocorax aristotelis desmarestii. Pp. 62-65. En: Madroño, A., González, C., Atienza, J. C. (Eds.) Libro Rojo de las Aves de España. Dirección General para la Biodiversidad-SEO/BirdLife, Madrid. Olsthoorn, J. C. M., Nelson, J. B. (1990). The availability of breeding sites for some British seabirds. Bird Study, 37: 145-164. Potts, G. R., Coulson, J. C., Deans, I. R. (1980). Population dynamics and breeding success of the Shag, Phalacrocorax aristotelis, on the Farne islands, Northumberland. Journal of Animal Ecology, 49: 465-484. Rodríguez Silvar, J., Bermejo Díaz De Rábago, A. (1976). Distribución y censo de las colonias de cormorán moñudo Phalacrocorax aristotelis (L.) en las costas de Galicia. Ardeola, 23: 3-25. Sanpera, C., Valladares, S., Moreno, R., Ruiz, X., Jover, L. (2008). Assessing the effects of the Prestige oil spill on the European shag (Phalacrocorax aristotelis): trace elements and stable isotopes. The Science of the Total Environment, 407: 242-249. Sewell, J., Harris, R., Hinz, H., Voltier, S., Hiscock, H. (2007). An assessment of the impact of selected fishing activities on european marine sites and a review of mitigation measures. Seafish Technology. The Marine Biological Association and the University of Plymouth. Snow, B. (1963). The behaviour of the shag. British Birds, 56: 77-103, 164-186. Tasker, M. L., Camphuysen, C. J., Cooper, J., Garthe, S., Montevecchi, W. A., Blaber, S. J. M. (2000). The impacts of fishing on marine birds. ICES Journal of Marine Science, 57: 531-547. Velando, A. (1997). Ecología y comportamiento del cormorán moñudo (Phalacrocorax aristotelis) en las islas Cíes y Ons. Tesis Doctoral, Universidad de Vigo. Velando, A., Álvarez, D. (2004). Cormorán moñudo, Phalacrocorax aristotelis aristotelis. Pp. 60-62. En: Madroño, A., González, C., Atienza, J. C. (Eds.) Libro Rojo de las Aves de España. Dirección General para la Biodiversidad-SEO/BirdLife, Madrid. Velando, A., Álvarez, D., Mouriño, J., Arcos, F., Barros, A. (2005b). Population trends and reproductive success of European Shag following the Prestige oil spill in the Iberian Peninsula. Journal of Ornithology, 146: 116-120. Velando, A., Docampo, F., Álvarez, D. (1999a). The status of the European shag Phalacrocorax aristotelis population on the Atlantic coast of the Iberian Peninsula. Atlantic Seabirds, 1: 97-106. Velando, A., Freire, J. (2002). Population modelling of European shag at their southern limit: conservation implications. Biological Conservation, 107: 59-69. Velando, A., Freire, J. (2003). Nest-Site Characterictics, Ocupation and Breeding Success in the European Shag. Waterbirds, 26: 473-483. Velando, A., Munilla, I. (2008). Plan de Conservación del Cormorán moñudo en el Parque Nacional de las Islas Atlánticas. Universidade de Vigo. Velando, A., Munilla, I. (2011). Disturbance to a foraging seabird by sea-based tourism: implications for reserve management in marine protected areas. Biological Conservation, 144: 1167-1174. Velando, A., Munilla, I., Leyenda, P. M. (2005a). Short-term indirect effects of the Prestige oil spill on a marine top predator: changes in prey availability for European shags. Marine Ecology Progress Series, 302: 263–274. Velando, A., Ortega-Ruano, J. E., Freire, J. (1999b). Chick mortality in European shag Stictocarbo aristotelis related to food limitations during adverse weather events. Ardea, 87: 51-59. Visbeck, M. H., Hurrell, J. W., Polvani, L. Cullen, H. M. (2001). The North Atlantic Oscillation: Past, present, and future. Proceedings of the National Academy of Sciences, 98: 12876-12877.
Álvaro Barros, David Álvarez y Alberto Velando Fecha de publicación: 16-07-2013 Otras contribuciones: 1. Alfredo Salvador. 11-05-2016 Barros, A., Álvarez, D., Velando, V. (2016). Cormorán moñudo –Phalacrocorax aristotelis. En: Enciclopedia Virtual de los Vertebrados Españoles. Salvador, A., Morales, M. B. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||