|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Para más información sobre cada apartado hacer click en:
|
Key words: Red-crested pochard, habitat, abundance, status, threats, management plans.
Hábitat El pato colorado utiliza humedales con amplias praderas de macrófitos sumergidos (Characeae, Zannichellia spp., Ruppia spp., Potamogeton spp., Najas spp., Myriophyllum spp., Ceratophyllum spp.). En invierno se presenta principalmente en masas de aguas abiertas, donde se reúne en grandes grupos. En época de reproducción usa humedales con cobertura tanto de macrófitos emergentes (Phragmites australis, Typha spp., Scirpus spp., Cladium mariscus) como sumergidos y se presenta de forma mucho más dispersa. Para realizar la muda completa del plumaje tras el período de reproducción los patos colorados se desplazan mayoritariamente a humedales extensos con cobertura de macrófitos sumergidos, aunque esos humedales pueden tener poca cobertura de macrófitos emergentes. En números menores también utiliza durante la muda humedales de menor superficie, pero con cobertura de macrófitos emergentes. Hábitat durante la invernada El pato colorado utiliza en invierno principalmente humedales extensos con una profundidad de 1−2 m en los que las temperaturas son moderadas (> 5,7 ºC) (Coronado et al., 1974; Keller, 2000; Dies et al., 2012). Esos humedales son tanto naturales como artificiales y en los mismos se pueden congregar varios miles de individuos. En números menores también ocupa lagunas de pequeño o moderado tamaño (Bernis, 1964; Ena y Purroy, 1982; Amat 1984b; Keller, 2000). En la península Ibérica el pato colorado hace un uso mayor de humedales artificiales (embalses) durante los inviernos en que los humedales naturales presentan bajos niveles de agua que en años cuando los niveles de agua son más altos (Amat y Ferrer, 1988). Esta misma tendencia ocurre a escala local, por ejemplo en las marismas del Guadalquivir, en las que cuando los niveles de agua son altos los colorados utilizan mayoritariamente la marisma natural del parque nacional de Doñana, pero cuando son más bajos hacen un uso casi exclusivo de balsas de acuicultura (Máñez y Arroyo, 2014). Así, los meses en que el nivel del agua en esas marismas es bajo el 100% de los patos colorados se presenta en las balsas de acuicultura, mientras que sólo el 1,4% de los individuos hacen uso de las mismas cuando hay altos niveles de agua en la marisma natural (Klowskowski et al., 2009). En las marismas del Guadalquivir hacen un uso escaso de los arrozales (Máñez y Arroyo, 2014). En la Región de Murcia se distribuye en invierno sobre todo en humedales artificiales que reciben el agua regenerada procedente de estaciones depuradoras de aguas residuales y grandes embalses, de agua dulce o salobre, con abundante vegetación palustre y praderas de macrófitos sumergidos de los que se alimenta (Ballesteros-Pelegrín et al., 2021). En la Albufera de Valencia el pato colorado utiliza arrozales que se inundan con agua dulce para favorecer la caza de aves acuáticas, por lo que su uso por el pato está condicionado por las prácticas cinegéticas (Oltra et al., 2001). En el delta del Ebro durante el invierno utilizan masas de agua de gran extensión con praderas de macrófitos sumergidos, habiéndose registrado también en una bahía marina (Ferrer, 1982). Una parte de la población en el delta ocupa arrozales durante la noche, aunque la mayor parte de la población allí invernante se alimenta en lagunas, tanto de agua dulce como salobres (Ferrer, 1982). En base al análisis de contenidos estomacales de patos cazados en el delta, Llorente et al. (1986) indicaron que el 55% de la población se alimentaría en arrozales, el 41% lo haría en lagunas litorales y el 9% restante en medios acuáticos con influencia marina. No obstante, estas estimaciones no tuvieron en cuenta el posible sesgo que podría producir la distribución de los tipos de sitios donde fueron cazados los patos colorados. En el lago de Constanza (Suiza/Alemania/Austria) el pato colorado ocupó principalmente las zonas cubiertas por extensas y densas praderas de Characeae (Lecocq, 1997). Generalmente sestean y se alimentan en las mismas zonas, estando la alternancia entre zonas de comedero y sesteo poco marcada (Coronado et al., 1974; del Portillo, 1978). No obstante, cuando son molestados en las zonas de alimentación usan otras zonas para descansar durante el día, desplazándose por la noche a las de alimentación (Ferrer, 1982). Durante la invernada en un dormidero en la Albufera de Valencia el pato colorado utilizó principalmente las zonas de mayor profundidad del agua (> 60 cm), aunque también se registró con cierta frecuencia en zonas más someras (Martínez-Abraín, 1999). Hábitat durante la temporada de cría En la época de reproducción los patos colorados se presentan de forma más dispersa que durante otras épocas del año y durante la misma usan humedales con amplias zonas de agua libre en los que hay buena cobertura de macrófitos sumergidos y emergentes (Ferrer, 1982; de Juana y Garcia, 2015). En las marismas del Guadalquivir nidifican principalmente en las quebradas, que son antiguos caños colmatados cubiertos por almajo Arthrocnemum macrostachyum y candilejo Juncus subulatus, con una profundidad del agua de 10-30 cm (Figura 1), y en menor proporción también se presentan en caños y lucios (lagunas) cubiertos por castañuela Bolboschoenus maritimus y bayunco Scirpus litoralis, en los que la profundidad del agua es > 30 cm, siendo en estos últimos hábitats donde crían a los pollos (Amat, 1982).
Figura 1. Aspecto de una quebrada inundada, que constituye el principal hábitat de nidificación del pato colorado en las marismas del Guadalquivir (Amat 1982). © Juan A. Amat/EBD−CSIC. En el delta del Ebro los colorados utilizan lagunas con buena cobertura de carrizo Phragmites australis y anea Typha angustifolia, con una profundidad del agua de 50−100 cm (Llorente y Ruiz, 1985). Arévalo y Baca (1887) y Pardo (1942) indicaron que en la Albufera de Valencia nidificaba principalmente en sitios de agua somera con abundancia de juncos y carrizos. Arévalo y Baca (1887) también señaló que nidificaba en huertas de habas y zanahorias inmediatas al lago. Durante la época de reproducción en otros sitios de la península Ibérica también utilizan lagunas interiores con buena cobertura de macrófitos sumergidos y emergentes, así como tramos de río con vegetación emergente de aneas y en cuyas márgenes se desarrolla vegetación ripícola (Populus, Tamarix, Salix, Ulmus) (Amat, 1984b; Blanco et al., 1996; Pérez Chiscano, 1997; Velasco y Blanco, 1998). Asimismo, se ha registrado a esta especie criando en embalses, graveras y charcas artificiales con carrizo, anea y praderas de macrófitos sumergidos (Díes y Gutiérrez, 2004; Juan, 2005; Prieta et al., 2013; Montero, 2017; Ballesteros-Pelegrín et al., 2021). En la Albufera de Adra (Almería) hubo incrementos en la abundancia de patos colorados positivamente relacionadas con la claridad del agua, que permitía el desarrollo de macrófitos sumergidos (Potamogeton pectinatus y Najas marina) en primavera/verano, en tanto que en otras épocas el desarrollo de fitoplancton hizo aumentar la turbidez del agua, limitando el crecimiento de los macrófitos y afectando negativamente a la abundancia de patos colorados (Moreno-Ostos et al., 2008). En Francia la mitad de la población de pato colorado nidifica en piscifactorías, donde la presencia de polladas se relaciona positivamente con la abundancia de anea, pero no con la de otros helófitos (carrizo, Juncus, Phalaris, Schoenoplectus) (Broyer y Dalery, 2000). Dado que las polladas usan con frecuencia la vegetación emergente, esto afecta a su detectabilidad y, por tanto, a la valoración de los requerimientos de hábitat, por lo que se ha recomendado integrar la probabilidad de detección y su variación en los análisis de uso del hábitat (Defos du Rau et al., 2005). Mediante este procedimiento se concluyó que en la Camarga (Francia) la fragmentación del hábitat y los bajos niveles de agua afectaron negativamente a las nidadas de pato colorado, cuya presencia en las lagunas se vio favorecida por la estabilidad de los niveles de agua durante primavera, la cobertura de Zannichellia spp. y la de carrizo (Defos du Rau et al., 2005). Hábitat durante la época de muda La población ibérica de pato colorado realiza movimientos tras la reproducción desde las zonas de cría a otras donde efectúan la muda completa del plumaje (véase Movimientos). Teniendo en cuenta el número de patos colorados, en España, la dependencia de humedales artificiales para la muda es mayor que la de humedales naturales. Esos humedales se caracterizan por la presencia de extensas praderas sumergidas de plantas acuáticas (Figura 2) y en los mismos se pueden producir agregaciones de miles de patos colorados (Tabla 1). Debido a su extensión no se hace necesaria la presencia de vegetación emergente, ya que las aves huyen buceando en caso de peligro (Lucientes, 1977; Amat et al., 1987; pero véase Szijj, 1965a) (Figura 3). En números mucho menores también utilizan durante la muda lagunas de moderado tamaño (> 10 ha), así como graveras y balsas de riego (Juan, 2005); este tipo de humedales puede tener vegetación emergente en la que las aves se puedan refugiar en caso de peligro (Amat et al., 1987). Figura 2. Embalse de Orellana (Badajoz), que ha sido utilizado por los patos colorados para efectuar la muda completa del plumaje. © Juan A. Amat/EBD−CSIC.
Figura 3. Embalse del Ebro (Santander/Burgos), localidad tradicional de muda del pato colorado en la península Ibérica. © Juan A. Amat/EBD−CSIC.
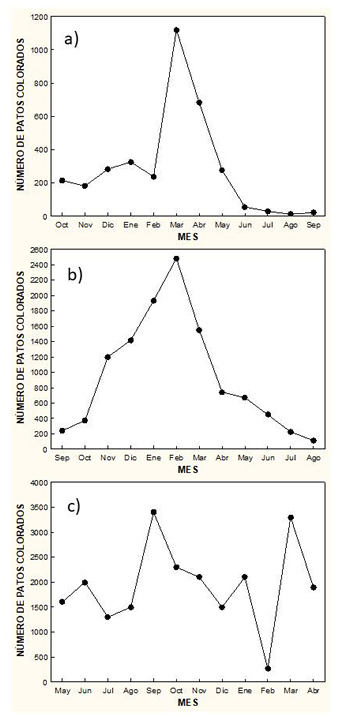
Tamaño de la población El pato colorado está presente durante todo el año en España, aunque su abundancia experimenta variaciones estacionales, que no son iguales en todas las regiones. Asimismo experimenta variaciones interanuales en abundancia, que pueden estar ligadas a los niveles de agua en los humedales. En primavera se presenta en menor cantidad que durante el invierno. Durante la muda del plumaje también experimenta variaciones numéricas interanuales. Variaciones numéricas estacionales La disponibilidad de censos a lo largo de todo el año permite establecer los patrones de abundancia mensual del pato colorado en algunos humedales. Tanto en las marismas del Guadalquivir como en un conjunto de lagunas andaluzas, la mayor abundancia se registra en invierno y la menor en verano (Figura 4). En cambio, en el delta del Ebro es en invierno cuando es menos abundante, registrándose en otoño y primavera la mayor abundancia, aunque las diferencias mensuales no son tan acusadas en el delta como en las localidades andaluzas (Figura 4).
Figura 4. Variaciones numéricas mensuales de patos colorados en (a) un conjunto de lagunas andaluzas (provincias de Cádiz, Sevilla, Córdoba y Málaga) (Amat, 1984b), (b) marismas del Guadalquivir (Máñez y Arroyo, 2014) y (c) delta del Ebro (Ferrer, 1982). Nótese que los censos en cada localidad no comienzan en el mismo mes.
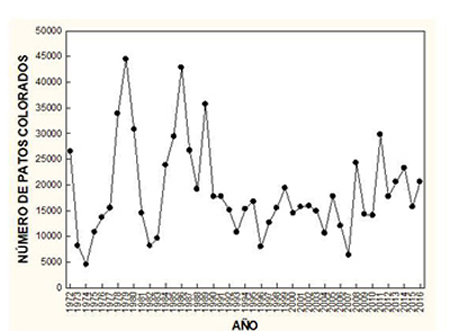
Invernada Martí y del Moral (2003), Dies et al. (2012), González y Pérez-Aranda (2011) y de Juana y Garcia (2015) resumieron las tendencias numéricas del pato colorado durante la invernada en España. Aunque anualmente no se censa el mismo número de localidades, las más importantes para el pato colorado sí que son tradicionalmente visitadas, por lo que se puede considerar que los números registrados representan con bastante fiabilidad la cantidad de patos colorados presentes cada mes de enero en España. Los números en enero experimentaron considerables variaciones interanuales durante 1972-2016, con un máximo de 44.558 individuos en 1979 y un mínimo de 4476 en 1974 (Figura 5). Dado que en España los niveles de agua en los humedales dependen en gran medida de las precipitaciones, las variaciones numéricas que experimenta el pato colorado podrían estar en relación inversa con el nivel del agua en los humedales (Dies et al., 2012). No obstante, también podrían estar afectadas por las condiciones en otras zonas de invernada, de forma cuando en ésas no fuesen óptimas, los patos colorados se desplazarían a los humedales ibéricos. Esto explicaría los números excepcionalmente elevados registrados en 1979, para lo que se ha sugerido que habría habido un desplazamiento masivo de patos colorados desde poblaciones de Europa oriental a la laguna de Gallocanta (Keller, 2000), en la que aquel año se censaron 35.680 individuos (Ena y Purroy, 1982)
Figura 5. Variaciones numéricas anuales de patos colorados en España durante enero de 1972-2016. (Fuente: SEO/BirdLife, http://www.acuaticas.org)
La tendencia en el número de patos colorados invernantes en España ha mostrado un ligero declive entre 1978 y 2009 (González y Pérez-Aranda, 2011; de Juana y Garcia, 2015). De igual modo, Dies et al. (2012) señalaron una tendencia negativa (−14,2%) durante 1990-2010. Una tendencia decreciente también se señaló en la Comunidad Valenciana durante 1984-2004, principalmente relacionada con el descenso en el número de aves que invernaban en la Albufera de Valencia (Gómez López et al., 2006). Al contrario de lo que ocurre a nivel nacional, el pato colorado no ha experimentado un descenso numérico en las marismas del Guadalquivir, donde se pasó de no superar los 6000 individuos en invernada durante la década de 1990, a superar los 13.000 durante dos años de la década siguiente (Máñez y Arroyo, 2014). La tendencia negativa registrada en el número de patos colorados invernantes en España podría estar en relación con una menor llegada de individuos procedentes de Europa central en las últimas décadas, donde la especie ha incrementado la abundancia en invierno (véanse Distribución y Movimientos). Población reproductora El número de patos que se reproducen anualmente en España es bastante variable, lo que en parte se explicaría por el estado de inundación de los humedales (Sáez-Royuela, 1997). Bernis (1972) estimó 5000−6000 parejas a finales de la década de 1960. Sáez-Royuela (1997) proporcionó unas estimas de 5400−8600 parejas entre 1975−1995. Más recientemente la estima se cifró en 4000 parejas reproductoras (Dies y Gutierrez, 2003), aunque se indicó que no era precisa. Parte de la imprecisión al estimar poblaciones reproductoras se puede deber a las dificultades de detección de los individuos durante la temporada de cría (Defos du Rau et al., 2005). De hecho, Čehovská et al. (2019), en un estudio con hembras individualmente marcadas, recomendaron efectuar los conteos de hembras fuera del período de incubación, ya que de esa forma se mejoraba la fiabilidad de los mismos. Según un censo en 2007, en España se reproducirían 7000 parejas (Palomino, 2009). Bernis (1972) estimó en la década de 1960 unas 3000 parejas reproductoras en La Mancha, pero tras las alteraciones producidas en Las Tablas de Daimiel (véase Amenazas: Pérdida de hábitats), el número en la región disminuyó, situándose en menos de 2000 parejas en 2001 (Díes y Gutiérrez, 2004). A partir de la década de 2010 se registró un incremento en el número de patos colorados que criaron en Las Tablas de Daimiel: 450 parejas en 2011, 15-50 en 2012-2016, 20-90 en 2017 y 160-170 en 2018 (Parque Nacional Las Tablas de Daimiel; en Molina et al., 2019). Este incremento podría estar en relación con las medidas de restauración hidrológica de Las Tablas (véase Planes de Conservación: Humedales restaurados y artificiales). El pato colorado ocupó el delta del Ebro hacia 1935, estimándose 350 parejas nidificantes en la década de 1970, aunque hubo un número más elevado de individuos aparentemente no reproductores (unos 1500; Ferrer, 1982). Desde entonces ha experimentado un incremento numérico. Así, hubo 900−1700 parejas reproductoras en la década de 1980 y 2088 parejas en 1995 (véanse Martínez-Vilalta y Motis, 1989; Dies y Gutiérrez, 2004). En Levante el pato colorado nidifica principalmente en localidades costeras (Ferrer et al., 1986; Ferrer, 1991: Gómez López et al., 2006), de las cuales la Albufera de Valencia fue tradicionalmente la más importante hasta que las alteraciones en el lago (véase: Amenazas: Pérdida de hábitats) determinaron que la especie prácticamente dejase de usarlo para reproducirse. Ya a principios del siglo XIX y hasta mediados del XX se mencionó su presencia en la Albufera, pero sin hacer alusión a su abundancia numérica, únicamente que en invierno era más abundante que en primavera, cuando también era muy numeroso (de Villanova, 1808; Vidal, 1851; Arévalo y Baca, 1887; Pardo, 1942). A principios de la década de 1960 se estimó que criaban en la Albufera unas 1000 parejas (Bernis, 1972), que descendieron a 200 tras una década (Dafauce 1975), a 100-120 en 1976, 150 en 1985 y 10 en 1986 (Ferrer, 1991). Entre 1984 y 2004 nidificaron en la Albufera entre 1 y 250 parejas, con una media de 54 (Gómez López et al., 2006). Tras la degradación de la Albufera, este humedal fue superado en importancia por otros de la Comunidad Valenciana para la nidificación del pato colorado. Así, en el embalse de El Hondo (Alicante) nidificaron 500 parejas en 1984 (Ferrer et al., 1986) y un promedio 104 parejas entre 1984 y 2004 (Gómez López et al., 2006). Además, en las salinas de Santa Pola (Alicante) lo hicieron 80-100 parejas en 1984 (Ferrer et al., 1986) y un promedio de 99 parejas entre 1984 y 2004 (Gómez López et al., 2006). En promedio, en la Comunidad Valenciana se reprodujeron 320 parejas entre 1984 y 2004, con un mínimo de 135 y un máximo de 682 (Gómez López et al., 2006). Aunque haya variaciones anuales, la tendencia se considera estable en la Comunidad Valenciana (Gómez López et al., 2006). En la Comunidad de Murcia siempre fue escaso, habiendo dejado de reproducirse en 1996 (Dies y Gutiérrez, 2004), pero volvió a hacerlo en el entorno del Mar Menor, cuando se reprodujo una pareja tanto en 2019 como en 2020 (Ballesteros Pelegrín et al., 2021). La principal localidad de reproducción del pato colorado en Andalucía está en las marismas del Guadalquivir, en donde la especie se reprodujo por primera vez hacia 1935 (Valverde, 1960). De hecho, Chapman y Buck (1893) comentaron sobre su ausencia en esas marismas y lo abundante que era en la Albufera de Valencia en el último tercio del siglo XIX. Noble (1902) tampoco lo encontró en las marismas, aunque mencionó la nidificación de otras seis especies de patos. Valverde (1960) estimó unas 100 parejas reproductoras en años favorables en las marismas del Guadalquivir a finales de la década de 1950 y Amat (1982) estimó 350 parejas a final de la década de 1970. A finales de la década de 1990 se estimó que en años favorables nidificaban en las marismas 400−600 parejas y su número continuó aumentando, estimándose 800-1200 parejas reproductoras en la primera década del siglo XXI (Díes y Gutiérrez, 2004). Además de en las marismas del Guadalquivir, el pato colorado también cría en otras localidades andaluzas, principalmente humedales de pequeño-mediano tamaño, entre los que el número total de parejas reproductoras probablemente no supere las 100 (Amat, 1984b; Dies y Gutiérrez, 2004; Moreno-Ostos et al., 2008). El número de patos colorados que se reproducen en otras regiones españolas es mucho menor que en Cataluña, Levante, La Mancha y Andalucía, siendo en cada una de esas otras regiones de muy pocas decenas de parejas (Dies y Gutiérrez, 2004; Palomino, 2009). En la laguna de Gallocanta (Zaragoza/Teruel) criaban unas 200-400 parejas en la década de 1970 (Lucientes, 1977), pero descendió mucho desde entonces, hasta prácticamente dejar de reproducirse en esa localidad (Dies y Gutiérrez, 2004). Merece destacarse el caso de la Comunidad de Madrid, donde la especie parece estar experimentando un aumento durante la temporada de cría, habiendo pasado de menos de 5 parejas en 1996 a probablemente más de 40 en 2005 (Juan, 2005). Época de muda En España, los patos colorados se concentran mayoritariamente durante la temporada de muda en unas pocas localidades, cuya importancia puede variar de año a año (Amat et al., 1987; de Juana y Garcia, 2015) (Tabla 1). No se ha efectuado ningún censo coordinado a nivel nacional, por lo que se desconoce el número total de patos colorados que puedan mudar anualmente en España, si bien por los números presentados en la Tabla 1 se puede inferir que es de varios miles, aunque probablemente no se superen los 20.000 individuos en los años de más abundancia. Dado que la población que se reproduce en España es de menor tamaño (Palomino, 2009), la diferencia con el número de individuos en período de muda sugiere que los humedales españoles son utilizados para efectuar la muda completa del plumaje por individuos de otras poblaciones europeas.
Tabla 1. Localidades españolas donde se han localizado concentraciones importantes de patos colorados (> 100 individuos) durante la temporada de muda completa del plumaje. Se indica el número máximo de ejemplares registrado durante junio-septiembre.
Estatus de conservación Categoría global (IUCN 2016): Preocupación Menor (LC) Categoría Europa (IUCN 2015): Preocupación Menor (LC) Categoría España (Comité Español IUCN 2015): Vulnerable (VU) El pato colorado tiene una abundancia menor en Europa occidental que en la oriental o en Asia y para la Convention of Migratory Animals (Convención de Bonn) siempre ha sido una especie de interés prioritario, dentro del African-Eurasian Waterbird Agreement (Keller 2000). La asignación a la categoría VU en España se justificó porque la especie presenta un área de distribución relativamente reducida (Dies y Gutiérrez, 2004). Dado que el tamaño de la población reproductora en España es menor de 15.000 aves, Palomino (2009) apuntó que se justificaría su inclusión en la categoría de Casi Amenazado (NT, en siglas IUCN) en España. Pero como se presenta como reproductor en varias comunidades autónomas españolas y la especie muestra una tendencia poblacional creciente en Europa, Palomino (2009) propuso finalmente incluirla en la categoría LC en España. No obstante, aunque la especie esté distribuida por muchos sitios durante la reproducción, desde el punto de vista numérico la mayoría de los individuos depende durante ese período de un número limitado de humedales, siendo esto mucho más acusado durante el período de muda. Por esto último, el mantenimiento del pato colorado en la categoría VU en España estaría justificado (Dies y Gutiérrez, 2004).
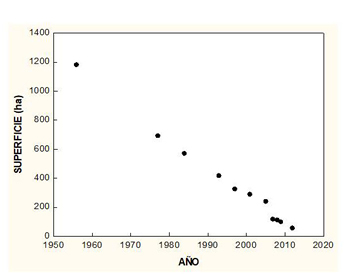
Amenazas El pato colorado afronta varios problemas de conservación, entre ellos la pérdida de calidad de hábitats derivada de procesos de destrucción, colmatación, eutrofización y/o contaminación. Las introducciones de carpas Cyprinus carpio y cangrejos rojos Procambarus clarkii en algunos humedales constituyen otro tipo de amenaza. Está considerado como especie cinegética, para la que la caza propiamente dicha puede no tener efectos excesivamente importantes en las poblaciones, pero sus efectos secundarios pueden ser más severos, por ejemplo condicionando el uso del hábitat o como consecuencia del saturnismo por ingestión de perdigones de plomo cinegético. Se han elaborado planes de conservación de la especie a nivel europeo y en alguna comunidad autónoma. Pérdida de hábitats La pérdida de hábitat representa el principal problema de conservación para el pato colorado (Sáez Royuela, 1997). Entre sus causas las hay de tipo directo como la desecación de humedales, principalmente para aprovechamiento agrícola, pero también de tipo indirecto, como las derivadas de actividades agrícolas, industriales o urbanas. La actividad cinegética también puede afectar a la calidad del hábitat como consecuencia de la contaminación de los humedales por perdigones de plomo, o determinando el desplazamiento de los patos a sitios de peor calidad para evitar molestias. Una gran parte de las marismas del Guadalquivir, Albufera de Valencia y delta del Ebro fueron alteradas para el cultivo de arroz, perdiéndose así una gran superficie de humedales naturales. Aunque cuando a finales de los 1950s-principio de los 1960s se desecó la laguna de la Janda (Cádiz), con unas 4000 ha en los períodos de máxima inundación, el pato colorado no era tan abundante como en la actualidad en Andalucía (véase Tamaño de la población), la persistencia de esa laguna hasta la actualidad seguramente habría constituido un sitio muy apropiado para la especie, ya que debía de poseer amplias praderas de vegetación sumergida, a juzgar por la cantidad de fochas, tanto común Fulica atra como moruna F. cristata, que mantenía (Bernaldo de Quirós, 1920). Aunque de mucha menor extensión, otras lagunas que podrían ser utilizadas por el pato colorado también fueron desecadas. Entre los efectos indirectos que la actividad agrícola tiene sobre los humedales están la colmatación de los mismos y el aporte de fertilizantes y productos fitosanitarios (Dies y Gutiérrez, 2004). También, el descenso de los niveles de agua debido a extracciones para riego. Como consecuencia de la eliminación de la cubierta vegetal para la puesta en cultivo de los terrenos y la subsiguiente roturación del suelo en las cuencas de los humedales, la colmatación de éstos se acelera tras períodos de precipitaciones intensas. Con el arrastre de sólidos a los humedales su profundidad disminuye debido a la entrada de sedimentos, como ocurrió en El Hondo (Alicante) en 1985 cuando durante una inundación llegó a depositarse en algunos sitios una capa de 15 cm de espesor, lo que supuso desaparición de la vegetación sumergida (Cirujano, 2010). Al disminuir la profundidad se acorta el hidroperíodo y, además, con la entrada de sedimentos a los humedales se produce un aporte de nutrientes que pueden eutrofizar las aguas (Margalef, 1974), lo que puede verse agravado por el uso de fertilizantes y aportes de residuos urbanos. En España la Albufera de Valencia puede considerarse un caso paradigmático de los efectos negativos de la eutrofización sobre las aves acuáticas y en particular sobre el pato colorado, cuya población reproductora en ese lago disminuyó severamente tras las perturbaciones que comenzó a sufrir el humedal a partir de la década de 1960 (véase Tamaño de la población: Población reproductora). Las medidas adoptadas en la Albufera para paliar esta situación han tenido un efecto limitado en el número de patos colorados que crían en el humedal (véase Planes de conservación). De modo similar al de la Albufera, tras la eutrofización de la laguna de la Encanyissada (delta del Ebro) en 1978, los patos colorados no la utilizaron con la misma frecuencia que en años anteriores (Ferrer, 1982). Otro ejemplo dramático de pérdida de hábitat para el pato colorado resultó de las actividades agrícolas alrededor de las Tablas de Daimiel (Ciudad Real), donde tras la declaración del humedal como parque nacional en 1973 ocurrió una transformación agrícola en su entorno, basada en la sobreexplotación de su acuífero. Entre 1974 y 1987 se pasó de 30.000 a 125.000 ha de regadío, lo que determinó la práctica desecación de las Tablas en 1986 (López-Camacho et al., 1996). A causa de la desecación, el suelo se agrietó y se produjo un incendio de la capa de turba del subsuelo en aquel año, afectando a un tercio de la superficie del parque nacional (López-Camacho, 1996). Otro incendio de la turba en 2009 duró cinco años, período en que las Tablas permanecieron secas (Ruiz de la Hermosa, 2019). La degradación de la capa de turbas pudo comprometer la impermeabilización del suelo y, con ello, afectar a la permanencia del agua en superficie. Como consecuencia de todas estas alteraciones, tanto la abundancia de plantas (Figura 6), como la de aves acuáticas, incluyendo al pato colorado, se vieron negativamente afectadas en las Tablas de Daimiel (Sánchez-Carrillo et al., 2016). Además de la disminución en abundancia, también se produjo la desaparición de varias especies de plantas acuáticas (Camargo y Cirujano, 1997), varias de las cuales pueden formar parte de la dieta del pato colorado. Para intentar revertir esta situación se implementaron una serie de planes de gestión (véase Planes de conservación).
Figura 6. Superficie cubierta por la masiega Cladium mariscus durante 1956-2012 en el parque nacional de Las Tablas de Daimiel (según Álvarez y Cirujano, 2012)
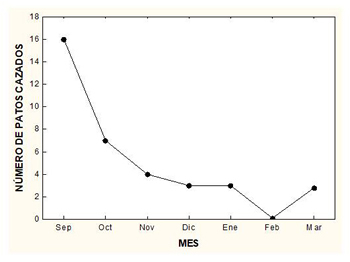
El aporte de productos fitosanitarios y de fertilizantes, junto a la entrada en los humedales de residuos de tipo urbano, industrial o minero puede tener efectos tóxicos sobre los patos colorados (véase Amenazas: Contaminantes). A esta pérdida de calidad del hábitat por esos motivos hay que añadir la de la presencia de perdigones de plomo cinegético en el lecho de los humedales, que los patos colorados ingieren al confundirlos con gastrolitos (véase Ecología trófica), así como los cambios de hábitat de los patos para evitar las perturbaciones que produce la caza (véase Perturbaciones humanas). Aunque en la actualidad está prohibido cazar en los humedales con munición de plomo (véase Planes de conservación), todavía hay una elevada densidad de perdigones de plomo en los humedales españoles usados como cazaderos de aves acuáticas. En el Hondo y en las salinas de Santa Pola, dos zonas importantes para el pato colorado en la Comunidad Valenciana (Gómez-López et al., 2006), se han encontrado densidades medias de 57,3 y 45,4 perdigones/m2, respectivamente, con un valor extremo de 1145 perdigones/m2 en un sitio de El Hondo (Bonet et al., 2010). La larga persistencia de los perdigones en los humedales queda demostrada en la laguna de Santa Olalla, en la que no se caza desde 1964, cuando quedó incluida en la Reserva Biológica de Doñana, y en la que más de 35 años después se muestrearon 12 perdigones/m2 en su fondo (Mateo et al., 2007). También en la laguna de Medina (Cádiz), donde tras ser declarada reserva natural en 1987 y ser prohibida la caza quedaban en su fondo 148 perdigones/m2 unos 15 años después (Mateo et al., 2007). Tanto la laguna de Medina como la de Santa Olalla son utilizadas por el pato colorado, en invernada y temporada de cría (Bernis, 1964; Amat y García, 1979; Amat et al., 1985). Contaminantes Los contaminantes que afectan a los humedales usados por el pato colorado son tanto los empleados en agricultura como los derivados de las actividades industrial y minera. Asimismo, la contaminación de los humedales por perdigones de plomo cinegético puede producir saturnismo (o plumbismo, intoxicación por ingestión de esos perdigones) en los patos. Dos tipos de pesticidas (organoclorados [DDT] y bifenilos policlorados [PCBs]) analizados en cinco tejidos (músculo, hígado, riñón, tejido adiposo y médula) de 31 patos colorados del delta del Ebro fueron detectaron en esos tejidos, excepto los PCBs en médula. No obstante, se encontró que los niveles de contaminación eran menores en pato colorado que en cerceta común Anas crecca o cuchara europeo Spatula clypeata (Llorente et al., 1987). También se analizaron esos tejidos para detectar la presencia de hidrocarburos de petróleo, pero estuvieron por debajo de los niveles de detección (Llorente et al., 1987). De forma similar, en las marismas del Guadalquivir también se detectó la presencia de DDT y PCBs en músculo de pato colorado, pero no la de hidrocarburos (Albaigés et al., 1987). En otro estudio en las marismas del Guadalquivir y en la Albufera de Valencia, Hernández et al. (1982) determinaron DDT y PCBs en músculo e hígado de pato colorado, encontrando bajos niveles de esos pesticidas, lo que estaría en relación con los hábitos herbívoros de la especie. Alberto y Nadal (1981) encontraron en huevos de pato colorado unas concentraciones intermedias de DDE y PCB en relación a los huevos de otras aves acuáticas en el delta del Ebro. En España se han realizado estudios sobre presencia de metales contaminantes en los tejidos corporales o en los huevos de las aves acuáticas, incluido el pato colorado. Como resultado de la rotura de la balsa de una mina en Aznalcóllar (Sevilla) en 1998 se vertieron al río Guadiamar dos millones de m3 de lodos decantados tras el vertido y cuatro millones de m3 de aguas ácidas, que alcanzaron las marismas del Guadalquivir (Ayala-Carcedo, 2004). En el húmero e hígado de 9 patos colorados colectados 2-3 meses tras la rotura de la balsa se encontraron concentraciones de varios metales (arsénico, selenio, zinc, plomo, cobre), algunas de las cuales podrían ser tóxicas (Taggart et al., 2006). Por su parte Mateo y Guitart (2003) analizaron el contenido de varios metales (cromo, manganeso, cobre, zinc, cadmio y plomo) en hígado de 43 patos colorados cazados en el delta del Ebro, la Albufera de Valencia y embalse de El Hondo, encontrando niveles altos de cobre, así como que el contenido en plomo se relacionó con la ingestión de perdigones de plomo cinegético. En las marismas del Guadalquivir, Baluja et al. (1993) hallaron en músculo de dos juveniles y en un huevo de pato colorado concentraciones de mercurio que no resultaban tóxicas. También en relación al saturnismo se han efectuado varios estudios sobre anátidas en España, entre los que se incluyó al pato colorado. Así, Mateo et al. (2007) no detectaron perdigones de plomo cinegético en los estómagos de 17 patos colorados encontrados muertos en las marismas del Guadalquivir. Sin embargo, Mateo et al. (1998) encontraron perdigones de plomo cinegético en los estómagos de 3 de 17 patos colorados cazados en la Albufera de Valencia y en 2 de 7 en El Hondo, considerándose tóxicos los niveles de plomo en el hígado de algunos individuos y pudiéndose atribuir a saturnismo la muerte de otro que cuando fue encontrado estaba muerto. En otro estudio, también en el delta del Ebro, se hallaron perdigones de plomo cinegético en los estómagos de 5 de 20 patos colorados, que además presentaban niveles tóxicos de plomo en el hígado (Mateo et al., 1997). En otro estómago de pato colorado de El Hondo se encontraron perdigones de plomo cinegético, lo que se relacionó con la ingestión de semillas y la necesidad de usar gastrolitos (véase Ecología trófica: Uso de gastrolitos) para facilitar la digestión de las semillas (Suárez y Uríos, 1999). No obstante, la tendencia del pato colorado a ingerir gastrolitos < 1 mm lo hace menos susceptible que otras anátidas, como el ánade rabudo Anas acuta, el ánade azulón Anas platyrhynchos, o el porrón europeo Aythya ferina, a la ingestión de perdigones de plomo cinegético (Mateo et al., 2000). Tras el accidente en la central nuclear de Chernobyl (Ucrania) en 1986 se detectaron patos colorados invernantes en Pakistán con unos niveles de radioactividad intermedios respecto a los de otras anátidas (Afzal y Jafari, 1998). Perturbaciones humanas La perturbación humana más importante que sufren los patos colorados es la provocada por la actividad cinegética. Es una de las especies más codiciadas por los cazadores de aves acuáticas en España y su caza resulta más difícil que la de otras especies de patos (Bernis, 1964; del Portillo, 1978). Se caza desde puesto al amanecer en zonas de querencia, a las que los patos colorados retornan tras una tirada, aunque a grandes intervalos de tiempo. También se caza al salto o desde embarcación en zonas con vegetación emergente (del Portillo, 1978). No hay estadísticas del número de patos colorados cazados anualmente en España. En las décadas de 1940-1960 los humedales donde según Bernis (1964) los colorados fueron cazados en mayores números eran las lagunas y tablas manchegas y la Albufera de Valencia, y en menor medida el delta del Ebro. Otro cazadero importante debió de ser el embalse de El Hondo, del que Bernis (1964) no dispuso de información. El número de patos colorados cazados en la Albufera de Valencia era moderado en relación al de otras especies de patos, de las que se cobraban muchos más individuos, principalmente ánade rabudo y cerceta común Anas crecca (las especies más cazadas), pero también ánade azulón y porrón europeo (Bernis, 1964). Ferrer (1982) presentó datos del número medio de patos colorados cobrados por un único cazador en una localidad del delta del Ebro durante 13 temporadas de caza (Figura 7), poniendo de manifiesto como el número de individuos cazados mensualmente seguía un patrón similar a la abundancia de la especie (Figura 4).
Figura 7. Número medio de patos colorados cobrados por un único cazador durante las temporadas 1962/63 –1975/76 en la laguna de la Encanyissada (delta del Ebro) (modificado de Ferrer, 1982).
Para valorar más adecuadamente los efectos de la caza, a sus impactos directos habría que añadir los indirectos motivados por la perturbación que esa actividad provoca. Así, por ejemplo, en el delta del Ebro el uso del hábitat se vio condicionado durante los períodos de caza, cuando los patos colorados se desplazaron desde sus querencias tradicionales a otros hábitats (arrozales) que pueden ser de menor calidad (Ferrer, 1982). En un humedal costero de Castellón la abundancia de patos colorados disminuyó mucho durante la temporada de caza en comparación a otros períodos en que no hubo caza, ya que los patos se desplazaron fuera del humedal para evitar las molestias (Tirado Bernat, 2018). Otra perturbación de origen humano es la que determina el trasiego de embarcaciones recreativas en los lugares de muda e invernada (Van Impe, 1985; Boutin, 1986; Lang et al., 1999; Dies y Gutiérrez, 2004), así como el vuelo de aeronaves a baja altura sobre los sitios donde descansan los patos (Boutin, 1986). En un lago de Italia el pato colorado mostró unas distancias de huida más largas que el silbón europeo Mareca penelope ante el trasiego de embarcaciones (Battisti, 2020). Un resultado similar obtuvieron Bull y Roedl (2018), quienes concluyeron que el pato colorado era una de las especies de patos más sensibles ante las prácticas deportivas de remo en lagos de Baviera (Alemania). El uso de nasas para captura de cangrejos provoca mortalidad entre los pollos, como se puso de manifiesto en las marismas del Guadalquivir (Gutiérrez-Yurita et al., 1997). En un lago en China las redes de pesca provocaron mortandad de patos colorados adultos (Quang et al., 2002). En la India se documentaron casos de mortandad de patos colorados por turbinas eólicas (Deb et al., 2020). Introducción de especies exóticas en los humedales En algunos humedales ha habido introducciones intencionadas o accidentales de carpas. Estos peces destruyen las praderas sumergidas de macrófitos, como ocurrió tanto en las Tablas de Daimiel como en la laguna de Medina (Cádiz), lo que determinó una disminución drástica de las aves acuáticas herbívoras, incluyendo al pato colorado (Laguna et al., 2016; Maceda-Veiga et al., 2017). En un estudio en Alemania se encontró que durante el período de muda la abundancia de carpas afectaba negativamente a la producción de macrófitos sumergidos y positivamente a la turbidez del agua, pero aunque la abundancia de patos colorados se vio negativamente afectada, la relación con la abundancia de carpas no fue estadísticamente significativa (Köhler et al., 2000). Otra especie introducida que destruye las praderas sumergidas de macrófitos es el cangrejo rojo Procambarus clarkii, como ocurrió en algunos medios de agua dulce en el parque nacional de Doñana (Duarte et al., 1990), lo que puede condicionar el uso de esos humedales por el pato colorado. Además, la pesca del cangrejo rojo provoca mortalidad en los pollos al quedar éstos atrapados en las nasas (véase Amenazas: Perturbaciones humanas). El cisne vulgar Cygnus olor se ha introducido en algunos humedales ibéricos en los que podría coincidir con el pato colorado. Se ha sugerido que los cisnes, a causa de su agresividad, pueden limitar la abundancia de otras aves acuáticas. Sin embargo, un estudio en Francia mostró que la abundancia de patos colorados era mayor y su éxito de reproducción mejor en los sitios donde ambas especies estaban presentes, lo que se relacionó con unas preferencias de hábitat similares en cisnes y patos colorados (Broyer, 2009). En otro estudio en Baviera (Alemania) también se encontró que ni el número de cisnes vulgares ni el de fochas comunes Fulica atra afectaron al número de nidos o de polladas de patos colorados en el embalse de Ismaning (Hofer, 1983). Otras especies introducidas, como ratas Rattus sp. o lucios Esox lucius, predan sobre nidos o pollos de pequeño tamaño, respectivamente (véase Interacciones entre especies).
Planes de conservación Se propuso un plan de gestión a nivel continental y alguna comunidad autónoma (Región de Murcia) elaboraró un plan específico para el pato colorado. En varios humedales se han acometido acciones de restauración, que pueden favorecer al pato colorado. En Baleares se llevó a cabo una reintroducción de la especie en S'Albufera (Mallorca). Conservación en Europa La Unión Europea diseñó un Plan de Acción para 2007-2009 en el que se propusieron 9 acciones para garantizar la conservación del pato colorado (Defos du Rau y Perennou, 2007). Dentro de ese plan una acción es de prioridad esencial cuando es necesaria para evitar un declive tan grande de la población que pueda conducir a su extinción. Una acción es de prioridad alta cuando es necesaria para evitar un declive > 20% de la población en 20 años o menos. Y es de prioridad media cuando es necesaria para evitar un declive < 20% de la población en 20 años o menos. Las acciones propuestas en el plan y sus niveles de prioridad eran:
Para la conservación del pato colorado en Camarga (Francia) Defos du Rau et al. (2005) propusieron la adopción de unas medidas, que incluían:
Conservación en España Las medidas propuestas para la conservación del pato colorado en España (Dies y Gutiérrez, 2004) están basadas en el Plan de Acción para la especie en Europa. En España la gestión de la conservación corresponde a las comunidades autónomas. Los humedales más importantes para las aves acuáticas en cada comunidad gozan de algún estatus de conservación. No obstante, la Región de Murcia elaboró un plan específico para el pato colorado, dado que en la misma se consideró que la especie requería medidas específicas de protección (Guardiola Gómez, 1999). En el mismo se propusieron los siguientes bloques de actuaciones, que a su vez englobaban unos objetivos:
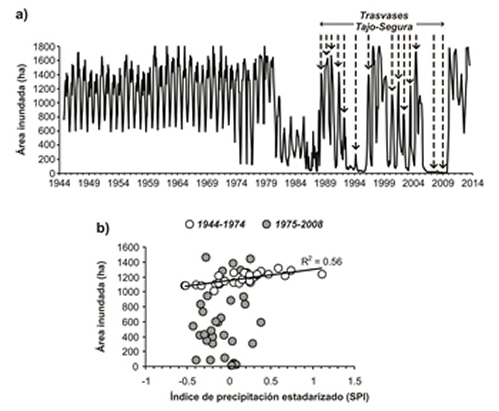
Humedales restaurados y artificiales Dos de los humedales tradicionalmente más importantes para el pato colorado en España, las Tablas de Daimiel y la Albufera de Valencia, sufrieron durante el siglo XX una pérdida en la calidad de sus hábitats afectando negativamente a las poblaciones de la especie. Para contrarrestar esto se realizaron una serie de actuaciones de restauración. En las marismas del Guadalquivir también se restauraron para las aves acuáticas algunas zonas que habían sido transformadas para cultivos agrícolas. Como consecuencia de la sobreexplotación de un acuífero con fines agrícolas, las Tablas de Daimiel experimentaron un descenso en la profundidad de sus aguas que condujo a la desecación del humedal durante varios años (véase Amenazas: Pérdida de hábitats). Para restablecer las condiciones naturales de funcionamiento se propuso un conjunto de medidas, algunas de las cuales no pudieron acometerse por falta de viabilidad (Jódar Abellán et al., 2016). En el marco de un plan de regeneración hídrica de las Tablas, en 1988 comenzaron a realizarse derivaciones del trasvase Tajo-Segura para aportar agua a ese humedal. Los aportes entre 1988 y 2007 variaron entre 6,5 y 30 Hm3/año y no resultaron suficientes para mantener la inundación en las Tablas (Figura 8), por lo que no solucionaron los problemas derivados de la sobreexplotación del acuífero (Jódar Abellán et al., 2016). Junto a esto se adoptaron otras medidas, como la limitación de las extracciones de agua y la construcción de algunas infraestructuras para contención de las aguas, lo que determinó un mayor período de inundación de las Tablas y que el nivel del acuífero experimentase una subida.
Figura 8. a) Superficie inundada en las Tablas de Daimiel durante 1944−2014, mostrando años en los que se hicieron aportes de agua desde el trasvase Tajo−Segura. b) La relación entre el área inundada y la precipitación durante 1944−1974 (cuando el acuífero no estuvo sobreexplotado) y durante 1975-2008 (cuando el acuífero estuvo sobreexplotado) sólo resultó estadísticamente significativa en el primer período (según Sánchez-Carrillo et al., 2016).
Se ha considerado que, de continuar la tendencia de subida, las Tablas volverán a actuar como zona de descarga de agua desde el acuífero (Jódar Abellán et al., 2016). Aunque inicialmente las praderas de plantas acuáticas sumergidas (importante fuente de alimentación para el pato colorado; véase Ecología trófica) se recuperaron con la subida de los niveles de inundación, tras unos años volvieron a desaparecer, lo que se atribuyó a un incremento en la contaminación de las aguas, probablemente facilitada por la construcción de las infraestructuras (presas) para retener el agua en el parque. Al contrario que en la situación original, cuando el agua fluía por las Tablas a través de los ríos, las presas que se construyeron habrían limitado mucho la circulación del agua, de forma que las Tablas habrían actuado como un sumidero de contaminantes agrícolas e industriales (Jódar Abellán et al., 2016). El pato colorado respondió a estas variaciones en los niveles de agua con aumentos y descensos del número de individuos, tanto en invernada como en época de reproducción (Sánchez-Carrillo et al., 2016; Molina et al., 2019). La Albufera de Valencia ha recibido un fuerte impacto ambiental desde el siglo XIX a causa de las prácticas agrícolas, pero más recientemente también por el desarrollo industrial y urbano (Dafauce, 1975; Romo et al., 2008). Como consecuencia de ello, el lago se volvió eutrófico en la década de 1970, por lo que, para intentar cambiar su estado trófico, en 1991 comenzó un desvío parcial de la carga de nutrientes que entraban en el humedal. A pesar de esto los efectos sobre los niveles de eutrofización del lago fueron muy limitados (Romo et al., 2008). Como medidas de restauración para revertir la situación se propuso (1) reducir todavía más la carga de nutrientes que recibe el lago, (2) aumentar los tiempos de renovación del agua con caudales similares a los que normalmente hay entre enero y marzo y (3) favorecer la pesca tradicional, ya que controla los peces que influyen negativamente en la calidad del agua (Romo et al., 2008). Gracias a las medidas adoptadas, al comienzo del siglo XXI hubo algunas fases de agua clara en la Albufera, lo que facilitó el crecimiento de macrófitos sumergidos (Potamogeton pectinatus, P. crispus, Ceratophyllum demersum, Myriophyllum spicatum, Najas marina) en algunos sitios del lago, que sin embargo se perdieron cuando incrementó la turbidez del agua (Jégou y Sanchis-Ibor, 2019). A causa de la eutrofización de la Albufera de Valencia, el número de patos colorados, sobre todo en período de reproducción, se ha visto muy disminuido en relación a lo que había a mediados de la década de 1960 (véase Amenazas: Pérdida de hábitats). Las medidas de restauración han tenido un impacto limitado sobre los patos colorados, superándose raramente las 100 parejas reproductoras durante los primeros años del siglo XXI (Gómez López et al., 2006), frente a las más de 1000 que había a final de la década de 1950 (Bernis, 1972). Sin embargo, en otros lugares, como en un lago en los Países Bajos, donde desaparecieron las praderas sumergidas de Chara spp. a causa de su eutrofización durante los años 1970s y 1980s se logró revertir la situación tras una serie de medidas de restauración, produciéndose una recolonización del lago por esas plantas y con ello un incremento en el número de patos colorados (Noordhuis et al., 2002). También en el lago de Neuchâtel (Suiza) se produjo un incremento en el número de patos colorados cuando se redujo la eutrofización y aumentaron las praderas de Characeae (Keller y Antoniazza, 2001). Otro caso de restauración que merece la pena ser destacado, por la importancia del sitio, es el realizado en las marismas del Guadalquivir en el marco del proyecto Doñana 2005. Sebastián-González y Green (2016) compararon la diversidad de aves acuáticas entre humedales artificiales, con la de otros restaurados y otros naturales, todos ellos en dichas marismas, y encontraron que la diversidad era menor en los humedales artificiales que en los restaurados o en los naturales, existiendo muy pocas diferencias entre los dos últimos. No obstante, los resultados presentados por Sebastián-González y Green (2016) no permiten valorar cómo la restauración de hábitats en las marismas del Guadalquivir afectó específicamente al pato colorado. Se ha sugerido que las balsas para riego agrícola pueden representar un hábitat alternativo para las aves acuáticas ante el deterioro de humedales naturales. Sin embargo el número de individuos que usan esos humedales es tan bajo que puede cuestionarse que esas balsas funcionen como hábitats alternativos de humedales naturales. Por ejemplo, en 89-300 balsas visitadas anualmente cerca de Orihuela (Alicante) durante 2002-2007 se censaron cada año entre 0 y 10 patos colorados (media de 2,2 patos/año) en invernada, en tanto que en época de reproducción se visitaron 222-329 balsas y se registraron anualmente entre 0 y 37 patos colorados (media 10,4 patos/año) (Sebastián-González et al., 2009). El número medio de patos colorados en tres humedales de la provincia de Alicante (El Hondo, La Mata-Torrevieja y salinas de Santa Pola) localizados cerca de aquellas balsas de riego varió durante las invernadas de 1984−2004 entre 123 y 284 individuos, con un máximo de 2400, y durante la temporada de cría en dos de esos humedales (El Hondo y salinas de Santa Pola) entre 99 y 104, con un máximo de 429 (Gómez-López et al., 2006). Aunque las balsas de riego puedan tener algún valor para el pato colorado, la escasa cantidad de individuos que las utiliza en relación a la población regional no justifica la consideración de dichas balsas como hábitats alternativos de los humedales importantes para esta especie. Probablemente la limitada importancia que tienen las balsas de riego se deba a su reducida superficie, ya que humedales artificiales de superficie considerable son utilizados por el pato colorado en grandes números, como por ejemplo durante la muda del plumaje (Tabla 1). Los arrozales también han sido sugeridos como hábitats alternativos o complementarios a los humedales naturales para las aves acuáticas (Fasola y Ruiz, 1996; Pernollet et al., 2015). Sin embargo, su valor para el pato colorado parece mucho más limitado que para otras anátidas en España (Ferrer, 1982; Máñez y Arroyo, 2014), aunque en sitios donde los humedales naturales han sufrido serias perturbaciones los patos colorados pueden hacer un uso mayor de arrozales durante la invernada, como en la Albufera de Valencia (Oltra et al., 2001). Las salinas parecen tener cierta importancia para el pato colorado en algunos sitios, como en Santa Pola y Torrevieja (Alicante) (Gómez López et al. 2006), pero no en otros como en Sanlúcar de Barrameda (Cádiz) (Rendón et al., 2008; Máñez y Arroyo, 2014). El uso de graveras abandonadas ha favorecido el incremento numérico de algunas poblaciones de pato colorado en el centro de España (véanse Tamaño de la población y Hábitat). Prohibición del uso de munición de plomo en los humedales A causa de la actividad cinegética cada año se depositan en los humedales europeos entre 21.000 y 27.000 Tm de plomo, que al ser ingerido por las aves acuáticas provoca efectos tóxicos en las mismas, acarreando en ocasiones la muerte de los individuos (véase Amenazas: Contaminantes). Para evitar las consecuencias de este tipo de contaminación, en 2001 se prohibió mediante un real decreto la utilización de ese tipo de munición en los humedales españoles protegidos. Un estudio en el delta del Ebro mostró que el porcentaje de patos colorados que habían ingerido perdigones de plomo cinegético fue del 19,0% (n = 21) durante 1991-1996 y del 12,5% (n = 16) durante 2007-2012 (Mateo et al., 2014), lo que supone un descenso moderado que en parte se explicaría por la larga persistencia de esos perdigones en los humedales (véase Amenazas: Pérdida de hábitats). En 2020, tras la votación favorable de los Estados miembro, incluida España, el Comité de la Agencia Europea de Sustancias y Mezclas Químicas (ECHA), siguiendo un mandato de la Comisión Europea, aprobó la prohibición del uso del plomo en los humedales de la Unión Europea. Moratorias de caza Bernis (1964) indicó que la "reciente prohibición de cazar en las Tablas de Daimiel ha debido favorecer allí la reproducción del Colorado." No obstante, los efectos de esa prohibición no se pudieron valorar a causa de la degradación ambiental motivada por la sobreexplotación del acuífero y la subsiguiente desecación del humedal (véase Amenazas: Pérdida de hábitats). Bernis (1964) también señaló que en la Albufera de Valencia debían de prohibirse las tiradas de anátidas en marzo, pues su principal finalidad era la caza de patos colorados, que en esa fecha ya podrían haber empezado la reproducción. En 1991 la Generalitat Valenciana retiró al pato colorado de la lista de especies cinegéticas, pero lo volvió a incluir en la misma al año siguiente por la presión de los colectivos de cazadores (Díes y Gutiérrez, 2004). Dado que a causa de las molestias derivadas de la caza la abundancia de patos colorados disminuyó en un humedal de Castellón, Tirado Blanco (2018) propuso una moratoria de caza para facilitar el uso del humedal por los colorados. La prohibición de la caza de aves acuáticas en la Comunidad de Madrid habría favorecido el incremento del número de patos colorados en la misma (Dies y Gutiérrez, 2004), aunque el uso de graveras abandonadas también puede haber contribuido a ese incremento (Juan 2005). Restablecimiento de poblaciones locales Al parecer el pato colorado se extinguió como reproductor en las Islas Baleares entre finales del siglo XIX y principios de XX (Ferrer et al., 1986). En 1991 se liberaron 60 patos colorados en S'Albufera de Mallorca para establecer una población en el humedal (Mayol y Vicens, 1995). En 1992 se reprodujeron 12-15 parejas (Dies y Gutiérrez, 2004), en 2000 unas 60 (Riera et al., 2000), en 2009 unas 125 (González et al., 2009) y 15 en 2019 (López-Jurado et al., 2019). Esta reintroducción en Mallorca podría haber favorecido la presencia del pato colorado en Menorca, donde se hizo regular a partir de 2001 y empezó a reproducirse en 2009 (González et al., 2009).
Referencias Afzal, M., Jafari, R. H. (1998). Studies on radioactivity in different organs of Anseriformes migratory birds. Pp. 83-89. En: Ahmad, M., Shakoori, A. R. (Eds.). Proceedings of the Pakistan Congress of Zoology, Volume 18. University of the Punjab, Lahore. Albaigés, J., Algaba, J., Arambarri, P., Cabrera, F., Baluja, G., Hernández, L. M., Castroviejo, J. (1987). Budget of organic and inorganic pollutants in the Doñana National Park (Spain). Science of the Total Environment, 63: 13-28. Alberto, L. J., Nadal, J. (1981). Residuos organoclorados en huevos de diez especies de aves del delta del Ebro. Publicaciones del Departamento de Zoología (Barcelona), 6: 73-83. Alonso Blanco, M. (2012). Noticiario ornitológico: Pato colorado Netta rufina. Ardeola, 59: 169. Álvarez, M., Cirujano, S. (2012). Seguimiento y recuperación ambiental en el P.N. Las Tablas de Daimiel. Informe inédito. CSIC, Madrid. Amat, J. A. (1982). The nesting biology of ducks in the Marismas of the Guadalquivir, south-western Spain. Wildfowl, 33: 94-104. Amat, J. A. (1984b). Las poblaciones de aves acuáticas en las lagunas andaluzas: composición y diversidad durante un ciclo anual. Ardeola, 31: 61-79. Amat, J. A., Ferrer, X. (1988). Respuestas de los patos invernantes en España a diferentes condiciones ambientales. Ardeola, 35: 59-70. Amat, J. A., García, L. (1979). Distribución y fluctuaciones mensuales de aves acuáticas en Andalucía occidental. Invierno 1977/78. Doñana Acta Vertebrata, 6: 77-90. Amat, J. A., Díaz-Paniagua, C., Herrera, C. M., Jordano, P., Obeso, J. R., Soriguer, R. C. (1985). Criterios de valoración de zonas húmedas de importancia nacional y regional en función de las aves acuáticas. Monografías ICONA. Número 35 (1985). Ministerio de Agricultura, Madrid. Amat, J. A., Lucientes, J., Ferrer, X. (1987). La migración de muda del pato colorado (Netta rufina) en España. Ardeola, 34: 79-88. Aragüés, A., Pérez Bujarrabal, E., Lucientes, J., Bielsa, M. A. (1974). Observaciones estivales en Gallocanta (Zaragoza). Ardeola, 20: 229-244. Arévalo y Baca, J. (1887). Aves de España. Memorias de la Real Academia de Ciencias Exactas, Físicas y Naturales de Madrid, 11: 1-471. Ayala-Carcedo, F. J. (2004). La rotura de la balsa de residuos mineros de Aznalcóllar (España) de 1998 y el desastre ecológico consecuente del río Guadiamar: causas, efectos y lecciones. Boletín Geológico y Minero, 115: 711-738. Ballesteros-Pelegrín, G. A., Zamora-López, A., Zamora-Marín, J. M., Sallent, A., Hernández-Navarro, A. J., Robledano, F., Fuentes-Marín, A. (2021). Atlas de las aves acuáticas del Mar Menor y humedales de su entorno. Dirección General del Mar Menor, Comunidad Autónoma de la Región de Murcia, Murcia. Baluja, G., Hernández, L. M., González, J., Clavero, R. (1993). Mercury distribution in an ecosystem of the "Parque Nacional de Doñana," Spain. Bulletin of Environmental Contamination and Toxicology, 30: 544-551. Battisti, C. (2020). Response behaviour in wintering wigeon (Mareca penelope) due to motor/electric boat disturbance: explorative data suggest a recurrent pattern. Avocetta, 44: 43-45. Belamendia, G. (2008). Noticiario ornitológico: Pato colorado Netta rufina. Ardeola, 55: 290. Bernaldo de Quirós, J. L. (1920). Excursión ornitológica a La Janda (marzo-abril de 1920). Boletín de la Real Sociedad Española de Historia Natural, 20: 236-248. Bernis, F. (1964). Información española sobre anátidas y fochas (época invernal).Sociedad Española de Ornitología, Madrid. Bernis, F. (1972). Status of the wetlands of international importance in Spain and the new Spanish hunting law. Proceedings of the International Conference on the Conservation of Wetlands and Waterfowl, Ramsar, 1971: 239-24. Blanco, G., Acha, A., Cuevas, J. A., Ruiz, P., Velasco, T. (1996). Fenología de la reproducción y productividad de anátidas en ríos del valle medio del Tajo. Ardeola, 43: 31-39. Bonet, A., Terrones, B., Echevarrías, J. L. (2010). Diagnóstico de la acumulación de plomo cinegético en las lagunas del P. N. El Hondo y medidas de restauración. Pp. 34-37. En: Belenguer, R., Echevarrías, J. L., López-Iborra, G. (Eds.). Actas de las I Jornadas científicas sobre el Parque Natural El Hondo. IMEM-Universidad de Alicante y Parque Natural El Hondo, Alicante. Boutin, J. (1986). Comportement diurne de la nette rouse, Netta rufina P., pendant son hivernage en Camargue. Revue d'Ecologie (Terre et Vie), 41: 261-269. Broyer, J. (2009). Compared distribution within a disturbed fishpond ecosystem of breeding ducks and bird species indicators of habitat quality. Journal of Ornithology, 150: 761-768. Broyer, J., Dalery, G. (2000). L'habitat de la nette rouse Netta rufina sur les étangs piscicoles de l'Est de la France en période de reproduction. Alauda, 68: 185-191. Bull, M., Roedl, T. (2018). Stand Up Paddling (SUP): Eine neue Trendsportart als Problem fur uberwinternde and rastende Wasservogel? Berichte zum Vogelschutz, 55: 25-52. Camargo, J. A., Cirujano, S. (1997). Reduction in diversity of aquatic plants in a Spanish wetland: the effect of the size of the inundated area. Journal of Freshwater Ecology, 12: 539-543. Chapman, A., Buck, W. J. (1893). Wild Spain. Gurney & Jackson, London. Čehovská, M., Musil, P., Musilová, Z., Poláková, K., Zouhar, J. (2019). Diving duck census efficiency based on monitoring of individually marked females: the influence of breeding stage and timing of census. Bird Study, 66: 198-206. Cirujano, S. (2010). Evolución de la vegetación acuática en las zonas húmedas: caso del P. N. El Hondo. Pp. 38-40. En: Belenguer, R., Echevarrías, J. L., López-Iborra, G. (Eds.). Actas de las I Jornadas científicas sobre el Parque Natural El Hondo. IMEM-Universidad de Alicante y Parque Natural El Hondo, Alicante. Coronado, R. (1972). Nidificación, comportamiento y biometría de huevos y pollos de ánades ibéricos. Tesis doctoral, Universidad Politécnica de Madrid. Coronado, R., del Portillo, F., Sáez-Royuela, R. (1974). Guía de las anátidas en España. ICONA, Madrid. Dafauce, C. (1975). La Albufera de Valencia: un estudio piloto. Monografías 4. ICONA, Madrid. de Juana, E., Garcia, E. (2015). The birds of the Iberian Peninsula. Christopher Helm, London. de Villanova, T. (1808). Índice de las aves que forman la colección completa de las especies propias de la Albufera de Valencia, disecadas por D. Tomás de Villanova y clasificadas según el sistema de su obra general de ornitología y orden alfabético. Memorias de la Real Sociedad Económica de Amigos del país de Valencia, 11. Deb, H., Sanyal, T., Kaviraj, A., Saha, S. (2020). Hazards of wind turbines on avifauna – A preliminary appraisal within the Indian context. Journal of Threatened Taxa, 12: 15414-15425. Defos du Rau, P., Perennou, C. (2007). Management plan for red-crested pochard (Netta rufina) 2007-2009.Directive 79/409/EEC on the conservation of wild birds. European Communities, Luxembourg. Defos du Rau, P., Barbraud, C., Mondain-Monval, J.-Y. (2005). Incorporating uncertainity into analyses of red-crested pochard habitat selection. Biological Conservation, 125: 355-367. del Portillo, F. (1978). La caza del colorado, pieza reina del paterío ibérico. Trofeo, 96: 33-37. Dies, J. I., Gutiérrez, R. (2003). Pato colorado Netta rufina. Pp. 146-17. En: Martí, R., del Moral, J. C. (Eds.). Atlas de las aves reproductoras de España. Dirección General de Conservación de la Naturaleza-Sociedad Española de Ornitología, Madrid. Dies, J. I. Gutiérrez, R. (2004). Pato colorado Netta rufina. Pp. 104-108. En: Madroño, A., González, C., Atienza, J. C. (Eds.). Libro rojo de las aves de España. Dirección General para la Biodiversidad−SEO/BirdLife, Madrid. Dies, J. I., Dies, B., Vera, P., Giménez, M. (2012). Pato colorado Netta rufina. Pp. 92-93. En: SEO/BirdLife (Ed.). Atlas de las aves en invierno en España 2007-2010. Ministerio de Agricultura, Alimentación y Medio Ambiente−SEO/BirdLife, Madrid. Duarte, C. M., Montes, C., Agustí, S., Martino, P., Bernués, M., Kalff, J. (1990). Biomasa de macrófitos acuáticos en la marisma del parque nacional de Doñana (SW España): importancia y factores ambientales que controlan su distribución. Limnetica, 6: 1-12. Ena, V., Purroy, F. J. (1982). Censos invernales de aves acuáticas en España (enero 1978, 79 y 80). Ministerio de Agricultura, Pesca y Alimentación, Madrid. Fasola, M., Ruiz, X. (1996). The value of rice fields as substitutes for natural wetlands for waterbirds in the Mediterranean región. Colonial Waterbirds, 19 (Special Publication 1): 122-128. Ferrer, X. (1982). Invernada de anátidas en el delta del Ebro. Tesis Doctoral. Universidad de Barcelona. Ferrer, X. (1991). Pato colorado Netta rufina Sivert. Pp. 96-97. En: Uríos, V., Escobar, J.V., Pardo, R., Gómez, J.A. (Eds.). Atlas de las aves nidificantes de la Comunidad Valenciana. Conselleria d'Agricultura i Pesca, Valencia. Ferrer, X., Martínez Vilalta, A., Muntaner, J. (1986). Historia natural dels països catalans. Vol. 12, ocells. Enciclopèdia Catalana, Barcelona. Gómez-López, J. A., Dies-Jambrino, J. I., Vilalta-Vilanova, M. (2006). Las aves acuáticas de la Comunitat Valenciana, censos y evolución de las poblaciones (1984-2004). Conselleria de Territori i Habitatge, Generalitat Valenciana, Valencia. González, J. M., Suárez, M., Rebassa, M., López-Jurado, C., Martínez, O., Pons, A., de Pablo, F., Escandell, R., Florit, J. (2009). Registres ornitològics 2009. Anuari Ornitològic de les Balears, 24: 101-226. González, R., Pérez-Aranda, D. (2011). Las aves acuáticas en España, 1980-2009. SEO/BirdLife, Madrid. Guardiola Gómez, A. (1999). Plan de manejo del pato colorado (Netta rufina) en la Región de Murcia. Pp. 1-112. En: Sánchez Sánchez, M. A., Díez de Revenga Martínez, E. (Eds.). Planes de Gestión de Ardeidas y Anátidas Amenazadas de la Región de Murcia. AMBIENTAL, S.L. para la Dirección General del Medio Natural, Consejería de Medio Ambiente, Agricultura y Agua, Murcia. Gutiérrez-Yurita, P. J., Green, A. J., López-Romero, M. A., Bravo, M. A., Montes, C. (1997). Nuevo modelo de trampa para reducir el impacto de la pesca del cangrejo sobre los vertebrados en las marismas del Guadalquivir. Doñana Acta Vertebrata, 24: 51-66. Hernández, L. M., González, M. J., Rico, M. C., Baluja, G. (1982). Contaminación xenobiótica del Parque Nacional de Doñama. I. Residuos de insecticidas organoclorados, bifenilos policlorados y mercurio en Anseriformes y Gruiformes. Doñana Acta Vertebrata, 9: 161-175. Hoffer, A. (1983). Brutbiologie und Strategien der Jungenaufzucht von Enten (Anatidae) im Ismaninger Teichgebiet. Anzeiger der Ornithologischen Gesellschaft in Bayern, 22: 57-93. Jégou, A., Sanchis-Ibor, C. (2019). The opaque lagoon. Water management and governace in l'Albufera de València wetland (Spain). Limnetica, 38: 503-515. Jódar Abellán, A., Albadalejo García, J. A., Fernández Rodríguez, H. (2016). Análisis de la evolución y estado actual del parque nacional Las Tablas de Daimiel (Cuenca Alta del Guadiana, España). 13º Congreso Nacional de Medio Ambiente: Comunicación Técnica. http://www.conama11.vsf.es/conama10/download/files/conama2016/CT%202016/1998971805.pdf Juan, M. (2005). Muda y reproducción del pato colorado (Netta rufina) en la Comunidad de Madrid. Anuario Ornitológico de Madrid, 2004: 22-39. Jubete, F., Román, J., Sanz-Zuasti, J. (1991). Censo de aves acuáticas nidificantes en las provincias de Salamanca, León, Ávila. Soria, Segovia, Burgos, Valladolid y Palencia. Informe inédito. Keller, V. (2000). Winter distribution and population change of red-crested pochard Netta rufina in southwestern and central Europe. Bird Study, 47: 176-185. Keller, V., Antoniazza, M. (2001). L'importance des réserves d'oiseaux d'eau pour la nette rousse Netta rufina et d'autre espèces hivernantes. Nos Oiseaux, suppl. 5: 81-90. Kloskowski, J., Green, A. J., Polak, M., Bustamante, J., Krogulec, J. (2009). Complementary use of natural and artificial wetlands by waterbirds wintering in Doñana, south-west Spain. Aquatic Conservation: Marine and Freshwater Ecosystems, 19: 815-826. Köhler, U., Köhler, P., Firsching, U., von Krosigk, E. (2000). Einfluss unterchiedlicher Besatzdichten von Karpen Cyprinus carpio auf die Verteilung mausernder Wasservogel in des Fischteichen des Ismaninger Teichgebietes 1996-1999. Ornithologischer Anzeiger, 39: 119-134. Laguna, C., López-Perea, J. J., Viñuela, J., Florín, M., Feliu, J., Chicote, A., Cirujano, S., Mateo, R. (2016). Effects of invasive fish and quality of water and sediment on macrophytes biomass, and their consequences for the waterbird community of a Mediterranean floodplain. Science of the Total Environment, 551-552: 513-521. Lang, A., Müller, A., Lange, F., Lange, A. (1999). Der Starnberger See als Rast- und Überwinterungsgewässer für die Kolbenente Netta rufina von 1966 bis 1998. Ornithologischer Anzeiger, 38: 21-30. Lecocq, A. (1997). Observations des stationnements et des comportements alimentaires de la nette rousse Netta rufina en bai d'Yvonand VD, lac de Neuchâtel. Du rôle des characées. Nos Oiseaux, 44: 83-95. Llorente, G. A., Ruiz, X. (1985). Datos sobre la reproducción del pato colorado, Netta rufina (Pallas, 1773), en el delta del Ebro. Miscel·lània Zoològica, 9: 315-323. Llorente, G. A., Ruiz, X., Serra-Cobo, J. (1986). Alimentation autumnale de la nette rouse (Netta rufina, Aves, Anatidae) dans le Delta de l'Ebre, Espagne. Vie Milieu, 36: 97-107. Llorente, G. A., Farran, A., Ruiz, X., Albaigés, J. (1987). Accumulation and distributions of hydrocarbons, polychlorobyphenyls, and DDT in tissues of three species of Anatidae from the Ebro Delta (Spain). Archives of Environmental Contamination and Toxicology, 16: 563-572. López-Camacho, B., de Bustamante, I., Dorado, M. Araúzo, M. (1996). Hidrología. Pp. 57-63. En: Álvarez, M., Cirujano, S. (Eds.). Las Tablas de Daimiel: Ecología acuática y sociedad. Dirección General de Conservación de la Naturaleza-CSIC, Madrid.López-Jurado, C., Hinckley, D., Riera, X., González, J. M., Capó, J. (2019). Novetats ornitològiques de 2019. Anuari Ornitològic de les Balears, 34: 107-290. Lucientes, J. (1977). La migración de muda del pato colorado en la laguna de Gallocanta. IV Jornadas Ornitológicas Españolas, Barcelona. Maceda-Veiga, A., López, R., Green, A. J. (2017). Dramatic impact of allien carp Cyprinus carpio on globally threatened diving ducks and other waterbirds in Mediterranean swallow lakes. Biological Conservation, 212: 74-85. Máñez, M., Arroyo, J. L. (2014). Las aves acuáticas del censo aéreo. Pp. 83-142. En: Román, J., Vilà, M. (Eds.). Censos aéreos de aves acuáticas en Doñana. Cuarenta años de seguimiento de procesos naturales. CSIC/Catarata, Madrid. Margalef, R. (1974). Ecología. Omega, Barcelona. Martí, R., del Moral, J. C. (Eds.) (2003). La invernada de aves acuáticas en España. Dirección General de Conservación de la Naturaleza-SEO/Birdlife. Ed. Organismo Autónomo Parque Nacionales, Serie Técnica. Ministerio de Medio Ambiente, Madrid. Martínez-Abraín, A., (1999). Patrones de asociaciones de anátidas durante la invernada en un dormidero del este de España. Ardeola, 46, 163-169. Martínez-Vilalta, A., Motis, A. (1989). Els ocells del delta de l'Ebre. Lynx Edicions, Barcelona. Mateo, R., Belliure, J., Dolz, J. C., Aguilar Serrano, J. M., Guitart, R. (1998). High prevalences of lead poisoning in wintering waterfowl in Spain. Archives of Environmental Contamination and Toxicology, 35: 342–347Mateo, R., Green A. J., Lefranc, H., Baos, R., Figuerola, J. (2007). Lead poisoning in wild birds from southern Spain: a comparative study of wetland areas and species affected, and trends over time. Ecotoxicology and Environmental Safety, 66: 119–126. Mateo, R., Guitart, R. (2003). Heavy metals in livers of waterbirds from Spain. Archives of Environmental Contamination and Toxicology, 44: 398–404. Mateo, R., Guitart, R., Green, A. J. (2000). Determinants of lead shot, rice, and grit ingestión in ducks and coots. Journal of Wildife Management, 64: 939-947. Mateo, R., Martínez-Vilalta, A., Guitart, R. (1997) Lead shot pellets in the Ebro delta, Spain: densities in sediments and prevalence of exposure in waterfowl. Environmental Pollution,96:335–341. Mateo, R., Vallverdú-Coll, N., López-Antia, A.,Taggart, M. A., Martínez-Haro, M., Guitart, R., Ortiz-Santaliestra, M. E. (2014). Reducing Pb poisoning in birds and Pb exposure in game meat consumers: The dual benefit of effective Pb shot regulation. Environment International, 63: 163-168. Mayol, J., Vicens, P. (1995). Reintroducció de Porphyrio porphyrio, Netta rufina i Oxyura leucocephala a S'Albufera de Mallorca. Monografies de la Societat d'Historia Nalural de les Balears, 4: 159-168. Molina, B., Prieta, J., Lorenzo, J. A., López-Jurado, C. (2019). Noticiario ornitológico. Ardeola, 66: 205-255. Montero, R. (2017). Noticiario ornitológico: Pato colorado Netta rufina. Ardeola, 64: 240. Moreno-Ostos, E., Paracuellos, M., de Vicente, I., Nevado, J. C., Cruz-Pizarro, L. (2008). Response of waterbirds to alternating phases in two Mediterranean lakes. Aquatic Ecology, 42: 701-706. Noble, H. (1902). Forty-four days' nesting in Andalucia. Ibis, 44: 67-89. Noordhuis, R., van der Molen, D. T., van der Berg, M. S. (2002). Response of herbivorous water-birds to the return of Chara in Lake Veleuwemeer, The Netherlands. Aquatic Botany, 72: 349-367. Oltra, C., Dies, J. I., García, F. J., Dies, B., Catalá, F. J. (2001). Anátidas invernantes en el Parc Natural de l'Albufera de Valencia: descripción y factores ambientales implicados. Spartina, 4: 152-174. Palomino, D. (2009). Pato colorado. Pp. 58-61. En: Palomino, D., Molina, B. (Eds.). Aves acuáticas reproductoras en España. Población en 2007 y método de censo. SEO/BirdLife, Madrid. Pardo, L. (1942). La Albufera de Valencia. Estudio limnográfico, biológico, económico y antropológico. Instituto Forestal de Investigaciones y Experiencias, 24, Madrid. Pardo de Santayana, J. I. (1974). Contribución a la ornitología del pantano del Ebro, con algún dato de otras localidades de Santander. Ardeola, 20: 221-228. Pérez Chiscano, J. L. (1997). Noticiario ornitológico: Pato colorado Netta rufina. Ardeola, 44: 248. Pernollet, C. A., Guelmami, A., Green, A. J., Curcó Masip, A., Dies, B., Bogliani, G., Tesio, F., Brogi, A., Gauthier-Clerc, M., Guillemain, M. (2015). A comparison of wintering duck numbers among European rice production áreas with contrasting flooding regimes. Biological Conservation, 186: 214-224. Prieta, J., Mayordomo, S., Cardalliaguet, M. (2013). Aves de Extremadura, volumen 4. 2004-2008. SEO-Extremadura, Plasencia. Quang, R. C., Wen, X., Yang, X. (2002). Effects of human activities on migratory waterbirds at Lashihai Lake, China. Biological Conservation, 108: 273-279. Rendón, M. A., Green, A. J., Aguilera, E., Almaraz, P. (2008). Status, distribution and long term changes in the waterbird community wintering in Doñana, south-west Spain. Biological Conservation,141, 1371-1388. Riera, J., González, J. M., López-Jurado, C., Martínez, O., Palerm, J. C. (2000). Registres ornitològics. Anuari Ornitològic de les Balears, 15: 51-155. Román Sancho, J. (1998). Noticiario ornitológico: Pato colorado Netta rufina. Ardeola, 45: 120. Romo, S., García-Murcia, A., Villena, M. J., Sánchez, V., Ballester, A. (2008). Tendencias del fitoplancton en el lago de la Albufera de Valencia e implicaciones para su ecología, gestión y recuperación. Limnetica, 27: 11-28. Ruíz de la Hermosa, C. A. (2019). El parque nacional Las Tablas de Daimiel. Implicaciones del manejo y gestión en el Pacto sobre el Agua. Cuadernos de la Sociedad Española de Ciencias Forestales, 45: 79-92. Sáez-Royuela, R. (1997). Pato colorado Netta rufina. Pp. 80-81. En Purroy, F.J. (Ed.). Atlas de las aves de España (1975-1995). Lynx Edicions, Barcelona. Sánchez-Carrillo, S., Álvarez-Cobelas, M., Cirujano, S., Carrasco-Redondo, M., Díaz-Cambronero, A. (2016). La información a largo plazo como herramienta clave para la evaluación de los cambios ambientales en las tablas de Daimiel: LTER-Daimiel. Ecosistemas, 25: 4-8. Sánchez García, A. (1989). El embalse de Orellana (Badajoz), localidad de muda del pato colorado. Ardeola, 36: 239. Sanz, T. (2000). Las aves acuáticas del pantano de Monteagudo (Monteagudo de las Vicarías, Soria) 1989-1999. Algunas consideraciones sobre el zampullín cuellinegro (Podiceps nigricollis, C. L. Brehm, 1831). Oxyura, 10: 123-135. Sanz-Zuasti, J., Velasco, T. (1999). Guía de las aves de Castilla y León. Carlos Sánchez, Medina del Campo. Sebastián-González, E., Green, A. J., (2016). Reduction of avian diversity in created versus natural and restored wetlands. Ecography,39, 1176-1184. Sebastián-González, E., Sánchez-Zapata, J. A., Botella, F. (2009). Agricultural ponds as alternative habitat for waterbirds: spatial and temporal patterns of abundance and management strategies. European Journal of Wildlife Research, 56: 11-20. Suárez, C., Uríos, V. (1999). La contaminación por saturnismo en las aves acuáticas del Parque Natural de El Hondo y su relación con los hábitos alimenticios. Humedales Mediterráneos, 1: 83-90. Szijj, J. (1965a). Ökologische Untersuchungen an Entelvógeln (Anatidae) des Ermatinger Beckens (Bodensee). Vogelwarte, 23: 24-71. Taggart, M. A., Figuerola, J., Green, A .J., R. Mateo, R., Deacon, C., Osborn, D., Meharg, A. A. (2006). After the Aznalcóllar mine spill: Arsenic, zinc, selenium, lead and copper levels in the livers and bones of five waterfowl species. Environmental Research, 100: 349–361. Tirado Bernat, M. (2018). Evolución de las poblaciones de especies acuáticas cinegéticas en el humedal del Prat de Cabanes-Torreblanca (E de la península ibérica) durante el período invernal. Nemus, 8: 115-131. Valverde, J. A. (1960). Vertebrados de las marismas del Guadalquivir: introducción a su estudio ecológico. Archivos del Instituto de Aclimatación de Almería, 9: 1-168. Van Impe, J. (1985). Contribution à la mue des rémiges chez la nette à huppe rousse Netta rufina (Pallas) en Espagne du Nord. Alauda, 53: 1-10. Velasco, T., Blanco, G. (1998). Las aves acuáticas nidificantes en los ríos de la Comunidad de Madrid. Anuario Ornitológico de Madrid, 1997: 96-101. Vidal, I. (1851). Catálogo de las aves de la Albufera. Memorias de la Real Academia de Ciencias Exactas, Físicas y Naturales de Madrid, 1: 167-199.
Juan A. Amat
Alfredo Salvador Fecha de publicación: 5-05-2021 Amat, J. A., Ballesteros, G., Salvador, A. (2021). Pato Colorado – Netta rufina. En: Enciclopedia Virtual de los Vertebrados Españoles. López, P., Martín, J. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||