|
|
|
|
|
|
Para más información sobre cada apartado hacer click en:
|
Key words: Cory's Shearwater, habitat, abundance, status, threats.
Hábitat Especie pelágica, la pardela cenicienta vive en mar abierto, tanto en zonas neríticas sobre la plataforma continental como en zonas pelágicas, acudiendo a tierra firme tan sólo durante el período reproductor. Hábitat de nidificación Gregarias durante la nidificación, forman colonias de cría situadas en islas, islotes y acantilados costeros, en áreas originariamente libres de depredadores terrestres. Los nidos se sitúan en huras, esto es, túneles o grietas a diferente altura, a menudo dentro de cuevas calizas o volcánicas, bajo derrubios, en pequeñas galerías excavadas por ellas mismas o incluso en antiguas madrigueras de conejo (Furness et al., 2000). En lugares sin ningún tipo de depredación –o con niveles muy bajos-, como en el Archipiélago de las Islas Salvajes, algunas huras pueden ser cortas y abiertas, mientras que en lugares con altos índices de depredación, las huras suelen ser más largas y angostas. Al menos en las Islas Canarias, se tiene constancia de la reproducción de esta especie también en zonas abruptas del interior (Martín y Lorenzo, 2001), hecho que debió ser, probablemente, más habitual en el pasado, previo a la ocupación humana del archipiélago y la consecuente caza e introducción de depredadores foráneos. Durante la época de cría, el hábitat marino que explotan puede variar. Debido a sus necesidades tróficas y a la disposición de sus colonias en el mar, los adultos reproductores se ven obligados a retornar al nido para incubar o para alimentar al pollo tras invertir varios días en el mar en busca de alimento (estrategia denominada en lengua inglesa central-place foraging). Este hecho es determinante en la extensión de sus movimientos de búsqueda de alimento durante la cría, y las poblaciones de las diferentes colonias reproductoras pueden afrontarlo mediante dos estrategias diferentes en función de su localización. Cuando los recursos en las aguas neríticas próximas a la colonia son escasos, las pardelas usan especialmente durante la fase de cría del pollo una estrategia bimodal, de forma que alternan viajes cortos (menos de 5 días) a aguas cercanas a la colonia, para obtener alimento con el que aprovisionar al pollo, con largos viajes de autoabastecimiento en áreas muy productivas, a menudo muy alejadas de la colonia de cría (Paiva et al., 2010a). Este es el caso de las pardelas cenicientas que crían en Azores y Salvajes (Paiva et al., 2010b, 2010c). Sin embargo, otras poblaciones, como las que se reproducen en las Islas Canarias, no se ajustan de forma tan evidente a esta estrategia, realizando menos viajes pero de mayor duración, dado que se desplazan a puntos de alta productividad como la costa de Marruecos y Sáhara Occidental, a relativamente poca distancia del archipiélago (Navarro y González-Solís, 2009, Reyes-González et al., 2017). Hábitat de alimentación En mar abierto, ocupa aguas cálidas o templadas de zonas subtropicales del Atlántico, suficientemente productivas como para abastecer sus necesidades tróficas. Se encuentran a menudo asociadas, por ello, a zonas de elevada productividad biológica como frentes oceánicos, zonas de afloramiento de aguas profundas, o extensas plataformas continentales (Paiva et al., 2010a). Varios estudios han puesto en evidencia la enorme dependencia de las colonias de cría de Canarias y Salvajes por las aguas de la Corriente de Canarias, donde el afloramiento de aguas profundas próximo a la costa africana produce una elevada productividad, que es aprovechada por las aves (Fig. 1) (Paiva et al., 2010b; Navarro y González-Solís, 2009, Ramos et al., 2013, Reyes-González et al., 2017). Las pardelas atlánticas de las colonias de Madeira, Salvajes y Canarias se alimentan en la plataforma continental africana más cercana, con segregación espacial entre colonias aunque hay cierto solapamiento a lo largo de la Corriente de Canarias (Ramos et al., 2013)1.
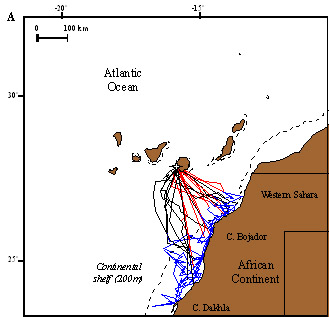
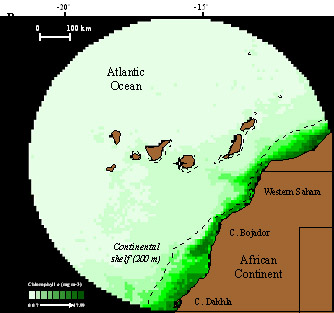
Figura 1. La imagen superior (A) muestra los viajes de alimentación de varios individuos de C. borealis reproductores en Canarias (en rojo, trayecto de ida, en azul, búsqueda de alimento, en negro trayecto de retorno a la colonia). Todos los individuos utilizan la costa africana para encontrar alimento durante la época de reproducción. La imagen inferior (B) muestra cómo las zonas en las que las aves buscan alimento son precisamente las más productivas (representadas con un verde más intenso, con mayor producción de clorofila A) en el entorno de las islas. Según Navarro y González-Solís (2009). En la colonia de las islas Chafarinas, donde C. borealis nidifica junto con C. diomedea, buscan mayoritariamente alimento en zonas de la plataforma continental próximas a la colonia, con solapamiento espacial entre ambas especies durante la incubación (Afán et al., 2014)1. Las aves con más experiencia, que tienen más años de éxito reproductivo, son menos pelágicas a lo largo del año (Haug et al., 2015), tienen rutas de migración menos extensas, utilizan un menor número de áreas de invernada y muestran valores isotópicos de nitrógeno y carbono más altos que las aves con menos experiencia (Missagia et al., 2015)1. Paiva et al. (2013) encontraron que la disminución de la productividad que se registró en áreas próximas a la colonia de Berlenga (Portugal) entre 2007 y 2010 hizo que las hembras se desplazaran durante el periodo de prepuesta en busca de alimento hasta el Gran Banco de Terranova, situado a casi 4.000 km de distancia, disminuyendo su condición física y el éxito de eclosión ()1.
Tamaño de población Las estimas más recientes son de unas 251.100-251.300 parejas (Derhé, 2011). En las islas Berlengas) hay unas 200-250 parejas, en el archipiélago de Azores cerca de 180.000 parejas, en el de Madeira entre 16.500 y 25.000 parejas (BirdLife International, 2004) y en las islas Salvajes unas 30.000 parejas (Granadeiro et al., 2006). Se estiman una 30.000 parejas en el archipiélago canario (Carboneras y Lorenzo, 2003). En esta área, las colonias localizadas en el conjunto de islas e islotes que conforman el Parque Natural del Archipiélago Chinijo son las de mayor importancia. La principal colonia de cría (8.000-10.000 parejas) se sitúa en la isla de Alegranza. Los islotes de Montaña Clara, Lobos y la isla de Lanzarote acogen unas 1.000 parejas cada isla. En el contexto atlántico pero al margen de Canarias, se han localizado recientemente algunos núcleos reproductores incipientes de pequeña entidad en aguas de Galicia, aunque su viabilidad se está viendo seriamente comprometida debido a la alta tasa de mortalidad, tanto en adultos como en pollos, causada por depredadores introducidos (Munilla y Velando, 2009).
Estatus de conservación Categoría global IUCN (2015): Preocupación menor LC (BirdLife International, 2015)1. Categoría España IUCN (2002): Vulnerable VU A3d+4d (Lorenzo, 2004). En el territorio español la especie se encuentra incluída en el Listado de Especies Silvestres en Régimen de Protección Especial (B. O. E., 2011), si bien la subespecie C.d.diomedea se incluye además en el Catálogo Español de Especies Amenazadas bajo la categoría de “Vulnerable” (B. O. E., 2011). A nivel europeo, se incluye en la categoría SPEC 2. En general sufre una tendencia regresiva, a pesar de las medidas de protección llevadas a cabo en las dos últimas décadas. Esta regresión generalizada viene motivada por causas de diferente índole.
Amenazas y medidas de conservación Muerte en artes de pesca La muerte accidental de aves en artes de pesca, especialmente la debida a la actividad pesquera con palangre, parece ser la principal causa de mortalidad no natural de la especie, tanto en áreas de cría como de invernada (Cooper et al., 2003; ICES, 2009). Al ser una especie longeva y con un único pollo por pareja y año, la mortalidad de aves en edad reproductora puede provocar graves declives en un corto período de tiempo, análogos a los detectados en la pardela Balear (Oro et al., 2004). Durante su estancia en aguas más australes, fuera de la época de reproducción, la especie también se ve afectada por la actividad pesquera aunque, hasta donde se sabe, en un grado mucho menor (Bugoni et al., 2008). La sustitución paulatina por artes y técnicas de pesca que reduzcan la mortalidad se plantea como solución al problema: calado nocturno (Sánchez y Belda, 2003), líneas espantapájaros, cebo tintado entre otras. Sobrepesca Un problema derivado de la intensificación pesquera es la sobrepesca. Ésta, en consecuencia, puede desembocar en una disminución de la disponibilidad de alimento, lo que podría afectar negativamente a las poblaciones de aves marinas. Sin embargo, aún no se ha demostrado este efecto sobre la pardela cenicienta. Depredadores introducidos La introducción de depredadores antropófilos, como gatos asilvestrados (Felis catus), ratas (Rattus sp.) y ratones (Mus musculus, Apodemus sylvaticus)en las islas e islotes donde cría esta pardela y otras especies de aves marinas, puede llegar a hacer desaparecer algunas colonias. Por otro lado, los conejos (Oryctolagus cuniculus), frecuentemente introducidos en islas e islotes, compiten con las aves marinas por el uso de pequeños túneles y galerías como madrigueras. Traveset et al. (2009) reportan tasas de fracaso reproductivo de un 53% (sobre 80 nidos seguidos) en Gran Canaria por acción directa de ratas y ratones. En la isla de Corvo (Azores), la rata negra (Rattus rattus) complementa su dieta con huevos y pollos de C. borealis. De seis pollos depredados registrados con cámaras, cinco fueron depredados por gatos y uno por rata negra (Hervias et al., 2014)1. En 2010 se registraron en las islas Sisargas 23 adultos muertos, probablemente por la acción de gatos asilvestrados abandonados en las islas (Munilla et al., 2016)1. Las medidas de control de depredadores introducidos, a pesar de su elevado coste, parecen tener resultados positivos (Donlan y Wilcox, 2008). En Chafarinas, donde había una elevada densidad de ratas, las tareas de desratización fueron paralelas a un aumento en la productividad de la colonia (Igual et al., 2006a). En algunas islas, especialmente en las Canarias, la competencia con los conejos por las galerías donde situar el nido, ha provocado disminución en el éxito reproductor de ciertas colonias (Lorenzo, 2004); afortunadamente medidas activas de erradicación han conseguido eliminar al conejo de ciertos islotes como Montaña Clara (Lanzarote), donde cría una importante población de pardelas (Martín et al., 2002). En las Islas Salvajes, tras la erradicación de conejos y ratones en 2002, el número de pollos de pardelas que consiguieron terminar su desarrollo fue un 20-40% superior al de las trece temporadas de cría anteriores al inicio de las medidas de control (Zino et al., 2008). Deslumbramientos Uno de los daños colaterales de la urbanización del litoral es el provocado por los deslumbramientos (Lorenzo, 2004). En las colonias de Canarias es bien sabido que los juveniles de pardela, en sus primeros vuelos, se desorientan y terminan chocando contra edificios y tendidos eléctricos a causa del deslumbramiento por las luces urbanas. En un seguimiento realizado a lo largo de 9 años, unas 9.000 pardelas cenicientas resultaron afectadas por este problema en la isla de Tenerife, de las que un 95% pudieron ser recuperadas y devueltas al medio natural (Rodríguez y Rodríguez, 2009). Desde organizaciones locales, los Cabildos y el Gobierno de Canarias se hace frente a este problema con la recogida, cuidado y posterior recuperación de numerosas aves extraviadas, tendiendo a implicar a la población civil en el proceso de retorno de las aves al medio natural. La mortalidad es más elevada en las colonias situadas en el interior de las islas (Rodríguez et al., 2015)1. Los volanderos tardíos con abundante plumón son más susceptibles a las colisiones (Rodríguez et al., 2012)1. Contaminación y vertidos En la zona de invernada de la Corriente de Brasil, se han encontrado materiales sintéticos en el estómago en un 87% de las aves analizadas (Petry et al., 2009). Dicha acumulación en el estómago podría provocar efectos negativos en los ejemplares, aunque hasta la fecha no hay estudios que lo demuestren. Con la ceba, los adultos transfieren a lo pollos fragmentos de plástico. El 83% de los volanderos varados en Canarias por la contaminación lumínica contenían en promedio ocho fragmentos de plástico en el estómago (Rodríguez et al., 20121). Debido a su posición en la cima de las redes tróficas marinas, es susceptible a la bioacumulación de contaminantes presentes en el medio marino. Por ejemplo, Monteiro et al. (1998) demostraron unos niveles elevados de mercurio en sangre en la población de Azores. También en Azores, Stewart et al. (1997) encontraron niveles de cadmio comparativamente más elevados que los descritos en otras aves marinas. Renzoni et al. (1986) encontraron mayores niveles de mercurio, hexachlorobenceno, DDE y PCBs en C. diomedea que en C. borealis. Roscales et al. (2010) muestran que la cantidad de compuestos organoclorados en la sangre es mayor en C. diomedea que en C. borealis. Caza ilegal Por último, aunque parece ser una afección prácticamente erradicada, su caza ilegal para consumo humano ha ocurrido de forma tradicional en las islas (Martín y Lorenzo, 2001), sabiéndose de su consumo incluso en tiempos de los aborígenes (Randoet al., 1997). La captura, fundamentalmente de pollos, se producía no sólo para consumo -aunque sí en su mayoría-, sino también para obtener aceite y plumas. Martín y Lorenzo (2001) citan unas 6.000-8.000 pardelas capturadas en Alegranza en la primera mitad del siglo XX (7.500 pollos capturados en 1926). En la actualidad todavía se registran casos de consumo humano de los pollos de forma ocasional en algunas localidades de las Islas Canarias.
Referencias Afán, I., Navarro, J., Cardador, L., Ramírez, F., Kato, A., Rodríguez, B., Ropert-Coudert, Y., Forero, M. G. (2014). Foraging movements and habitat niche of two closely related seabirds breeding in sympatry. Marine Biology, 161 (3): 657-668. BirdLife International (2004). Birds in europe: population stimates, trends and conservation status. Cambridge, UK. BirdLife International (2015). Calonectris borealis. En: The IUCN Red List of Threatened Species 2015: e.T22732244A83955374. Bugoni, L., Mancini, P. L., Monteiro, D. S., Nascimento, L., Neves, T. S. (2008). Seabird bycatch in the Brazilian pelagic longline fishery and a review of capture rates in the southwestern Atlantic Ocean. Endangered Species Research, 5: 137-147. Carboneras, C., Lorenzo, J. A. (2003). Parcela Cenicienta Calonectris diomedea. Pp. 84-85. En: Martí, R., Del Moral, J. C. (2003) Atlas de las Aves Reproductoras de España, Dirección General de Conservación de la Naturaleza - Sociedad Española de Ornitología, Madrid. Cooper, J., Baccetti, N., Belda, E. J., Borg, J. J., Oro, D., Papaconstantinou, C., Sanchez, A. (2003). Seabird mortality from longline fishing in the Mediterranean Sea and Macaronesian waters: a review and a way forward. Scientia Marina, 67: 57-64. Derhé, M. A. (Ed.) (2011). Population assessment for the Cory’s Shearwater Calonectris diomedea. BirdLife International for the European Commission. Cambridge. Donlan, C. J., Wilcox, C. (2008). Integrating invasive mammal eradications and biodiversity offsets for fisheries bycatch: conservation opportunities and challengues for seabirds and sea turtles. Biological Invasions, 10: 1053-1060. Furness, R. W., Hilton, G., Monteiro, L. R. (2000). Influences of coastal habitat characteristics on the distribution of Cory´s shearwaters Calonectris diomedea in the Azores Archipelago. Bird Study, 47: 257-265. Granadeiro, J. P., Dias, M. P., Rebelo, R., Santos, C. D., Catry, P. (2006). Numbers and Population Trends of Cory's Shearwater Calonectris diomedea at Selvagem Grande, Northeast Atlantic. Waterbirds, 29: 56-60. Haug, F., Paiva, V. H., Werner, A. C., Ramos, J. A. (2015). Foraging by experienced and inexperienced Cory's shearwater along a 3-year period of ameliorating foraging conditions. Marine Biology, 162 (3): 649-660. Hervias, S., Ceia, F. R., Pipa, T., Nogales, M., Ruiz de Ybañez, R., Ramos, J. A. (2014). How important are seabirds in the diet of black rats on islands with a superpredator? Zoology, 117 (3): 171-178. ICES (Eds.) (2009). Report of the Working Group on Seabird Ecology (WGSE), 23-27 March 2009. ICES CM 2009/LRC:05. 91 pp. Igual, J. M., Forero, M. G., Gómez, T., Orueta, J. F., Oro, D. (2006a). Rat control and breeding performance in Cory's shearwater (Calonectris diomedea): effects of poisoning effort and habitat features. Animal Conservation, 9: 59-65. Lorenzo, J. A. (2004). Parcela Cenicienta Calonectris diomedea borealis. Pp. 43-45. En: Madroño, A., González, C., Atienza, J. C. (Eds.). Libro Rojo de las Aves de España. Dirección General para la Biodiversidad-SEO/BirdLife, Madrid. Martín, A., Lorenzo, J. A. (2001). Aves del Archipiélago Canario. Francisco Lemus ed., Tenerife. 787 pp. Martín, A., Nogales, M., Alonso, J., Rodríguez, B., De León, L., Izquierdo, C., Martín, M., Marrero, P., Puerta, N., Cazorla, J., Rodríguez, B., López, M., Martínez, J., Pérez, D., Ginovés, J., González, E. (2002). Restauración de los Islotes y del Risco de Famara (Lanzarote). Departamento de Biología Animal (Zoología), Universidad de La Laguna, La Laguna, España. Missagia, R. V., Ramos, J. A., Louzao, M., Delord, K., Weimerskirch, H., Paiva, V. H. (2015). Year-round distribution suggests spatial segregation of Cory's shearwaters, based on individual experience. Marine Biology, 162 (11): 2279-2289. Monteiro, L. R., Granadeiro, J. P., Furness, R. W. (1998). Relationship between mercury levels and diet in Azores seabirds. Marine Ecology Progress Series, 166: 259-265. Munilla, I., Genovart, M., Paiva, V. H., Velando, A. (2016). 2016). Colony Foundation in an Oceanic Seabird. Plos One, 11 (2): e0147222. Munilla, I., Velando, A. (2009). Plan Integral de Recuperación e Conservación das Aves Mariñas Ameazadas de Galicia. Consellería de Medio Ambiente e Desenvolvemento Sostible. Xunta de Galicia. Navarro, J., González-Solís, J. (2009). Environmental determinants of foraging strategies in Cory's shearwater. Marine Ecology Progress Series, 374: 259-267. Oro, D., Aguilar, J. S., Igual, J. M., Louzao, M. (2004). Modelling demography and extinction risk in the endangered Balearic shearwater. Biological Conservation, 116: 93-102. Paiva, V. H., Geraldes, P., Ramírez, I., Garthe, S., Ramos, J. A. (2010a). How area restricted search of a pelagic seabird changes while performing a dual foraging strategy. Oikos, 119: 1423-1434. Paiva, V. H., Geraldes, P., Ramírez, I., Meirinho, A., Garthe, S., Ramos, J. A. (2010b). Foraging plasticity in a pelagic seabird species along a marine productivity gradient. Marine Ecology Progress Series, 398: 259-274. Paiva, V. H., Geraldes, P., Ramírez, I., Meirinho, A., Garthe, S., Ramos, J. A. (2010c). Oceanographic characteristics of areas used by Cory's shearwaters during short and long foraging trips in the North Atlantic. Marine Biology, 157: 1385-1399. Paiva, V. H., Geraldes, P., Ramírez, I., Werner, A. C., Garthe, S., Ramos, J. A. (2013). Overcoming difficult times: the behavioural resilience of a marine predator when facing environmental stochasticity. Marine Ecology Progress Series, 486: 277-288. Petry, M. V., Krüger, L., Fonseca, V. S. S., Brummelhaus, J., Piaco, R. C. (2009). Diet and ingestion of synthetics by Cory's Shearwater Calonectris diomedea off southern Brazil. Journal of Ornithology, 150: 601-606. Ramos, R., Granadeiro, J. P., Rodríguez, B., Navarro, J., Paiva, V. H., Becares, J., Reyes-González, J. M., Fagundes, I., Ruiz, A., Arcos, P., González-Solís, J., Catry, P. (2013). Meta-population feeding grounds of Cory's shearwater in the subtropical Atlantic Ocean: implications for the definition of Marine Protected Areas based on tracking studies. Diversity and Distributions, 19 (10): 1284-1298. Rando, J. C., López, M., Jiménez, M. C. (1997). Bird remains from the archaeological site of Guinea (el Hierro, Canary Islands). International Journal of Ostearchaeology, 7: 298-302. Renzoni, A., Focardi, S., Fossi, C., Leonzio, C., Mayol, J. (1986). Comparison between concentrations of mercury and other contaminants in eggs and tissues of Cory's shearwater Calonectris diomedea collected on Atlantic and Mediterranean islands. Environmental Pollution Series A Ecological and Biological, 40 (1): 17-35. Reyes-González, J. M., Zajková, Z., Morera Pujol, V., de Felipe, F., Militão, T., Dell’Ariccia, G., Ramos, R., Igual, J. M., Arcos, J. M., González-Solís, J. (2017). Migración y ecología espacial de las poblaciones españolas de pardela cenicienta. Monografía n.º 2 del programa Migra. SEO/BirdLife, Madrid. Rodríguez, R., Rodríguez, B. (2009). Attraction of petrels to artificial lights in the Canary Islands: effects of the moon phase and age class. Ibis, 151: 299-310. Rodríguez, A., Rodríguez, B., Carrasco, M. N. (2012). High prevalence of parental delivery of plastic debris in Cory's shearwaters (Calonectris diomedea). Marine Pollution Bulletin, 64 (10): 2219-2223. Rodríguez, A., Rodríguez, B., Curbelo, A. J., Pérez, A., Marrero, S., Negro, J. J. (2012). Factors affecting mortality of shearwaters stranded by light pollution. Animal Conservation, 15 (5): 519-526. Rodríguez, A., Rodríguez, B., Negro, J. (2015). GPS tracking for mapping seabird mortality induced by light pollution. Scientific Reports, 5: 10670. Roscales, J. L., Muñoz-Arnanz, J., González-Solís, J., Jiménez, B. (2010). Geographical PCB and DDT patterns in shearwaters (Calonectris sp.) breeding across the NE Atlantic and the Mediterranean archipelagos. Environmental Science & Technology, 44: 2328-2334. Sanchez, A., Belda, E. J. (2003). Bait loss caused by seabirds on longline fisheries in the northwestern Mediterranean: Is night setting an effective mitigation measure? Fisheries Research, 60: 99–106. Stewart, F. M., Monteiro, L. R., Furness, R. W. (1997). Heavy metals concentrations in Cory's Shearwater, Calonectris diomedea, fledglings from the Azores, Portugal. Bulletin of Environmental Contamination and Toxicology, 58: 115-122. Traveset, A., Nogales, M., Alcover, J. A., Delgado, J. D., López-Darias, M., Godoy, D., Igual, J. M., Bover, P. (2009). A review on the effects of alien rodents in the Balearic (Western Mediterranean Sea) and Canary Islands (Eastern Atlantic Ocean). Biological Invasions, 11: 1653-1670. Zino, F., Hounsome, M. V., Buckle, A. P., Biscoito, M. (2008). Was the removal of rabbits and house mice from Selvagem Grande beneficial to the breeding of Cory's shearwaters Calonectris diomedea borealis? Oryx, 42: 151-154.
José Manuel de los Reyes González y Jacob González-Solís Bou Fecha de publicación: 28-11-2016 Otras contribuciones: 1. Alfredo Salvador. 28-11-2016 Reyes-González, J. M., González-Solís, J. (2016). Pardela cenicienta atántica - Calonectris borealis. En: Enciclopedia Virtual de los Vertebrados Españoles. Salvador, A., Morales, M. B. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
|
|
|
|
|
|
|