|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Para más información sobre cada apartado hacer click en:
|
Key words: Pygmy newt, identification, measurements, geographic variation.
OrigenEl género Triturus podría haber aparecido durante el periodo Eoceno, donde se encuentran restos de ejemplares con características algo diferentes a las especies actuales (Hecht y Hoffstetter, 1962; Milner et al., 1982). Posteriormente, entre los periodos Eoceno y Oligoceno (hace unos 40 millones de años) se pudieron diferenciar los géneros Triturus (Neotriton) y Lissotriton (Paleotriton) según algunos análisis morfométricos (González y Sanchiz, 1986). El registro fósil claramente atribuible al género Triturus, se remonta a los periodos Mioceno y Plioceno con formas similares a las actuales (Estes, 1981). Se ha estimado que a finales el Mioceno se produjo la divergencia de Triturus pygmaeus (y T. marmoratus) de otros grupos del género Triturus (Carranza y Amat, 2005). Este taxón ha sido tradicionalmente considerado como una subespecie de Triturus marmoratus que se distribuye por el oeste de Francia y norte de la Península Ibérica; sin embargo, algunos estudios morfológicos, osteológicos, inmunológicos y enzimáticos ponían en evidencia diferencias importantes similares a las encontradas entre otras especies del género Triturus (Dorda y Esteban, 1986; Busack et al., 1988), lo que sugirió que deberían ser consideradas especies diferentes (García-Paris et al., 1993). Posteriormente, estudios más finos basados en la caracterización molecular de individuos pertenecientes a zonas de contacto de los dos taxones (sierras de Guadarrama y Gata en el Sistema Central), revelaron claras diferencias específicas (García-Paris et al., 2001). Las diferencias morfológicas encontradas entre ambas poblaciones coincidían con las diferencias encontradas en los patrones de corte obtenidos en una región del citocromo b del ADN mitocondrial con la enzima de restricción MVN-1 (García-Paris et al., 2001). Por todo ello, en la actualidad se consideran especies diferentes. El proceso de especiación que separó las especies T. pygmaeus y T. marmoratus se produjo hace aproximadamente 1,7 millones de años, a comienzos del Pleistoceno (Carranza y Amat, 2005). La distribución actual de ambas especies podría indicar que el Sistema Central, el río Tajo o ambos podrían haber actuado como barrera geográfica interrumpiendo el contacto de ambas formas y diferenciarse posteriormente por procesos de vicarianza (Carranza y Amat, 2005). La distribución de T. marmoratus y T. pygmaeus en 25 sitios acuáticos de reproducción en la zona de Caldas da Rainha (centro oeste de Portugal) es parapátrica, sin poblaciones mezcladas ni híbridos interespecíficos lo que demuestra que están genéticamente aisladas y tienen estatus de especie (Themudo y Arntzen, 2007a).1 En la región litoral de Portugal el flujo de genes es unidireccional desde T. pygmaeus hacia T. marmoratus. El río Tajo no supone una barrera efectiva para el flujo de genes de T. pygmaeus. La Sierra de Gata podría representar una barrera pues allí es donde es menor el flujo de genes (Espregueira Themudo et al., 2012)4.
Descripción del adulto Este urodelo de mediano tamaño posee una cabeza algo más larga que ancha y ligeramente aplanada dorso-ventralmente. Desde la base del tronco se va estrechando levemente hasta la altura de los ojos, donde empieza la mandíbula que es corta y redondeada. Los ojos son algo prominentes y tienen una pupila circular de color negro e iridiscencias metalizadas de colores amarillos, dorados o cobrizos con puntos y pequeñas manchas negras. Las glándulas parotídeas y el pliegue gular son patentes. La cabeza es algo más ancha en hembras que en machos (en individuos pertenecientes a varias poblaciones de Sierra Morena Central: anchura de cabeza de machos: 9,24 ± 0,45 mm (n = 35) y de hembras: 10,17 ± 0,61 mm (n = 26) (R. Reques, datos no publicados). Las extremidades son relativamente largas y delgadas y terminan en dedos también largos y sin membranas interdigitales o palmeaduras. La piel cuando están en tierra es algo áspera y rugosa pero en el agua se vuelve brillante y algo más tersa. El color del dorso es verde con manchas entre negras y marrones de formas y tamaños irregulares que con frecuencia se fusionan. Presentan un fino granulado y punteado negro que puede llegar a ser rojo oscuro, especialmente cerca de la cabeza. El color verde del dorso con frecuencia pasa a ser pardusco al llegar a la zona de contacto con el vientre. Una línea muy característica aparece en el centro de la zona dorsal. En hembras e individuos jóvenes es de color naranja más o menos intenso. Los machos presentan una línea que alterna colores oscuros y anaranjados que, en la época de celo, despliegan formando una cresta. La cola es aproximadamente igual de larga, o algo menor, que la longitud de la cabeza y cuerpo juntos. Su sección en la base es ovalada y se va comprimiendo lateralmente haciéndose más aplanada para terminar en punta. La base de la cola está recorrida por una banda oscura seguida de otra banda clara, de color blancuzco o casi plateado que puede tener algún punteado negro y por encima de ésta continúa el diseño verde jaspeado de negro del dorso. La zona ventral es de color blanquecino, amarillento con tonos anaranjados o grisáceos con manchas negras y blancas. Las machas oscuras ventrales son de mayor tamaño en los machos que en las hembras, especialmente en los flancos. Este patrón de coloración se presenta desde la cloaca hasta el extremo del hocico, incluyendo la zona gular (Herrero et al., 2003;3 García-París et al., 2004). Se ha citado en Jimena de la Frontera (Cádiz) un macho parcialmente albino (Romero y Real, 2007).2 Se ha encontrado en una charca de los alrededores de La Barca de la Florida (Cádiz) una larva completamente albina (Busack, 2014)5. Las hembras son de mayor tamaño que los machos. La longitud total oscila entre 90 y 125 mm (García-Paris et al., 2004) aunque pueden llegar a alcanzar los 140 mm (González de la Vega, 1988). Hay una variación de tallas entre poblaciones, siendo las de Doñana, las de menor tamaño. La longitud corporal media es 42,3 mm (75,6 mm de longitud total) en machos y 43,9 mm (79,0 mm de longitud total) en hembras (Díaz Paniagua, 1996). En el apartado que trata las variaciones geográficas de esta especie se dan más detalles sobre los tamaños encontrados en diferentes poblaciones. Durante el periodo de reproducción se producen cambios morfológicos que son especialmente patentes en los machos. En ambos sexos el color de la piel es más brillante y los pliegues labiales se desarrollan más (Salvador, 1974). Las hembras, de mayor tamaño que los machos, presentan una cloaca anaranjada y de menor tamaño que la de los machos (Figura 1). Cuando están en el periodo de vitelogénesis su abdomen se abulta y es fácil de observar los ovocitos por transparencia (Reques, 2000). Los machos, más estilizados que las hembras, desarrollan una cresta dorsal prominente y continua hasta la cola (con una ligera inflexión marcada en la zona pélvica) en la que se alternan en bandas estrechas de color negro y de color claro blancuzco o amarillento (Figura 2). En los machos las manchas oscuras del vientre son de mayor tamaño que las de las hembras. La cloaca es muy abultada y de color oscuro, casi negro. Este color se extiende a lo largo de toda la base de la cola que se hace más ancha. Paralela a esta franja, discurre otra de color claro y por encima otra estrecha franja con el mismo diseño dorsal incluyendo la cresta. En la Tabla 1 se describen algunas variables morfológicas medidas en una población de Sierra Morena Central y su relación con el peso de los individuos.
Tabla 1. Variables morfológicas medidas en una población de Sierra Morena Central y su relación con el peso de los individuos. Media, desviación típica (DT), correlaciones de Spearman (rs) y probabilidad asociada (P) en un total de 35 machos respecto al peso (Peso x = 5.128 + 0.926; N=35); R. Reques, datos no publicados.
Figura 1. Diferencias entre las cloacas de hembras (izquierda) y machos (derecha). © R. Reques.
Figura 2. Tritón pigmeo macho en celo. Pueden observarse las crestas completamente desarrolladas, el abultamiento de la cloaca y la anchura de la cola. Individuo de una población de la Sierra del Aljibe, Cádiz. © R. Reques.
Descripción de huevos y larvas Los huevos son de color blancuzco o amarillento rodeados de una capa gelatinosa transparente. Las hembras los ponen individualmente en hojas de plantas sumergidas envolviéndolos con ayuda de sus patas traseras. Cuando se desprenden de la envoltura del huevo, las larvas miden entre 5 y 11 mm. En ese momento son de color claro, blancuzco o amarillento con finos punteados negros que generalmente conforman líneas longitudinales. Presentan unos finos filamentos a ambos lados de la cabeza llamados balancines que sirven para mantener el equilibrio en la natación, branquias poco desarrolladas y los dos miembros anteriores igualmente poco desarrollados (González de la Vega, 1988; Salvador y García-Paris, 2001; Grossenbacher, 2004;3 Díaz Paniagua et al., 2005). A los pocos días desaparecen los balancines y se forma una cresta dorso-caudal que empieza detrás de la cabeza y que se ensancha hacia atrás con unas manchas oscuras y redondeadas. Esta cresta, que es traslúcida moteada con manchas oscuras, se prolonga hacia la cola que termina con un filamento en el extremo. En este momento las branquias también crecen y se hacen plumosas, así como las patas, desarrollándose primero las anteriores y progresivamente las posteriores. Las extremidades son finas y largas y terminan en unos característicos dedos largos. Con cierta frecuencia pueden sufrir amputaciones de estas partes que son las más expuestas por ataques de depredadores u otras larvas de tritón en luchas territoriales. Se han descrito individuos con características neoténicas (Gutiérrez Titos et al., 2007; Ceacero et l., 2010; Fuentes et al, 2011). Antes de alcanzar la metamorfosis, van adquiriendo una coloración oscura y el jaspeado característico de su forma terrestre. Los juveniles tienen un color brillante con un verde muy vivo y una línea naranja muy marcada en el dorso.
Figura 3. Huevos de tritón individualizados en hojas de plantas sumergidas. © R. Reques.
Figura 4. Embrión de tritón en el envés de una hoja con forma lanceolada. © R. Reques.
Figura 5. Embrión con restos de envuelta gelatinosa justo antes de desprenderse de ella y pasar a tener una vida nadadora. © R. Reques.
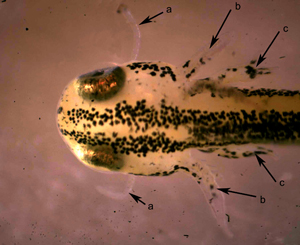
Figura 6. Detalle de larva de tritón al desprenderse del huevo: a) balancines; b) branquias y c) miembros anteriores. © R. Reques.
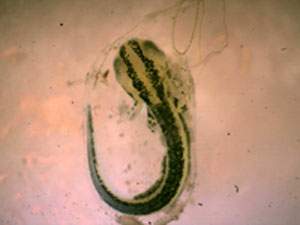
Figura 7. Larva de tritón pigmeo en la que pueden apreciarse algunos de los rasgos definitorios. © R. Reques.
Figura 8. Aspecto del una larva de tritón pigmeo en el agua, donde pueden apreciarse las branquias desarrolladas, los largos dedos de las extremidades delanteras y la cola terminada en punta. © Ricardo Reques.
Figura 9. Juvenil de tritón a los pocos días de haber pasado la metamorfosis. © R. Reques.
Características genéticas Se han caracterizado 13 loci microsatélites polimórficos (Albert y Godoy, 2011)4.
Variación geográfica Existen diferencias en cuanto al tamaño de individuos adultos entre poblaciones así como en el diseño y patrones de coloración dorsal y ventral. En Doñana tanto los machos como las hembras tienen un tamaño menor (Tabla 2). Precisamente, en la población de Doñana se han encontrado pequeños cambios en los pares cromosómicos 12 y 10 (García-Paris et al., 2004), siendo éstas las únicas diferencias encontradas en los patrones de bandeado cromosómico hasta el momento. Otros estudios filogenéticos se han realizado en Portugal, encontrando diferencias entre las poblaciones de Mora y Zebreira (Sequeira et al., 2006).
Tabla 2. Variación de tamaño (longitud total media en mm.) entre localidades para machos y hembras.
También se han descrito diferencias en el patrón de diseño dorsal en poblaciones de Cáceres, Ciudad Real, Toledo y Madrid con pequeñas y abundantes manchas redondas de color negro sobre fondo verde que nunca llegan a fusionarse. Además, estas poblaciones presentan hocicos más redondos y dedos relativamente más cortos que el resto de las poblaciones de tritón pigmeo descritas (García-Paris, 2004).
Referencias Albert, E. M., Godoy, J. A. (2011). Characterization of 13 microsatellite loci for the Pygmy Marbled Newt Triturus pygmaeus (Salamandridae). Conservation Genetics Resources, 3 (4): 745-747. Busack, S. D. (2014). Complete albinism in a larval Triturus pygmaeus. Boletín de la Asociación Herpetológica Española, 25 (1): 15. Busack, S. D., Jericho, B.G., Maxxon, L.R., Uzzell, T. (1988). Evolutionary relationships of salamanders in the genus Triturus: The view from inmunology. Herpetologica, 44: 307-316. Caetano, M. H., Castanet. J. (1990).Variability and microevolutionary patterns in Triturus marmoratus from Portugal: age, size, longevity and individual growth. Ampbibia-Reptilia, 14:117-129. Carranza, S., Amat, F. (2005). Taxonomy, biogeography and evolution of Euproctus (Amphibia: Salamandridae), with the resurrection of the genus Calotriton and the description of a new endemic especies from the Iberian Peninsula. Zoological Journal of the Linnean Society, 145: 555–582. Ceacero, F., Donaire-Barroso, D., García-Muñoz, E., Beltrán, J. F., Tejedo, M. (2010). On the occurrence of facultative paedomorphosis in the three newt species of Southern Iberian Peninsula (Amphibia, Salamandridae). Amphibia-Reptilia, 31 (4): 571-575. Díaz-Paniagua C. Mateo, J.A., Andreu, A. (1996). Age and size structure of small marbled newt populations (Triturus marmoratus pygmaeus) from Doñana Nacional Park (SW Spain). A case of dwarfism among dwarfs. J. Zool. Lond., 239: 83-92. Díaz-Paniagua, C. Gómez-Rodríguez C., Portheault, A., de Vries, W. (2005). Los anfibios de Doñana. Naturaleza y Parques nacionales. Serie Técnica. Organismo Autónomo Parques Nacionales. Ministerio de Medio Ambiente. Dorda, J., Esteban, M. (1986). Evolution and subespeciation of Iberian Triturus marmoratus. Pp. 159-163. En: Rocek, Z. (Eed.). Studia Herpetologica. Charles University, Prague. Espregueira Themudo, G., Nieman, A. M., Arntzen, J. W. (2012). Is dispersal guided by the environment? A comparison of interspecific gene flow estimates among differentiated regions of a newt hybrid zone. Molecular Ecology, 21 (21): 5324-5335. Estes, R. (1981). Gymnophiona, Caudata. En: Kuhn. O. (Ed.). Handbuch der Palaeoherpetologie. Vol 2. Gustav Fischer Verlag. Stuttgart. Fuentes, J., García-Cardenete, L., Escoriza, E., Esteban, J. L., Benavides, J. (2011). Neotenia en Triturus pygmaeus. Observación en el sur de Jaén. Boletín de la Asociación Herpetológica Española, 22: 96-98. García-Paris, M. Montori, A., Herrero, P. (2004). Amphibia, Lissamphibia. En: Fauna Ibérica, vol. 24. Ramos M. A. et al. (Eds). Museo Nacional de Ciencias Naturales. CSIC. Madrid. 640 pp. García-Paris, M., Arano, B., Herrero, P. (2001). Molecular characterization of the contact zones between Triturus pygmaeus and T. marmoratus (Caudata: Salamandridae) in Central Spain and their taxonomic assessment. Rev. Esp. Herp., 15: 115-126. García-Paris, M., Herrero, P., Martín, C., Dorda, J., Esteban, M., Arano, B. (1993). Morphological characterization, crytogenetic analysis and geographical distribution of the Pygmy marbled newt Triturus marmoratus pygmaeus (Wolf, 1905)(Caudata, Salamandridae). Bijdragen tot de Dierkunde, 63: 3-14. González de la Vega, J. P. (1988). Anfibios y Reptiles de la provincia de Huelva. Ertisa, Huelva. 238 pp. González, J. E., Sanchíz, B. (1986). Consideraciones metodológicas sobre el análisis evolutivo: el caso de los morfotipos vertebrales actuales y fósiles del género Triturus (Caudata, Salamandridae). Estudios Geológicos, 42: 479-486. Gutiérrez Titos, J. M., García-Cardenete, L., Fuentes, J., Escoriza Abril, E. (2007). Tritón pigmeo (Triturus pygmaeus). En: Proyecto Sierra de Baza. http://www.sierradebaza.org/Fichas_fauna/00_Anfibios/05-04_triton-pigmeo/triton_pigmeo.htm Hecht, M., Hoffstetter, R. (1962). Note preliminaire sur les amphibians et les squamates du Landénien Supérieur et du Tongrien de Belgique. Bulletin de I´Institute Royal des Sciences Naturelles de Belgique, 38: 1-30. Herrero, P., Montori, A., Arano, B. (2003). Triturus pygmaeus (Wolterstorff, 1905) – Südlicher Marmormolch. Pp. 543-553. En: Thiesmeier, B., Grossenbacher, K. (Eds.). Handbuch der Reptilien und Amphibien Europas. Band 4/II A. Schwanzlurche (Urodela). II A. Salamandridae II: Triturus 1. Aula-Verlag, Wiebelsheim. Milner, A.C., Milner, A.R., Estes, R. (1982). Amphibians and Squamates from the Upper Eocene of Hordle Cliff, Hampshire. A preliminary report. Tertiary Research, 4: 149-154. Reques, R. (2000). Anfibios. Ecología y conservación. Serie Recursos Naturales de Córdoba. Diputación de Córdoba. Delegación de medio Ambiente y Protección Civil. 140pp. Romero, D., Real, R. (2007). Albinismo parcial de un macho de Triturus pygmaeus (Wolterstorff, 1905). Boletín de la Asociación Herpetológica Española, 18: 93. Salvador, A. (1974). Guía de los anfibios y reptiles españoles. ICONA, Madrid. Salvador, A., García-París, M. (2001). Anfibios Españoles. Canseco Editores, Talavera de la Reina. Sequeiro, F. Ferrand, N., Harris, D. J. (2006). Assessing the phylogenetic signal of the nuclear β-Fibrinogen intron 7 in salamandrids (Amphibia: Salamandridae). Amphibia-Reptilia, 27: 409-418. Themudo, G. E., Arntzen, J. W. (2007a). Molecular identification of marbled newts and a justification of species status for Triturus marmoratus and T. pygmaeus. Herpetological Journal, 17 (1): 24-30.
Ricardo Reques Rodríguez Fecha de publicación: 17-04-2007 Otras contribuciones: 1. Alfredo Salvador. 18-12-2007; 2. Alfredo Salvador. 25-03-2008; 3. Alfredo Salvador. 31-03-2009; 4. Alfredo Salvador. 24-07-2014; 5. Alfredo Salvador. 31-10-2014 Reques, R. (2014). Tritón pigmeo - Triturus pygmaeus. En: Enciclopedia Virtual de los Vertebrados Españoles. Salvador, A., Martínez-Solano, I. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||