|
|
|
|
|
|
Para más información sobre cada apartado hacer click en:
|
Keywords: Sharp-ribbed newt, identification, measurements, geographic variation.
Sinónimos y combinaciones Pleurodeles waltl Michahelles, 1830; Triton costatus Wagler, 1830; Salamandra major Gray, 1831; Salamandra fenestrata Gray, 1831; Salamandra pleurodeles Schlegel, 1837; Bradybates ventricosus Tschudi, 1838; Pleurodeles waltlii - Waltl, 1839; Pleurodeles waltelei - Schinz, 1840; Pleurodeles watlii - Duméril, Bibron y Duméril, 1854; Pleurodeles exasperatus Duméril, Bibron y Duméril, 1854; Pleurodeles waltli - Wiedersheim, 1877; Triturus waltli - Boulenger, 1878; Molge waltlii - Boulenger, 1882; Triton pleurodelus Schulze, 1891; Triton waltlii - Wolterstorff, 1901; Triton waltli - Gadow, 1901; Pleurodeles waltl – Dunn, 1918 (Frost, 2014).
Origen Análisis basados en el estudio de haplotipos mitocondriales indican que la distribución del género Pleurodeles se puede explicar por dispersión múltiple (de Europa a África y viceversa) y aislamiento posterior. Pleurodeles debió alcanzar el norte de África a través de la región Bética, una vez que ésta se separó de la Península Ibérica y se unió con el norte de África hace unos 14 millones de años. El aislamiento subsiguiente provocó que se diferenciaran P. waltl en la Península Ibérica y P. poireti en el norte de Africa. P. waltl se dispersó de Europa a África cuando se cerró el estrecho de Gibraltar durante el período Messiniense, al final del Mioceno (6,9-4,3 millones de años) (Veith et al., 2004). Otros autores plantean un escenario diferente (Carranza y Arnold, 2004). Según estos autores, Pleurodeles se diferenció de Tylotriton hace unos 8,6-10 millones de años. Pleurodeles probablemente invadió el NW de África durante la crisis de salinidad del Messiniense, hace unos 5,6-5,3 millones de años, diferenciándose P. poireti por aislamiento hace unos 5,3 millones de años.
Descripción del adulto Especie muy grande, su longitud total puede alcanzar 312 mm en machos y 286 mm en hembras. La longitud de la cola varía entre el 46,3 y el 55% de la longitud total (González de la Vega, 1988). Cabeza muy aplastada dorso-ventralmente, con ojos pequeños. Cola comprimida lateralmente. Pliegue gular presente. Piel verrugosa, con tubérculos terminados en punta negra. Crestas caudales pequeñas, algo desarrolladas durante la reproducción. Coloración parda olivácea o gris con manchas negruzcas irregulares. En cada costado hay una hilera de 7 a 10 manchas anaranjadas o amarillentas. Vientre algo más claro, con tonos amarillos o anaranjados y algunas manchas oscuras (García-París, 1985; Salvador y García-París, 1999, 2001; Van der Meijden, 2002; García-París et al., 2004). Se han citado casos de albinismo parcial (Fontanet et al., 1992; Villodre et al., 2009). En Cádiz se encontraron 6 larvas albinas con los ojos rojos, en El Campillo (Huelva) un albino con eritróforos, en las cercanías de Chiclana de la Frontera varios adultos y larvas sin coloración y en las proximidades de la Barca de la Florida (Cádiz) una larva leucística (Busack y Donaire, 2014). Se han citado en Tortosa un albino con eritróforos, cerca del aeropuerto de Sevilla un albino con xantóforos y un individuo sin coloración en la Venta de los Alazores (Granada) (Guillem et al., 2009). La piel contiene tres tipos de glándulas cutáneas. Uno de ellos son las glándulas mucosas, que tienen un tamaño relativamente pequeño. Las glándulas serosas son de dos tipos granulares. En uno, el tamaño es moderado y se distribuyen por todo el cuerpo, especialmente en la región parotídea y el dorso. El otro tipo es de gran tamaño y se encuentran en la cola, especialmente en su parte superior. Ambos tipos se concentran en aquellas partes del cuerpo que se dirigen hacia un depredador potencial. Su función parece ser producir sustancias repelentes o venenosas para disuadir a los depredadores (Gogorza, 1909; Gogorza y González, 1910; Heiss et al., 2009). Los machos tienen la cola relativamente más larga y los miembros anteriores más desarrollados que las hembras. Durante el periodo reproductivo, los machos desarrollan rugosidades negruzcas en la cara interna de los miembros anteriores y palma de la mano que le permiten sujetar mejor a la hembra durante el cortejo. Cloaca de aspecto papilar en machos y con rebordes dirigidos hacia dentro en hembras (García-París, 1985; Salvador y García-París, 1999, 2001; Van der Meijden, 2002). Una descripción detallada del esqueleto se encuentra en Wierdersheim (1880). Datos adicionales y referencias en Salvador y García Paris (1999).
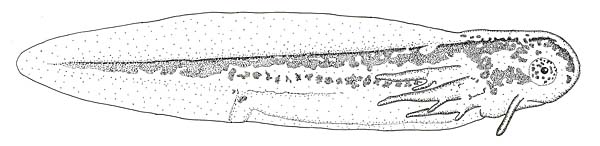
Descripción de la larva
Figura 1. Larva recién nacida. Longitud total, 10,5 mm. © A. Salvador.
Figura 2. Larva desarrollada. © Iñigo Martínez-Solano.
Posee balancines al nacer (Fig. 1). Larva con crestas muy desarrolladas (Fig. 2). La cresta dorsal tiene su comienzo anterior al principio del cuerpo. Las crestas caudales se estrechan progresivamente hacia el extremo de la cola terminando en punta aguda sin filamento o saliente apical. Cuerpo de color pardusco o grisáceo, más o menos oscuro, con pequeñas manchas negras o grises y reflejos verdosos. Eje de las branquias con reflejos metálicos (Díaz-Paniagua y López-Jurado, 1981; García-París, 1985; Salvador y García-París, 2001; García-París et al., 2004).
Biometría y peso En Doñana, la longitud de cabeza y cuerpo mide 81,8 mm de media en machos (rango= 37,4 – 108 mm ; n= 72) y 77,5 mm de media en hembras (rango= 38 – 123 mm ; n= 58). La longitud total mide 78,22 mm de media en machos (rango= 75,8 – 80,4 mm ; n= 72) y 142 mm de media en hembras (rango= 71 – 235,7 mm ; n= 58). El peso es 25,8 g de media en machos (rango= 1,5 – 52,3 g ; n= 72) y 24,6 g de media en hembras (rango= 1,2 – 87,2 g ; n= 58). Ejemplares capturados en fase terrestre (n= 32) miden de media 56,3 mm de longitud del cuerpo, 100,1 mm de longitud total y 6,3 g de peso. Ejemplares capturados en fase acuática (n= 101) miden de media 85,7 mm de longitud del cuerpo y su peso medio es 28,5 g (Díaz-Paniagua et al., 2005).
Variación geográfica No se ha estudiado con detalle la variabilidad morfológica y de coloración de las poblaciones ibéricas. Las poblaciones marroquíes tienen talla algo menor y crestas caudales más desarrolladas pero durante un período menor. (Pasteur, 1958; Pasteur y Bons, 1959). La comparación entre poblaciones de ambos lados del estrecho de Gibraltar utilizando métodos electroforéticos mostró escasas diferencias entre ambas, sugiriendo que ha continuado el intercambio genético entre poblaciones después de la apertura del estrecho. La propagación pasiva de ejemplares podría haber ocurrido a través de la vegetación flotante movida por las corrientes superficiales que van de España a Marruecos (Busack, 1986). La distribución geográfica de haplotipos mitocondriales separa por un lado un clado en el centro, norte y oeste de la Península Ibérica. Por otro lado hay otro clado distribuído por Marruecos y el este y sur de la Península Ibérica, con un haplotipo presente a ambos lados del estrecho de Gibraltar. Estos datos unidos a la amplia distribución ibérica de haplotipos de tipo norteafricano y la presencia en el este y sur peninsular de haplotipos ibéricos exclusivos señala que el intercambio a ambos lados del estrecho parece deberse a dispersión pasiva en épocas recientes (Batista et al., 2004; Veith et al., 2004; Carranza y Arnold, 2004). La bifurcación en los dos clados parece haber tenido lugar en el Plioceno, hace unos 3,2 - 2 millones de años (Carranza y Arnold, 2004). Las poblaciones situadas al sur del río Mira en el suroeste de Portugal forman un tercer clado que se formó por aislamiento geográfico del clado occidental (Van de Vliet et al., 2014). Se han descrito 14 microsatélites altamente polimórficos (Van De Vliet et al., 2009). Gutiérrez-Rodríguez et al. (2014) han descrito otros 12 microsatélites.
Referencias Batista, V., Harris, D. J., Carretero, M. A. (2004). Genetic variation in Pleurodeles waltl Michahelles, 1830 across the Strait of Gibraltar derived from mitochondrial DNA sequences. Herpetozoa, 16 (3-4): 166-168. Busack, S. D. (1986). Biogeographic analysis of the herpetofauna separated by the formation of the Strait of Gibraltar. National Geographic Reearch, 2: 17-36. Busack, S. D., Donaire, D. (2014). Albinism in Pleurodeles waltl. Boletín de la Asociación Herpetológica Española, 25 (1): 12-14. Carranza, S., Arnold, E. N. (2004). History of West Mediterranean newts, Pleurodeles (Amphibia: Salamandridae), inferred from old and recent DNA sequences. Systematics and Biodiversity, 1 (3): 327-337. Díaz-Paniagua, C., Gómez-Rodríguez, C., Portheault, A., de Vries, W. (2005). Los anfibios de Doñana. Naturaleza y parques nacionales. Serie técnica. Organismo Autónomo Parques Nacionales, Madrid. 181 pp. Díaz-Paniagua, C., López-Jurado, L. F. (1981). Notas sobre las larvas de urodelos de la mitad sur de la Península Ibérica: caracteres diferenciadores y desarrollo. Boletín de la Estación Central de Ecología, 10: 27-34. Fontanet, X., Montori, A., Llorente, G. A., García-Serra, N., Carretero, M. A., Santos, X., Llorente, C. (1992). Pleurodeles waltl (Iberian Newt). Albinism. Herpetological Review, 23: 79. Frost, D. R. (2014). Amphibian Species of the World: an Online Reference. Version 6.0. http://research.amnh.org/herpetology/amphibia/index.html. American Museum of Natural History, New York, USA. García-París, M. (1985). Los anfibios de España. Ministerio de Agricultura, Pesca y Alimentación, Madrid. García-París, M., Montori, A., Herrero, P. (2004). Amphibia. Lissamphibia. En: Ramos Sánchez, M. A., et al. (Eds.). Fauna Ibérica. Vol. 24. Museo nacional de Ciencias Naturales, Madrid. Gogorza, J. (1909). Estudio anatómico de la piel del gallipato (Pleurodeles Waltlii, Mich.), Memorias de la Real Sociedad Española de Historia Natural, 6: 67-103, 3 láminas. Gogorza y González, J. (1910). Las glándulas cutáneas del gallipato (Pleurodeles waltlii, Mich.). Asociación Española para el Progreso de las Ciencias. Congreso de Zaragoza. Tomo IV. Primera parte. Sección 3ª- Ciencias Naturales: 5-15, 3 láminas. González de la Vega, J. P. (1988). Anfibios y reptiles de la provincia de Huelva. Ertisa, Huelva. Guillem, G., Gómez, D., Roig, J. (2009). Nou cas de Pleurodeles waltl Michahelles, 1830 (Caudata; Salamandridae) albí a Tortosa (Baix Ebre – Catalunya). Butlletí de la Societat Catalana d’Herpetologia, 18: 116-120. Gutiérrez-Rodríguez, J., González, E. G., Martínez-Solano, I. (2014). Development and characterization of twelve new polymorphic microsatellite loci in the Iberian ribbed newt, Pleurodeles waltl (Caudata: Salamandridae), with data on cross-amplification in P. nebulosus. Amphibia-Reptilia, 35 (1): 129-134. Heiss, E., Natchev, N., Rabanser, A., Weisgram, J., Hilgers, H. (2009). Three types of cutaneous glands in the skin of the salamandrid Pleurodeles waltl. A histological and ultrastructural study. Journal of Morphology, 270 (7): 892-902. Pasteur, G. (1958). Sur la systematique des èspeces du genre Pleurodeles (Salamandridés). Bull. Soc. Sci. Nat. Phys. Maroc, 38: 157-165. Pasteur, G., Bons, J. (1959). Les batraciens du Maroc. Trav. Inst. Sci. Cherif., Ser. Zool., 17: 1-241. Salvador, A., García-París, M. (1999). Pleurodeles waltl (Michahelles, 1830) - Rippenmolch. Pp. 209-228. En: Grossenbacher, K., Thiesmeier, B. (Eds.). Band 4/I: Schwanzlurche (Urodela) I (Hynobiidae, Proteidae, Plethodontidae, Salamandridae I). En: Böhme, W. (Ed.). Handbuch der Reptilien und Amphibien Europas. Aula, Wiebelsheim. Salvador, A., García-París, M. (2001). Anfibios españoles. Identificación, historia natural y distribución. Canseco Editores, Talavera de la Reina. Van der Meijden, A. (2002). Pleurodeles waltl. En: AmphibiaWeb: Information on amphibian biology and conservation. Berkeley, California. Van de Vliet, M., Diekmann, O., Machado, M., Beebee, T. J. C., Beja, P., Serrao, E. A. (2014). Genetic Divergence for the Amphibian Pleurodeles waltl in Southwest Portugal: Dispersal Barriers Shaping Geographic Patterns. Journal of Herpetology, 48 (1): 38-44. Van De Vliet, M. S., Diekmann, O. E., Serrao, E. A., Beja, P. (2009). Isolation of highly polymorphic microsatellite loci for a species with a large genome size: sharp-ribbed salamander (Pleurodeles waltl). Molecular Ecology Resources, 9 (1): 425-428. Veith, M., Mayer, C., Samraoui, B., Donaire Barroso, D., Bogaerts, S. (2004). From Europe to Africa and viceversa: evidence for multiple intercontinental dispersal in ribbed salamanders (Genus Pleurodeles). Journal of Biogeography, 31: 159-171. Villodre A., Villodre J., Ceacero F. (2009). Pleurodeles waltl (Spanish ribbed newt). Albinism. Wiedersheim, R. (1880). Das Skelett von Pleurodeles Waltlii. Jenaische Zeitschrift für Naturwissenschaft, 14: 25-38.
Alfredo Salvador Museo Nacional de Ciencias Naturales (CSIC)
Fecha de publicación: 26-11-2002
Revisiones: 9-03-2004; 16-07-2004; 14-12-2004; 27-11-2006; 18-03-2009; 26-03-2009; 22-06-2009; 3-08-2011; 6-10-2014
Salvador, A. (2015). Gallipato - Pleurodeles waltl. En: Enciclopedia Virtual de los Vertebrados Españoles. Salvador, A., Martínez-Solano, I. (Eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
|
|
|
|
|
|
|